24 Августа 2021
Спинальная мышечная атрофия
СМА (спинальная мышечная атрофия) – это группа генетических заболеваний, при которых развивается потеря или гибель двигательных нейронов в спинном мозге. Характерным признаком является нарушение работы поперечно-полосатой мускулатуры ног, головы и шеи. Мышцы рук не страдают, чувствительность сохранена, интеллектуальное развитие не нарушено.
Лечения с доказанной эффективностью не существует. Пациенту назначают поддерживающую терапию, специальное питание. Потаба против мышечной атрофии показана в качестве дополнительного источника витамина В.
Причина СМА
СМА – наследственное заболевание, оно связано с мутациями в гене SMN1.
Чтобы болезнь проявилась, носителями мутации в этом гене должны быть оба родителя. Рецессивный ген СМА имеет примерно каждый 40-й. Вероятность рождения больного ребенка от двух носителей – 25%, с такой же вероятностью ребенок двух носителей не будет иметь генной поломки. Ещё в 50% случаев он будет носителем СМА, но сам не заболеет.
В редких случаях (менее 2%) больные дети рождаются в семьях, где носителем является только один родитель. У второго родителя мутация гена происходит при закладке яйцеклетки или сперматозоида.
Если вашему ребенку диагностировали СМА, я хочу поговорить с вами
Что повреждается в результате мутации
Из-за дефектного гена в организме нарушается выработка белка SMN – протеина выживаемости мотонейронов. Без этого белка мотонейроны – нервные клетки спинного мозга, отвечающие за координацию движений и мышечный тонус – отмирают, сигнал в мышцы ног, спины и отчасти рук не идёт.
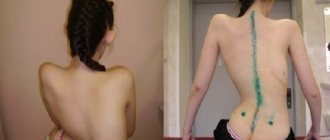
Без необходимого тонуса мышцы постепенно атрофируются. Отсутствие мышц пресса и спины приводит, кроме прочего, к обширным искривлениям позвоночника, а они – к проблемам с дыханием, которые из-за слабых мышц и так есть.
Болезнь может проявляться с первых месяцев жизни или в более позднем возрасте.
Изображение с сайта bfm.my
От чего зависит степень тяжести болезни
За выработку белка SMN отвечают два гена – SMN1 и SMN2.
При этом SMN1 – основной «заказчик» данного белка, а SMN2 – дополнительный, он вырабатывает белок в количестве, недостаточном для нормальной работы организма. В случаях, когда в геноме человека SNM1 отсутствует, SNM2 начинает выполнять замещающие функции, но никогда не может полностью восполнить недостачу.
Копий SMN2 в геноме бывает до восьми. От имеющегося у человека числа копий SMN2 и зависит тяжесть состояния больного. Такой сложный механизм болезни приводит к тому, что СМА имеет несколько форм, и состояние больных – очень разное.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Партнер номинации — медицинская .
Генеральный спонсор конкурса — : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Рисунок 1. Внутреннее строение спинного мозга. 1 — задние рога спинного мозга; 2 — боковые рога; 3 — передние рога; 4 — центральный канал; 5 — центральное промежуточное вещество; 6 — задняя центральная борозда; 7 — задняя боковая борозда; 8 — передняя центральная щель; 9 — задние канатики; 10 — боковой канатик; 11 — передний канатик.
[1]
Сегодня науке известно огромное количество генетических заболеваний, терапия которых представляет серьезную проблему. Одним из них является СМА. Спинальная мышечная атрофия относится к орфанным, то есть редким, генетическим заболеваниям. Для нее характерна постепенная дегенерация α-моторных нейронов передних рогов спинного мозга. Анатомическое расположение передних рогов спинного мозга представлено на рисунке 1 [1].
Альфа-мотонейроны иннервируют экстрафузальные мышечные волокна, которые ответственны за сокращение скелетной мускулатуры. Схематически взаимосвязь нейронов и мышечных волокон представлена на рисунке 2.
Рисунок 2. Взаимодействие мотонейронов и мышц. 1 — большой альфа-нейрон; 2 — гамма-нейрон; 3 — малый альфа-нейрон; 4 — мышца; 5 — проприоцептор; 6 — корковоспинномозговой путь; 7 — ретикулярноспинномозговой путь; 8 — нисходящие пути экстрапирамидной системы; 9 — спинномозговой узел.
[2]
Как видно из рисунка, для поддержания тонуса мышц и их сокращения необходима слаженная работа многих компонентов нейронной сети и мышечных волокон [2]. При СМА один из этих компонентов перестает выполнять свою функцию, что приводит в конечном итоге к мышечной атрофии.
Как правило, СМА связана с потерями участка хромосомы или точечными мутациями гена SMN1 (survival motor neuron, или ген выживаемости мотонейронов) [3]. Хотя существуют и еще более редкие формы спинальной мышечной атрофии, не связанные с мутациями SMN1, в данной статье речь пойдет только о «классической» СМА, или 5qСМА, — данное название связано с тем, что мутация затрагивает именно хромосому 5.
Рисунок 3. Наследование СМА
[4]
Частота встречаемости данной патологии — один случай на 6–10 тыс. человек. При этом каждый 40–50-й житель Земли является носителем «сломанного» гена SMN1. Если два человека, каждый из которых является носителем мутировавшего гена, становятся родителями, то вероятность того, что их ребенок будет болен СМА — 25% (рис. 3) [4].
За что же ответственен SMN-ген, если его мутации приводят к таким последствиям?
У человека существует два гена SMN: SMN1 и SMN2, которые находятся в 5 хромосоме. Мутация, как правило, затрагивает ген SMN1. В результате нарушается синтез белка SMN. Как следствие, все функции по синтезу SMN берет на себя ген SMN2. Однако между генами SMN1 и SMN2 есть, казалось бы, крохотное отличие в один нуклеотид в начале 7-го экзона, но именно этот нуклеотид влияет на процесс сплайсинга — удаления некодирующих последовательностей из преРНК. Ген SMN2 не может из-за своей структуры обеспечить синтез достаточного количества стабильного и функционального SMN-белка (рис. 4) [4].
Рисунок 4. Схематическое изображение отрезка 5 хромосомы, которая содержит гены SMN1 и SMN2. На схеме видно, что в состав 7 экзона первого из рассматриваемых генов входит нуклеотид цитозин, а второго — нуклеотид тимин. Из-за этих отличий ген SMN2 не может синтезировать в нужных количествах функционирующий полноразмерный белок.
[4]
SMN необходим для работы всех клеток организма [4]. Почему же тогда именно моторные нейроны так чувствительны к его нехватке? Исследователи из Университета Эмори дают следующее объяснение данному явлению. Дело в том, что в каждой клетке мРНК считывается с ДНК и, в дальнейшем, служит основой для синтеза белков. Однако для того чтобы синтез белковой молекулы начался, мРНК должна быть доставлена в определенную точку клетки. Каждая матричная РНК имеет участок, который кодирует место доставки. Белок SMN как раз отвечает за корректное считывание данной информации, а при его нехватке данный механизм нарушается.
Поскольку спинальные моторные нейроны обладают очень длинными аксонами, то нарушение транспорта мРНК становится для них критичным. Из-за того что мРНК не достигает концов аксонов, наступает гибель нейронов, и, как следствие, последующая мышечная атрофия [5–7].
Однако роль SMN-белка в нейронах не сводится только лишь к транспортной функции. На рисунке 5 отображены основные функции SMN в нейронах [8].
Рисунок 5. Функции белка SMN в нейроне
[8]
Какие формы СМА существуют?
Существует 4 типа СМА, различающиеся степенью тяжести и возрастом, в котором впервые проявляется заболевание.
СМА I, болезнь Верднига-Гоффмана. Самая тяжёлая форма болезни, проявляется у младенцев от 0 до 6 месяцев. Дети с этой формой с рождения имеют трудности с дыханием, сосанием и глотанием, а также не осваивают самые простые контролируемые движения – не держат голову, не сидят самостоятельно. Ранее считалось, что большинство (80%) не доживают до двух лет. Сейчас благодаря новым стратегиям ИВЛ и зондовому кормлению срок жизни можно продлить ещё на несколько месяцев.
СМА II, болезнь Дубовица. Первые проявления болезни в 7-18 месяцев. Человек с таким типом СМА может есть и сидеть, но не ходит самостоятельно. Продолжительность жизни зависит от степени поражения мышц, обеспечивающих дыхание.
СМА III, болезнь Кюгельберга-Веландер. Болезнь впервые проявляется после полутора лет. Такие больные могут стоять (испытывая боль), но не ходят. На продолжительность жизни СМА III типа, как правило, не влияет, но сильно ухудшает её качество.
СМА IV, этот тип называется ещё «взрослой СМА», поскольку болезнь проявляется обычно в возрасте после 35 лет. Симптомы – мышечная слабость, сколиоз и тремор. Кроме того, развиваются контрактуры суставов (ограничения подвижности в суставах) и нарушения метаболизма. Прогрессирование заболевания не очень быстрое, сначала мышечная слабость затрагивает мышцы ног, затем – рук. Обычно проблем с глотательной и дыхательной функцией у больных нет. Большинство из больных IV типом СМА могут ходить, и лишь некоторым приходится прибегать к инвалидным коляскам.
СМА, связанные с нарушением гена SMN, в медицинской литературе называют проксимальными – они составляют 95% от всех спинальных амиотрофий. СМА, не связанных с геном SMN, довольно много, но встречаются они редко. К ним относится, например, болезнь Кеннеди. Исследования 1990-х годов показали, что болезнь Кеннеди не связана не с поломкой гена SMN1, но с другими генетическими мутациями, приводящими к нарушению усвоения белка SMN. Болезнь проявляется у людей старше 35 лет. Для СМБА характерна, в основном, слабость конечностей.
Один из видов СМА, не связанный с геном SMN, называется болезнь Кеннеди. То, что эту болезнь до сих пор иногда относятся к СМА – анахронизм. В конце 1960-х, когда было выполнено подробное описание этой атрофии, её посчитали разновидностью СМА, так как при ней поражаются те же нервы и мышцы, что и при трёх типах СМА (но в гораздо меньшей степени).
Генетическое редактирование: дождутся ли СМАйлики?
Действие всех вышеописанных препаратов основано на работе с геном SMN2. Однако основная проблема людей, страдающих СМА, в отсутствии полноценной работы гена SMN1, поскольку SMN2 не может его полностью заменить. Так можно ли подойти к проблеме с этой стороны? Оказывается, можно! И здесь на помощь приходят технологии генетического редактирования.
Уже несколько лет научное сообщество активно обсуждает использование технологии CRISPR/Cas9 для решения целого ряда глобальных проблем, стоящих перед человечеством, а также этические вопросы, с этим связанные. Технология позволяет редактировать геномы всех живых организмов, в том числе и человека. Подробнее об этом можно почитать в статьях «Мутагенная цепная реакция: редактирование генома на грани фантастики» [25] и «А не замахнуться ли нам… на изменение генома» [26].
Сегодня идут активные исследования по разработке методов CRISPR/Cas9 для лечения ВИЧ, онкозаболеваний, миопатии Дюшена, и вот, очередь дошла и до СМА [27].
Рисунок 10. Логотип компании AveXis — первого разработчика генной терапии для СМА-пациентов
[28]
AVXS-101 — лекарственное средство, созданием которого занимается компания AveXis (рис. 10) [28].
В отличие от описанных выше препаратов, AVXS-101 не влияет на работу гена SMN2, его целью является SMN1. В результате использования генной терапии мутировавший или отсутствующий ген замещается функционально полноценным, способным синтезировать полноразмерный стабильный SMN-белок. Это сложно представить, но технически реализовать уже вполне возможно [29]. Более того, AVXS-101 уже прошел стадию изучения на животных и сейчас идет этап клинических исследований на людях.
Сегодня рассматривают два возможных способа введения препарата — внутривенно и непосредственно в спинномозговую жидкость. Второй вариант хоть и технически более сложен, но способен снизить потребность в лекарстве для взрослых пациентов, особенно с избыточным весом. Такой способ введения делает AVXS-101 доступным для большего числа людей.
В октябре 2021 года компания AveXis сделала заявление, которое подарило очередной лучик надежды всем СМАйликам: AVXS-101 подан на одобрение в регистрационные медицинские органы Соединенных Штатов, Европы и Японии. Если не возникнет никаких непредвиденных обстоятельств, то уже в середине 2021 года первый препарат для генетической терапии СМА будет зарегистрирован.
После регистрации его планируют использовать для лечения младенцев со СМА I возрастом до 9 месяцев. Однако со временем AVXS-101 будет применяться и для других групп пациентов [25].
Безусловно, несмотря на всю перспективность данного лекарственного средства, необходимо помнить о том, что технология эта еще очень новая, а значит, возможны различные неожиданные побочные эффекты в долгосрочной перспективе.
Подводя итог, можно сказать, что СМА все еще остается серьезным заболеванием, которое существенно снижает качество жизни пациентов и их семей и зачастую приводит к летальному исходу в детском или подростковом возрасте. Но динамика разработки новых лекарственных препаратов позволяет надеяться, что ситуация скоро изменится в лучшую сторону. Хотелось бы, чтобы в ближайшие годы лечение стало более эффективным и доступным для граждан разных государств, а не только резидентов Евросоюза и США. И будем ждать выход на фармацевтический рынок AVXS-101, поскольку этот препарат обещает стать новым переломным моментом в терапии обсуждаемого заболевания. Главное, чтобы как можно больше СМАйликов смогло дождаться этого дня, поскольку для многих из них и полгода — очень значительный срок.
Как это лечат?
Изображение с сайта asesoramientopsicologicoalicante.es
В последние годы в мире активно разрабатываются препараты против СМА, три из них уже применяются в мире, остальные находятся на разных стадиях разработки.
Спинраза – препарат, разработанный компанией Biogen, увеличивает производство белка SMN из «резервного» гена SMN2. При регулярной терапии спинраза приостанавливает развитие СМА и стабилизирует состояние больного.
Спинраза выпускается в дозировке 12 мг на 5 мл для интратекального введения (непосредственно в спинномозговую жидкость) и одобрен для всех возрастов и типов СМА без каких-либо ограничений.
В первый год необходимо будет сделать 6 инъекций: 3 дозы с 14-ти дневным интервалом, 1 дозу спустя 30 дней и далее – раз в 4 месяца. Впоследствии препарат нужно будет применять постоянно в течение всей жизни каждые 4 месяца.
Препарат следует начать применять, как только был поставлен диагноз. Эффективность и безопасность применения нусинерсена изучалась у детей в возрасте от 0 до 17 лет, опыт применения у пациентов старше 18 лет ограничен, применение препарата у пациентов старше 65 лет не изучалось.
После применения спинразы наблюдались улучшения двигательной активности у пациентов со СМА I, II и III типа. Возможные осложнения спинразы – инфекция верхних дыхательных путей, инфекции нижних дыхательных путей и запоры, возможно также развитие ателектаза, отклонения коагуляции и тромбоцитопения, включая острую тяжелую тромбоцитопению, а также развитие гломерулонефрита.
13 февраля 2021 года спинраза получила в России орфанный статус. 16 августа 2021 года препарат был официально зарегистрирован в России.
3 августа 2021 комиссия Минздрава рекомендовала правительству включить препарат для лечения спинальной мышечной атрофии в перечень жизненно необходимых и важнейших лекарственных препаратов на следующий год. Однако по состоянию на сентябрь переговоры по возмещению за счет средств федерального бюджета на 2021 год не завершены.
Есть прецеденты выигранных судов, когда суд обязал региональные власти обеспечить пациентов спинразой за счёт региональных бюджетов.
Стоимость препарата – около 8 миллионов рублей за одну инъекцию.
Золгенсма (Zolgensma) — первый препарат генной терапии, разработанный для лечения спинальной мышечной атрофии (СМА). Предназначен для устранения генетической причины СМА путем замены дефектного или отсутствующего гена SMN1 для остановки прогрессирования заболевания. Препарат доставляет полностью функциональную копию гена SMN в организм человека. Препарат разработан компанией Авексис для однократного применения (одна инъекция на всю жизнь).
В настоящее время препарат одобрен в США для больных СМА возрастом до 2 лет, включая тех, кто не имеет симптомов при постановке диагноза. В Европе препарат получают больные СМА I типа с количеством копий SMN2 не более 3 копий, ограничения по весу 21 кг. Препарат вводится однократно внутривенно, доза определяется с учётом массы тела ребёнка.
Наиболее эффективно применение препарата до появления первых симптомов заболевания у детей, у которых наличие СМА установлено по результатам скрининга. Исследования о применении препарата у детей более позднего возраста, уже имеющих симптомы СМА, продолжаются.
Наиболее частыми нежелательными реакциями на фоне применения Золгенсма были повышение активности печёночных ферментов и рвота. В инструкции по применению препарата имеется предупреждение о риске развития тяжёлого острого поражения печени.
В середине июля 2021 года подала в Министерство здравоохранения РФ досье на регистрацию препарата к применению в России. По существующей процедуре, процесс регистрации может занять до полугода.
В настоящее время компанией-производителем объявлена программа сострадательного применения (до официальной регистрации препарата), по которому 100 доз препарата будут распространены между ста пациентами со СМА любого типа до двух лет методом лотереи. В России по этой программе препарат получили 4 ребёнка.
Кроме того, за счёт средств благотворителей препарат получили 16 российских детей, ещё двое принимают участие в программе клинических испытаний.
Стоимость дозы препарата составляет около 152 миллионов рублей (самый дорогой препарат в мире).
Рисдиплам (RG7916) («Эврисди») – препарат компании Roche, является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков. В отличие от других препаратов, применяется перорально.
Исследования проводились с участием пациентов от 0 до 60 лет со СМА II и III типов. Улучшает моторную функцию пациентов. Противопоказаний на сегодняшний день не зарегистрировано.
18 марта 2021 года подала заявку на рассмотрение для дальнейшей регистрации препарата в Министерство здравоохранения РФ.
В настоящее время производителем открыта программа дорегистрационного доступа к препарату.
Кроме того, в мире идут клинические испытания ещё нескольких препаратов – бранаплам, релдесемтив, SRK-015 и других.
По мнению врачей комбинация препаратов при лечении СМА возможна, но её целесообразность должна рассматриваться в каждом случае индивидуально.
Лечение мышечной атрофии
В настоящее время эффективного лечения атрофии мышц не существует. Пациент нуждается в поддерживающей терапии. В противном случае его состояние резко ухудшается.
Улучшение состояния больных с СМА возможно только при увеличении продукции белка SMN. Основные результаты получены, но препараты находятся на стадии клинических исследований.
Одобренные лекарственные препараты:
- Спинраза, США – олигонуклеотид, который способствует образованию протеина SMN. Вводится эндолюмбально;
- Золгенсма – для детей до 2 лет – обеспечивает замену отсутствующего или дефектного гена SMN1. ДНК пациента остается неизмененным. Может применяться как у больных с симптомами, так и для пациентов без признаков заболевания, но с выявленными генетическими отклонениями. Курс – 1 доза, но стоимость лекарственного средства составляет 2 млн долларов.
Методы лечения, которые применяются на текущий момент, зависят от вида СМА, тяжести заболевания. Пациент должен находиться под контролем терапевта, пульмонолога, невролога, ортопеда, генетика, гастроэнтеролога и реабилитолога.
Основные проблемы, которые приходится решать врачу и родственникам больного:
- недостаточное откашливание, отхождение слизи из легких;
- недоразвитие легких, недостаточная вентиляция во время сна;
- сниженный иммунитет, инфекции, которые увеличивают скорость атрофии мышц;
- нарушение процессов глотания.
Заболевания дыхательной системы – это основная причина смерти пациентов с СМА. Поэтому нужно обеспечить качественную вентиляцию легких во время респираторных заболеваний и при каждодневном уходе.
Мониторинг состояния органов дыхательной системы проводится каждые 4–6 месяцев. Задача для врачей и родственников – постараться не попадать в отделения интенсивной терапии, не использовать неивазивные методы вентиляции легких, не допускать трахеотомий.
Для всех пациентов показано назначение антибиотиков по показаниям, препаратов, купирующих гастроэзофагеальный рефлюкс, диетическое питание. Кроме того, нужно исключить нарушение роста, недостаточный и лишний вес.
Ортопедическая поддержка показана для предупреждения развития контрактур, деформации позвоночника, болей, переломов. По показаниям проводятся нейрохирургические вмешательства, назначают использование протезов, ортезов. Хождение должно поощряться, как и любые другие физические упражнения. Это улучшает состояние пациента, поддерживает мышцы в тонусе.
Медикаментозная терапия включает в себя:
- препараты на основе L-карнитина и коэнзима Q10;
- ноотропы для улучшения трофики тканей;
- витамины группы B – например, Потаба. Они повышают уровень кислорода в тканях. Ранее такие препараты вводили инъекционно, капсулы Потаба для перорального приема облегчают уход за пациентами с СМА;
- витамин Е;
- вальпроаты, хотя их эффективность не доказана;
- сальбутамол для улучшения отхождения мокроты;
- регуляторы моторики ЖКТ;
- антациды.
Можно ли помочь больным СМА и как именно?
Вылечить болезнь пока нельзя, но можно облегчать состояние больных СМА, то есть различными способами компенсировать проявления болезни.
При тяжёлых типах СМА больным приходится помогать дышать и глотать. Поэтому им жизненно необходимы мобильные аппараты ИВЛ, аспираторы-откашливатели, мешки Амбу.
Ещё детям со СМА очень нужна помощь волонтёров, способных хоть на короткое время подменить родителей.
Детям, больным СМА, помощь может понадобиться в любой момент, поэтому мамы и папы всегда начеку и сами осваивают навыки реанимации, необходимые на случай, если ребенок внезапно перестал дышать.
Менее тяжёлым больным нужны лекарства, облегчающие дыхание, корсеты, коляски и другие приспособления, облегчающие перемещение и жизнь людей со слабыми мышцами.
Болезнь, продолжающаяся много лет, выматывает, поэтому пациентам, особенно взрослым, часто необходима помощь психолога.
Фото с сайта f-sma.ru
Благотворительный фонд «Семьи СМА» помогает детям и взрослым со спинальной мышечной атрофией и другими нервно-мышечными заболеваниями и их семьям.
Фонд работает по всей территории России. Работа фонда имеет два основных направления – оказание помощи самим больным СМА и их близким и работа на системные изменения ситуации со СМА в России.
Вы можете поддержать деятельность фонда, сделав пожертвование любым удобным для вас способом. Помочь можно, оформив разовое или регулярное пожертвование на специальной странице фонда или отправив на короткий номер 3443 смс со словом СМА и, через пробел, суммой пожертвования – например, СМА 300.
Ольга Германенко: «Болезнь дочери воспринимаю как награду»
Нусинерсен — эффективное средство или ложная надежда?
Долгое время генетические заболевания считались по умолчанию неизлечимыми. Но сегодня человек замахнулся и на лечение данных патологий. Нельзя сказать, что всегда это получается удачно, но новые попытки предпринимаются с завидной регулярностью.
Так, после того как была выяснена генетическая природа СМА, начались поиски препаратов, способных хотя бы частично исправить генетический дефект. И вот, 23 декабря 2021 г. СМАйлики и их семьи были взбудоражены сенсационным известием: FDA (американское Управление по надзору за качеством лекарств и пищевых продуктов) зарегистрировало первое лекарство против СМА — нусинерсен (коммерческое название Spinraza, производитель — компания Biogen) (рис. 9). Через несколько месяцев препарат одобрило и EMA — Европейское медицинское агентство [17].
Рисунок 9. Первый зарегистрированный препарат для лечения СМА — нусинерсен (Spinraza)
[17]
Как же работает нусинерсен? Он исправляет дефекты сплайсинга матричной РНК гена SMN2, что, в свою очередь, увеличивает продукцию SMN-белка. К сожалению, представители компании Biogen пока не раскрывают более подробно механизм действия данного препарата. Терапия проводится в стационаре с участием многопрофильной медицинской команды, которая должна состоять из пульмонолога, физиотерапевта и реаниматолога. Лекарство вводят непосредственно в спинномозговую жидкость. Каждому СМА-пациенту необходимо несколько инъекций нусинерсена в год. Среди основных побочных воздействий препарата — инфекции верхних и нижних дыхательных путей, запоры.
Перед регистрацией клинические испытания проводили на группе из 121 пациента с инфантильным началом заболевания. Часть пациентов получала препарат, а часть — плацебо. В ходе исследования было выяснено, что 51% процент пациентов отвечал на лечение нусинерсеном, по сравнению с контрольной группой. У этих детей улучшились моторные навыки, а также снизились риск смерти и постоянной вентиляции легких. Однако данное исследование также означает, что, к сожалению, 49% пациентов, получавших нусинерсен в ходе исследования, не имели ответной реакции улучшения моторных навыков.
В дальнейшем компания-производитель провела исследования лекарственного средства на людях с более поздним началом СМА. Наблюдения вели за пациентами в течении 15 месяцев. В результате было отмечено, что по шкале Хаммерсмита, которая позволяет оценивать уровень двигательных навыков СМАйликов, пациенты, получавшие препарат, в среднем улучшили свои показатели на 4 пункта, в то время как у СМАйликов из контрольной группы показатели ухудшились на 1,9 балла [18].
Сегодня, как заявляют представители компании Biogen, применение нусинерсена рекомендовано для пациентов любого возраста и при любом типе СМА.
В октябре 2021 представила новые данные по препарату нусинерсен на ежегодном Конгрессе Всемирного общества нервно-мышечных заболеваний. На этот раз исследования проводили на пресимптоматических младенцах со СМА. Представители «Биогена» заявляют, что были получены впечатляющие результаты: после применения нусинерсена 100% испытуемых могли сидеть без поддержки и 88% — ходить [19]. Результат обнадеживающий, однако, для того чтобы применять лечение к пресимптоматическим младенцам, необходим скрининг новорожденных, направленный на раннее выявление СМА. В России и других постсоветских государствах такие исследования пока не проводили и, зная инертность отечественного здравоохранения, можно предположить, что еще не скоро будут проводить.
Новость о появлении первого зарегистрированного препарата для лечения СМА казалась фантастической. Заболевание, которое очень часто приводит к летальному исходу, теперь можно лечить! У СМАйликов есть шанс на жизнь!
Однако восторг пациентов и их семей значительно поубавился, когда производитель препарата озвучил цену. В год человеку, страдающему СМА, необходимо несколько инъекций и их суммарная стоимость составляет несколько сотен тысяч долларов. Эта сумма является неподъемной для большинства СМА-семей. Однако в США и Евросоюзе можно воспользоваться лечением по страховке. Поэтому применение первого лекарства против СМА уже начало набирать обороты.
Однако за пределами США и Евросоюза обсуждаемое лекарственное средство не везде было встречено с большим восторгом. Так, в Великобритании нусинерсен столкнулся с рядом сложностей. Организация NICE — National Institute for Health and Care Excellence — не одобрила использование нусинерсена для лечения спинальной мышечной атрофии. При этом представители NICE говорят о возможной «существенной пользе» от применения данного лекарственного средства для СМА-пациентов, но при этом также отмечают, что в связи со «значительной неопределенностью, особенно в отношении долгосрочных перспектив» и высокой стоимостью препарата не могут рекомендовать его для терапии спинальной мышечной атрофии. При этом организация заявляет, что готова к «дальнейшему обсуждению» сложившейся ситуации с представителями [20], [21].
В России и других странах постсоветского пространства данный препарат также все еще не зарегистрирован. Это означает, что даже если родственники пациента каким-то чудом добудут это лекарство, то ни один из российских врачей не имеет права его применять, поэтому лечение пока возможно только за границей.
Пациентов же и их семьи волнует следующий вопрос: действительно ли нусинерсен является панацеей для СМАйликов? К сожалению, однозначного ответа на данный вопрос нет. Некоторые врачи твердо уверены в том, что нусинерсен — это прорыв в лечении СМА. Так, к примеру, Эдуардо Тициано, один из ведущих специалистов в вопросах диагностики и лечения СМА, не так давно, во время своего приезда в Россию, заявил, что «СМА больше не неизлечима» и что «в ближайшее время появится несколько способов лечения СМА» [22]. Другие же доктора напоминают о результатах клинических исследований, и о том, что у 49% пациентов в инфантильной группе, у которых лечение началось уже после появления симптомов, препарат не дал никакого положительного результата [18]. Кроме того, неизвестно, насколько долгосрочным является эффект от применения нусенерсена [17].
Семьи же СМАйликов, в большинстве своем, придерживаются мнения, что этот препарат, как минимум, позволит их близким остаться живыми и дождаться принципиально другого средства лечения СМА. Какого? Читайте ниже. Но сначала о препаратах, созданных для борьбы со СМА, которые сходны по своему действию c нусинерсеном.
Можно ли заболеть СМА из-за прививок?
В Европе и США связь между прививками и проявлением болезни не прослежена.
Понять, есть ли связь между СМА и прививками, может объяснение разницы между СМА и полиомиелитом. Полиомиелит – инфекционное заболевание, когда от инфекции повреждается организм изначально здорового ребёнка. Ребёнок со СМА, родившийся с повреждённым геномом, внешне может выглядеть здоровым, но на самом деле он уже болен, просто симптомы его болезни проявляются постепенно. В этом отношении СМА – такая же «отложенная» болезнь как, например, миодистрофия Дюшенна или синдром Ретта, когда ребёнок, некоторое время развивавшийся в соответствии с нормой, теряет приобретённые ранее навыки и становится инвалидом.
Большинство проявлений СМА связаны с освоением первых двигательных навыков. Первые проявления болезни совпадают по времени с несколькими возрастными прививками. В итоге человек и его родные могут утверждать, что он «заболел от прививки», но на самом деле у него просто проявились признаки болезни, которая уже была.
Как определяют, что у ребенка именно СМА, а не какая-то другая болезнь?
Несмотря на то, что впервые СМА была описана австрийским неврологом Гвидо Верднигом и немецким неврологом Джоханном Хоффманном ещё в начале 1890-х годов, полностью понять природу заболевания удалось только в конце XX века. Ген SMN1 был открыт в 1995 году. Чтоб подтвердить диагноз СМА, нужен генетический тест.
В России соответствующие генетические тесты стали доступны в начале 2000-х годов. Генетический тест на СМА возможно сделать по ОМС, однако на практике не слишком много врачей знают этот редкий диагноз и направляют больных на соответствующее исследование. Стоимость такого тестирования в коммерческих лабораториях Москвы – порядка 6 тысяч рублей.
Отсутствие специальной диагностики привело также к путанице в диагнозах. Большинство больных СМА в России не выявлены, у многих выявленных в качестве диагноза записана «болезнь Верднига-Гоффмана», хотя не у всех из них (особенно взрослых) в действительности именно этот тип болезни.
Кто в России помогает людям со СМА и их семьям
Благотворительный фонд «Вера», детский хоспис «Дом с маяком», благотворительный фонд «Детский паллиатив», благотворительный фонд «Семьи СМА», детская паллиативная служба «Милосердие».
С 2014 года в Москве развивается совместный проект службы «Милосердие» и фонда «Семьи СМА» «Клиники СМА» На встречах, которые проходят раз в месяц, больные могут получить консультации пульмонолога, ортопеда, физиотерапевта и психолога. В последнее время часть встреч ориентированы и на нужды взрослых пациентов.
Известные люди со СМА
Валерий Спиридонов. Фото с сайта mioby.ru
Итальянка Симона Спиноглио родилась с наследственным заболеванием – спинальной мышечной атрофией 2 типа. Она с самого рождения не может ходить и передвигается только с помощью электрической коляски. Но ее жизнь полна и насыщенна; ничто не может помешать ее стремлению жить. Симона работает на «горячей линии» итальянской Ассоциации «Семьи СМА» (Famiglies of SMA) и помогает детям и взрослым со СМА и другими нервно-мышечными заболеваниями. Также Симона записала несколько популярных в итальянском сообществе СМА песен – о свободе делать то, что ты хочешь, несмотря на болезнь.
Российская певица Юлия Самойлова родилась в городе Ухта (Республика Коми) В возрасте десять лет выступила на благотворительном концерте, после чего была приглашена заниматься пением в местный Дворец пионеров. В пятнадцати лет начала заниматься в городском Доме культуры.
В 2008 году собрала собственную музыкальную группу (распалась в 2010). В 2013 году приняла участие в конкурсе «Фактор А» на телеканале «Россия». Заняла второе место и получила персональную премию Аллы Пугачёвой «Золотая звезда Аллы». В 2021 году из-за недопуска России в конкурсную программу не смогла принять участие в конкурсе «Евровидение». Передвигается на коляске.
Программист из Владимира Валерий Спиридонов. Окончил школу с золотой медалью, затем защитил диплом инженера. В 2015 году Валерий планировал стать участником эксперимента итальянского хирурга Серджио Канаверо по пересадке головы человека (эксперимент был отменен).
Сегодня Валерий – член городской общественной палаты Владимира, эксперт по вопросам доступной среды, а также создатель собственного сообщества «Desire for life», рассказывающего о создании доступной среды и перспективных медицинских проектах. Валерий – участник многих телепрограмм на российском и зарубежном ТВ.
Валерий Спиридонов: «Мне сложно искать с Богом общий язык»
Литература
- Боярчук Е.Д. Анатомия и эволюция нервной системы. Луганск: ГУ «ЛНУ им. Т.Г.Шевченко», 2014. — 411 с.;
- Рефлекторная функция нервной системы. «Неврологический портал»;
- Сокольник В.П. (2012). От молекулярных основ СМА к разработке терапевтической стратегии. «Медицинский журнал». 3, 115–118;
- Генетические основы спинально-мышечной атрофии. «Семьи СМА»;
- Kegel M. (2017). Why SMN deficiency so quickly kills motor neurons detailed in study with relevance to SMA treatment. SMA News Today;
- Paul G. Donlin-Asp, Claudia Fallini, Jazmin Campos, Ching-Chieh Chou, Megan E. Merritt, et. al.. (2017). The Survival of Motor Neuron Protein Acts as a Molecular Chaperone for mRNP Assembly. Cell Reports
.
18, 1660-1673; - Scientists show ‘matchmaker’ role for protein behind SMA. (2017). Science Daily;
- Melissa Bowerman, Catherina G. Becker, Rafael J. Yáñez-Muñoz, Ke Ning, Matthew J. A. Wood, et. al.. (2017). Therapeutic strategies for spinal muscular atrophy: SMN and beyond. Dis. Model. Mech.
.
10, 943-954; - Лепесова М.М., Ушакова Т.С., Мырзалиева Б.Д. (2016). Дифференциальная диагностика спинальной мышечной дистрофии первого типа. «Вестник АГИУВ». 1, 38–45;
- Факты о спинальной мышечной атрофии. (2011). «Миопатия.by»;
- Пациентский активизм и борьба с хроническими заболеваниями;
- Пациентские организации в борьбе с аутоиммунными болезнями;
- В Китае медики провели первую в мире успешную операцию по пересадке человеческой головы. (2017). NEWSru.com;
- Резник О.Н. (2017). Феномен Канаверо. «Вестник трансплантологии и искусственных органов». 4, 146–150;
- Саломатина А.В. (2018). Юридические аспекты и биоэтическая экспертиза пересадки головы человека. «Научный альманах». 5-3, 95–98;
- Голова профессора Канаверо;
- «Ни Спинраза, ни генная терапия не являются панацеей»: достижения, надежды и ограничения терапии СМА. (2017). «Миопатия.by»;
- Первое лекарство для лечения спинальной мышечной атрофии, одобренное ЕМА. (2017). «Семьи СМА»;
- Компания Биоген представила новые данные по препарату Спинраза (нусинерсен) на Ежегодном Конгрессе Всемирного общества нервно-мышечных заболеваний. «Семьи СМА»;
- Biogen response to nice spinraza announcement. (2018). The SMA Trust;
- McKee S. (2018). Draft guidelines reject NHS funding for Biogen’s Spinraza. PharmaTimes;
- Эдуардо Тициано: «В ближайшие годы появится несколько способов лечения СМА». (2018). «Миопатия.by»;
- Компания Roche распространила обновление информации по программам исследований препарата RG7916. «Семьи СМА»;
- В Москве открыт российский центр клинических исследований по программе Sunfish испытания препарата RG7916 для пациентов со СМА 2-го и 3-го типов (от 2 до 25 лет). (2018). «Семьи СМА»;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- А не замахнуться ли нам на… изменение генома?;
- Фетальная генная терапия: от теории — к практике;
- AveXis подала документы на одобрение препарата генной терапии СМА 1го типа в регистрационных органах США, Европы и Японии. (2018). «Семьи СМА»;
- AVXS-101. SMA News Today.