Подробное описание исследования
Эстриол (E3) — это половой гормон, являющийся одной из основных форм эстрогенов (женские половые гормоны) в организме. Кроме эстриола к группе женских гормонов относят эстрон (E1) и бета-эстрадиол (E2). Главной функцией эстрогенов считается рост и развитие половых органов, а также тканей, которые влияют на репродуктивную функцию.
Так, в период полового созревания эстрогены способствуют развитию половых органов — матки, маточных труб, яичников и влагалища — и формированию молочных желез. Помимо этого, женские половые гормоны выполняют другие важные функции:
- Влияют на функцию опорно-двигательной системы: стимулируют рост костей и подавляют их разрушение;
- Участвуют в обмене жиров: способствуют их отложению в подкожной клетчатке;
- Регулируют водно-электролитный баланс: задерживают натрий в организме, участвуя в развитии отёков.
Однако последнее действие имеет прикладное значение только в организме у беременной женщины за счёт массивного выброса эстрогенов в кровь.
Эстриол — стероидный гормон с самой слабой эстрогенной активностью. В численном сравнении его биоактивность уступает эстрону примерно в 12 раз, бета-эстрадиолу — в 80 раз. Эстриол становится главным эстрогеном во время беременности — до 90 % всех форм эстрогенов в этот период составляет именно он. В норме его показатель в крови повышается уже в конце первого триместра, когда начинает формироваться плацента — орган-посредник между плодом и матерью. Эстриол является маркером нормальной жизнедеятельности плода и маточно-плацентарного кровообращения.
Оценка концентрации эстриола при беременности помогает выявить нарушения развития плода или плаценты.
Установлено, что снижение уровня свободного эстриола во II триместре беременности является лабораторным признаком синдрома Дауна и синдрома Эдвардса. Данные патологии относятся к хромосомным болезням, то есть проявляются патологическим увеличением числа хромосом в 21-й и 18-й парах.
Низкая концентрация свободного эстриола во время беременности также может отражать развитие следующих заболеваний:
- Синдром Смита-Лемли-Опица — врожденное нарушение метаболизма холестерина;
- Ихтиоз, сцепленный с Х-хромосомой — избыточное ороговение кожи, образование чешуек;
- Первичная или вторичная надпочечниковая недостаточность (у ребенка);
- Преэклампсия;
- Трофобластическая болезнь (пузырный занос, хориокарцинома).
В некоторых случаях отмечается уменьшение концентрации свободного эстриола на фоне внутриутробных инфекций (токсоплазмоз, краснуха, цитомегаловирусная и герпетическая инфекции). Также пониженный уровень гормона регистрируется у женщин на фоне приема ряда лекарственных средств — антибиотиков (пенициллин, ампициллин), гормональных препаратов (глюкокортикоиды, эстрогены), динопрост триметамина и других.
Свободный эстриол применяется в качестве лабораторного маркера вышеуказанных заболеваний. Для комплексной оценки состояния плода данное исследование рекомендуется проводить в сочетании с другими маркерами аномалии развития — альфа-фетопротеин (печень) и β-ХГЧ.
Одним из ранних и первых признаков нарушений углеводного обмена у женщин старшей возрастной группы являются жалобы на признаки атрофического вульвовагинита (АВ). Это связано с тем, что в пери- и постменопаузе у женщин развиваются патологические процессы, обусловленные возрастным дефицитом половых стероидов (в большей степени эстрогенов), которые в физиологических условиях вызывают увеличение синтеза гликогена в промежуточных клетках и пролиферацию влагалищного эпителия. Под влиянием эстрогенов улучшается кровоснабжение влагалищной стенки, восстанавливаются транссудативная функция слизистой оболочки и ее эластические свойства. Нормальный уровень эстрогенов обеспечивает образование молочной кислоты, подавляющей рост патогенных и условно-патогенных микроорганизмов, поддерживает кислую среду влагалищного содержимого и популяцию лактобацилл в вагинальном биотопе. Эстрогены стимулируют секрецию иммуноглобулинов, что является одним из факторов локального иммунитета, препятствующих развитию восходящей инфекции мочевыводящих путей.
Как правило, частота атрофического вульвовагинита и выраженность патологических изменений у женщин без сахарного диабета (СД) зависят от длительности постменопаузы [1—3]. Так, через 7—10 лет после прекращения менструаций вагинит наблюдается почти у половины женщин, а через 10 лет и позднее его частота возрастает до 73—75%. Для пациенток с нарушениями углеводного обмена характерно более раннее и тяжелое поражение слизистой влагалища [1—5].
Основными проявлениями атрофического вагинита являются сухость, зуд, боль во влагалище, жжение, дискомфорт, неприятные ощущения в уретре и влагалище, связанные с актом мочеиспускания, диспареуния, появление контактных кровянистых выделений. Обусловленные дефицитом гормонов атрофические изменения связаны со снижением кровотока и кровоснабжения слизистых оболочек, разрушением эластических и коллагеновых волокон. Кроме того, в эпителии влагалища и подлежащей соединительной ткани происходит изменение клеточного состава, а в клетках эпителия — уменьшение выработки и содержания гликогена, что приводит к ослаблению защитных свойств, облегчает инфицирование слизистых оболочек. Снижается колонизация влагалища лактобациллами, значительно уменьшается количество молочной кислоты и повышается рН влагалищного содержимого до 5,5—6,8. Изменение микроценоза влагалища создает условия для колонизации слизистой оболочки влагалища экзогенной и эндогенной флорой, при которой возрастает риск развития бактериального вагиноза, инфекционных заболеваний влагалища и других органов мочеполовой системы. Происходят изменения во влагалище, приводящие к уменьшению его глубины и просвета вследствие потери эластичности и слабости мышц тазового дна или их атрофии, сглаживание вагинальных складок, истончение влагалищного эпителия с последующей инфильтрацией лимфоцитами. Такие атрофические изменения приводят к развитию урогенитальных, сексуальных и трофических нарушений, а также служат фоном для длительного хронического течения воспалительных процессов нижних отделов генитального тракта.
В последние годы все больше внимания уделяется поиску оптимальных путей решения проблем, связанных с лечением атрофических вульвовагинитов (АВ). Актуальность этого направления определяется тенденцией к генерализации и хронизации воспалительных процессов, развитием серьезных патофизиологических и патоморфологических изменений в пораженных тканях и органах, вовлечением в патологический процесс иммунной, нервной, эндокринной, репродуктивной и других систем организма. Вагиниты относятся к заболеваниям, которые сами по себе не представляют прямой угрозы здоровью женщины. Однако при этом в нижних отделах полового тракта накапливаются и постоянно сохраняются в чрезвычайно высоких концентрациях условно-патогенные микроорганизмы, которые могут приводит к манифестации воспалительного процесса.
Под «атрофическим диабетическим вульвовагинитом» (АДВ) принято понимать острое или хроническое воспаление слизистой влагалища, преддверия влагалища, вульвы, а также наружных половых органов, связанное с декомпенсацией углеводного обмена и проявляющееся на фоне атрофических изменений слизистой урогенитального тракта, связанных с длительным эстрогенодефицитом (О.Р. Григорян, 2004). Важно отметить, что не всегда эстрогенодефициту принадлежит основная роль. Чаще всего для развития данного заболевания достаточно лишь внезапного или длительного повышения уровня сахара в крови [1, 2, 5, 6].
АДВ может быть острым и хроническим; неосложненным и осложненным (эрозивный, язвенный, язвенно-некротический). Для него характерны все 5 классических признаков воспаления: гиперемия, отечность, боль, локальное повышение температуры окружающих тканей, нарушение функции (диспареуния, частое мочеиспускание и т.д.) [6—9].
Основными методами объективной диагностики являются: общий осмотр, цитологическое исследование, определение pH влагалищного содержимого, расширенное кольпоскопическое исследование, микробиологическое исследование [10].
Диагностика атрофического вульвовагинита включает:
1) жалобы на сухость и зуд во влагалище; рецидивирующие выделения, часто расцениваемые как симптом рецидивирующего кольпита; контактные кровянистые выделения;
2) объективные методы обследования:
— расширенная кольпоскопия: определяется истончение слизистой влагалища, кровоточивость, петехиальные кровоизлияния, многочисленные просвечивающиеся капилляры;
— кольпоцитологическое исследование — определение кариопиенотического индекса (КПИ), который при развитии атрофических процессов во влагалище снижается до 15—20, или определение индекса созревания (ИС), который оценивается по сдвигу формулы: сдвиг формулы влево свидетельствует об атрофии влагалищного эпителия;
— определение рН влагалища (рН влагалища у не получавших лечения женщин в постменопаузе составляет 5,5—7,0 в зависимости от возраста и сексуальной активности; у сексуально активных женщин рН несколько ниже; чем выше рН, тем больше степень атрофии влагалищного эпителия).
Эволюция лечения АВ претерпела значительную трансформацию в течение последнего века от местных спринцеваний антисептиками через системное применение антибиотиков до заместительной гормональной терапии (ЗГТ), а также местного использования различных препаратов, содержащих эстрогены. Локальный путь введения лекарственных средств позволяет снизить фармакологическую нагрузку на организм женщины, также его преимуществами являются простота и удобство применения, отсутствие абсолютных противопоказаний (кроме индивидуальной непереносимости компонентов препарата), а также возможность применения у больных с экстрагенитальной патологией, а именно: нарушениями углеводного обмена.
В связи с этим рациональное и эффективное лечение АВ, для которого наиболее предпочтительным является местное применение препаратов, является непростой, но чрезвычайно актуальной задачей.
Цель данного исследования — определить зависимость уровня pH, зрелости влагалищного эпителия, индекса вагинального здоровья от длительности сахарного диабета у женщин в период пери- и постменопаузы. Оценить клиническую эффективность препарата эстрокад (вагинальные суппозитории эстриола 0,5 мг) в лечении АДВ у данной категории больных.
Материал и методы
За период 2000—2010 гг. в клинике ФГУ ЭНЦ МЗ и СР РФ (дир. — акад. РАН и РАМН И.И. Дедов) были обследованы 1352 женщины с нарушениями углеводного обмена, находящиеся в пери- и постменопаузе и давшие согласие на участие в исследовании. Возраст пациенток составил 40—65 лет (средний возраст 54,3±7,8 года). В перименопаузе находились 636 (47,1%) пациенток (средний возраст 48,7±4,5 года); в постменопаузе — 716 (52,9 %) в возрасте 55—58 лет (средний возраст 58,2±3,7 года). СД 1-го типа имелся у 451 (33,3%) женщины: 296 (66%) пациенток — в фазе перименопаузы, 155 (44,0%) — в постменопаузальной фазе. СД 2-го типа был верифицирован у 620 (45,8%) женщин: 274 (44%) — в фазе перименопаузы, 346 (66%) — в фазе постменопаузы. Нарушенная толерантность к глюкозе (НТГ) была выявлена у 281 (20,8%) женщины: 136 (48,3%) — в фазе перименопаузы, 145 (51,7%) — в постменопаузальной фазе.
У всех больных изучалась вагинальная микробиология с предварительным исключением инфекций, передающихся половым путем; проводились расширенные кольпоцитологические исследования — определяли зрелость вагинального эпителия, подсчитывали индекс вагинального здоровья, изучали вагинальный микроценоз [10].
15 женщинам в фазе постменопаузы с диагностированным АДВ (без признаков наличия грибковой инфекции, по результатам бактериологического и бактериоскопического исследований) помимо строгой компенсации уровня гликемии в течение суток было предложено лечение препаратом эстрокад (вагинальные суппозитории эстриола 0,5 мг), глубоко интравагинально 2 раза в неделю в течение 3 мес. 15 женщинам контрольной группы для лечения АДВ были предложены только строгая компенсация основного заболевания и традиционные мылосодержащие средства для интимной гигиены.
Результаты исследования
При обследовании 214 пациенток с СД 1-го типа в возрасте 56,3±10,7 года и 356 с СД 2-го типа в возрасте 52,6±8,9 года жалобы на сухость, зуд и жжение во влагалище предъявляли 209 (97,6%) и 341 (95,7%) женщин соответственно. На диспареунию жаловались 198 (92,5%) женщин с СД 1-го типа и 314 (88,2%) — с СД 2-го типа; на рецидивирующие выделения из наружных половых органов (не кровянистого характера) — 143 (66,8%) и 186 (52,2%) женщин соответственно. Опущение стенок влагалища 0—II степени выявлялось у 21 (9,8%) женщины с СД 1-го типа и у 286 (80,3%) — с СД 2-го типа.
Данные о зависимости уровня pH, зрелости влагалищного эпителия, индекса вагинального здоровья от длительности основного заболевания у женщин с СД 1-го и 2-го типа представлены в табл. 1 и 2.
При анализе полученных данных были выявлены прямые корреляционные зависимости между длительностью СД и pH влагалищного содержимого (r=0,45 и r=0,48 соответственно, р<0,01), обратная корреляционная зависимость между длительностью СД и значениями зрелости влагалищного эпителия, а также индекса вагинального здоровья в обеих группах женщин (r=–0,58; р<0,01; r=–0,49; р<0,01). Та же тенденция выявлялась и при сравнительном анализе уровня компенсации СД с перечисленными показателями. Так, у женщин с уровнем HbА1c% <7,5% pH составил 4,1–4,6, а при HbА1c% ≥9% — 7,8–8,9 (р<0,001).
Сравнительный анализ рН, зрелости влагалищного эпителия, индекса вагинального здоровья в зависимости от уровня HbА1c% в исследованных группах представлен в табл. 3.
При анализе данных микробиологической диагностики в группе женщин с клиническими проявлениями АВ было выявлено, что из 570 женщин «условно нормоценоз» [10] имели лишь 112 (19,6%) пациенток с СД (для здоровых — 43%); бактериальный вагиноз — 62 (10,8%) пациентки (для здоровых — 15%); а атрофический кольпит — 228 (40%) женщин (для здоровых — 1%).
В связи с жалобами на зуд и жжение в области наружных половых органов в сочетании со специфическими клиническими проявлениями со стороны урогенитального тракта мы использовали нозологическое понятие «атрофический диабетический вульвовагинит», который имел прямую корреляционную зависимость от уровня HbА1c% (табл. 4).
Клинически АДВ проявлялся зудом и жжением в области наружных половых органов (95% пациенток). При гинекологическом исследовании выявлялись гиперемия (93%), отечность (90%), реже — микроэрозии и трещины (26 и 41% соответственно).
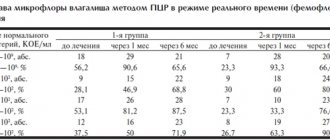
Изучение состава микрофлоры у 298 женщин, больных СД с клиническими проявлениями АДВ, выявило отсутствие лактобацилл в 87,6% случаев; обнаружены колонии условно-патогенных микроорганизмов, среди которых грамположительные кокки — 68,7%, эпидермальный стафилококк в низком титре (8–103 КОЕ/мл) — 11%. Высокий уровень pH (7,8–8,9) выявлялся у 93% женщин, а низкое значение зрелости вагинального эпителия (25—30) — в 89% случаев. Выраженный лейкоцитоз (количество лейкоцитов во влагалищном содержимом — 38,6±10 в поле зрения) определялся у 96,7% пациенток.
15 женщин основной группы с верифицированным «острым атрофическим диабетическим вульвовагинитом» (без признаков наличия грибковой инфекции по результатам бактериологического и бактериоскопического исследований) кроме строгой компенсации углеводного обмена использовали препарат эстрокад (вагинальные суппозитории эстриола 0,5 мг), глубоко интравагинально 2 раза в неделю в течение 3 мес. Контрольную группу составили 15 женщин с верифицированным острым атрофическим диабетическим вульвовагинитом, которым была предложена строгая компенсация углеводного обмена. Данные представлены в табл. 5—8.
У всех 15 (100%) пациенток основной группы через 3 мес использования препарата эстрокад уровень pH снизился в среднем на 30%, значение зрелости влагалищного эпителия повысилось на 15—25%, а индекс вагинального здоровья в подгруппах женщин с декомпенсацией основного заболевания увеличился на 40—50%. В контрольной группе изучение состава микрофлоры до и по окончании исследования выявило отсутствие лактобацилл у 93% пациенток, высокий уровень рН (7,8—8,9) в 87,6% случаев, низкое значение зрелости вагинального эпителия (25—30) — у 89% женщин и выраженный лейкоцитоз содержимого влагалища (38,6±10 лейкоцитов в поле зрения) — у 96,6%. У 98,7% женщин с СД 1-го типа и 93,4% с СД 2-го типа выявлена прямая корреляционная зависимость между длительностью СД, степенью компенсации углеводного обмена и рН содержимого влагалища.
Таким образом, специфические клинические проявления со стороны урогенитального тракта у женщин с СД имеют прямую корреляционную зависимость со степенью компенсации углеводного обмена, а АДВ является следствием и ранним маркером декомпенсации углеводного обмена. Представленные результаты терапии АДВ препаратом эстрокад показали высокую эффективность, безопасность и приемлемость этого препарата непосредственно после лечения. В комплексное патогенетическое лечение как острых, так и хронических АДВ у пациенток с нарушениями углеводного обмена в пери- и постменопаузе (помимо строгой компенсации углеводного обмена) необходимо включать местное применение препаратов, содержащих эстрогены, таких как препарат эстрокад, для нормализации индекса вагинального здоровья и повышения качества жизни.