Что такое рак простаты?
РПЖ представляет собой злокачественное новообразование, которое развивается из тканей предстательной железы.
Предстательная железа, или простата, – мужской репродуктивный орган, по размерам схожий с каштаном. Он находится под мочевым пузырем и охватывает передний отдел мочеиспускательного канала.
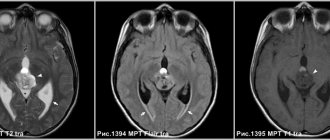
Рис. 1. МРТ (Т2-взвешенные изображения) картина поражения левой доли предстательной железы.
Золотой стандарт – трансректальная биопсия
Распространенный метод забора биоптатов из предстательной железы мужчины. Особенности трансректальной биопсии:
- Проводится под контролем УЗИ через прямую кишку.
- Врач делает 12 проколов иглой с режущими концами, на которых остаются частички тканей. Их консервируют и отправляют на экспертизу.
- Трансректальное вмешательство минимально травмирует ткани.
Недостатком считается то, что есть вероятность получения недостаточного количества биоптатов, что приводит к необходимости проведения повторной биопсии.
Разновидности рака предстательной железы
В 95% случаев РПЖ развивается из эпителиальных клеток собственных желез (их называют «ацинусы»), из которых сформирована периферическая часть предстательной железы. Эта форма болезни называется «ацинарная аденокарцинома». В остальных 5% случаев диагностируется интрдуктальная разновидность, для которой характерно более агрессивное течение.
Важная характеристика аденокарциномы – степень ее дифференцировки, которая выявляется при гистологическом исследовании биоптата или биоматериала, полученного в ходе операции. Дифференцировка сегодня выражается шкалой Глисона (Gleason), в соответствии с которой присваивается сумма баллов: от 6 (самый благоприятный прогноз) до 10 (самый неблагоприятный вариант).
Стадии
Онкологи различают четыре стадии рака простаты.
- Размеры новообразования очень малы, поэтому оно не прощупывается и не обнаруживается при УЗИ железы. Признаки заболевания обнаруживаются лишь при помощи специального теста на простатический антиген (ПСА).
- Опухоль увеличивается в размерах, но не выходит за пределы простаты. Ее можно обнаружить: при пальцевом исследовании прощупываются уплотнения, которые выявляются при УЗИ. Появляются проблемы с мочеиспусканием, болезненные ощущения.
- Злокачественная ткань поражает мочевой пузырь, прямую кишку и другие расположенные рядом органы. В моче появляется примесь крови, при мочеиспускании ощущается сильная боль.
- Опухоль метастазирует в другие органы: лимфатические узлы, печень, легкие, костную ткань. Состояние больного ухудшается, он ощущает упадок сил, нарушаются выделительные процессы.
Характерные признаки заболевания
Риск развития РПЖ растет с возрастом: средний показатель в этой категории заболевших – 68 лет. Существуют также факторы риска, то есть то, что повышает шанс появления онкологического заболевания. Современной медициной не выявлены достоверные факторы, которые приводят к повышению риска развития РПЖ (какие-либо препараты, характер рациона, вредные привычки, плохая экология и др.). Поэтому основным фактором остается возраста, а также возрастной гормональный дисбаланс (между эстрогенами и андрогенами).
Причины и факторы риска
Единственной причиной рака простаты является злокачественное видоизменение клеток, которые утрачивают свою исходную функцию и направляют вырабатываемую энергию на бесконтрольное деление. Как работает биологический механизм, запускающий этот процесс, пока установить не удалось. Тем не менее, основные факторы, увеличивающие вероятность развития опухоли, хорошо известны:
- возраст старше 65 лет – до 75% пациентов принадлежат к этой возрастной группе;
- нарушения гормонального фона, связанные с возрастными изменениями в организме;
- несбалансированное питание, чрезмерно насыщенное животными жирами;
- унаследованная предрасположенность к заболеванию;
- наличие патологий предстательной железы – аденомы, простатита, гиперплазии, аденоза;
- длительное пребывание под солнечными лучами или облучение искусственным ультрафиолетом;
- работа на вредном производстве с длительным воздействием канцерогенных соединений.
Симптоматика, первые признаки
На ранних стадиях злокачественная опухоль обычно не проявляет себя. Кроме аденокарциномы, у людей с повышенным риском развития РПЖ почти всегда присутствуют сопутствующие патологии (простатит, аденома простаты), и они могут давать симптоматику. Чаще всего встречаются следующие симптомы:
- частое мочеиспускание, включая ноктурию (то есть учащение позывов в ночное время);
- трудности при мочеиспускании;
- ощущение, что мочевой пузырь опорожнен не полностью;
- боль при мочеиспускании;
- гематурия, то есть кровяные включения в моче;
- гемоспермия – при эякуляции наличие примесей крови в сперме;
- костные боли, появляющиеся при метастазировании РПЖ в скелет.
Таким образом, чем выше стадия, тем больше вероятность проявления симптоматики. Чаще всего РПЖ обнаруживается во время профилактического обследования (оно рекомендовано всем мужчинам старше 40-ка лет). Такое обследование включает в себя:
- УЗИ простаты;
- пальцевое ректальное исследование;
- определение ПСА (простат-специфического антигена).
ПСА – это маркер, используемый для раннего выявления РПЖ. Он достаточно чувствителен и специфичен, чтобы заподозрить наличие рака на начальной стадии. Кроме ПСА, анализу могут подвергаться его производные – индекс здоровья простаты, плотность ПСА, соотношение свободного ПСА и общего.
Диагностика
Поскольку распознать заболевание по симптомам крайне сложно, важнейшее значение приобретает лабораторная и инструментальная диагностика рака простаты, в которую включают ряд исследований.
- Анализ сыворотки крови на ПСА. Гликопротеин, вырабатываемый клетками эпителиальной ткани простаты, служит специфическим маркером, позволяющим определять опухолевый процесс предстательной железы на ранней стадии.
- Анализ на ПСА 3. Еще один биомаркер, позволяющий судить не только о наличии злокачественного процесса, но и о размерах опухоли.
- УЗИ простаты. Выполняется при помощи специального датчика, который вводят в задний проход для обнаружения уплотненных участков железы.
- Биопсия. Наиболее точный метод диагностики раковых опухолей заключается в изъятии образцов опухолевой ткани при помощи тонкой полой иглы.
- Гистологический анализ. Взятый образец исследуют под микроскопом для изучения клеточной структуры и определения типа опухоли.
- Цитологический анализ. Микроскопическое исследование опухолевой клетки позволяет точно диагностировать рак и определить его агрессивность.
Внимание!
Вы можете бесплатно получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (высокотехнологичной медицинской помощи).
Чтобы узнать подробности, позвоните, пожалуйста, по телефону +7 , или можете прочитать более подробно здесь…
Методы диагностики
Основа диагностики РПЖ – биопсия предстательной железы, иными словами, морфологическая верификация.
Показания к биопсии:
- Уровень ПСА выше нормального. Следует отметить, что верхняя граница нормы (4 нг/мл) может быть понижена для относительно молодых мужчин (возраст 40-50 лет) до 2-2,5 нг/мл.
- Подозрительные изменения очагового характера (гипоэхогенные очаги), выявленные при УЗИ (или ТРУЗИ) либо МРТ. Сейчас рекомендуется делать биопсию после МРТ, а не до нее, потому что это улучшает толкование изменений. Важно: делать МРТ лучше в специализированном учреждении, специалисты которого имеют нужный опыт, а диагностическое оборудование – специализированное ПО (то есть мультипараметрическая МРТ).
- Обнаруженные в ходе пальцевого исследования очаговые изменения.
Важно! Если уровень ПСА ниже верхней допустимой границы, это не всегда говорит о том, что РПЖ отсутствует. Примерно 25% случаев заболеваемости отмечаются на фоне нормальных значений этого показателя. Поэтому решение о необходимости проведения биопсии должно приниматься после комплексного обследования, которое включает все виды диагностики.
Варианты биопсии простаты:
- Стандартная, или трансректальная мультифокальная. Такая биопсия делается обычно амбулаторно. Выполняется через прямую кишку, в ходе процедуры берут не менее 6-ти биоптатов (лучше 10-12). Недостаток этого вида биопсии – вероятность пропустить РПЖ, если он имеет малые размеры и локализуется в определенных зонах предстательной железы.
- Промежностная. Проводится обычно по расширенной методике (сатурационная процедура). В ходе нее беру гораздо больше биоптатов – от 20-ти. Такая биопсия показана тем, кому проводились стандартные биопсии, но они не выявили РПЖ, при этом риск развития заболевания сохраняется. Еще одно показание: планирование органосохраняющего лечения (фокальная терапия, брахитерапия). Недостатки методики – необходимость обеспечения пациенту спинальной анестезии, использования специализированного оборудования, стационарные условия проведения. Однако именно такая биопсия дает возможность наиболее точно выявить характер патологических изменений.
- Fusion. Это современная разновидность биопсии предстательной железы, при которой используется современное оборудование и данные МРТ, проведенной заблаговременно. Широкое применение такой методики сейчас ограничено ввиду отсутствия в лечебных учреждениях нужного оборудования.
Рис. 2 А., 2 Б. Фьюжн-биопсия. Мастер-класс в НМИЦ онкологии им. Н.Н. Петрова
Пальпация предстательной железы через прямую кишку при раке простаты
Благодаря близкому расположению простаты к прямой кишке уролог может провести пальцевое ректальное исследование. Простой метод позволяет выявить наличие опухоли, поскольку она отличается от других тканей неподвижностью, увеличенной плотностью. В большинстве случаев новообразования располагаются в периферической зоне, поэтому врач может нащупать их через прямую кишку.
Здоровая железа имеет эластичную консистенцию, симметричные контуры и реагирует при надавливании. При пальпации врач обращает внимание на:
- асимметрию и нечеткость контуров;
- бугристость поверхности;
- неподвижность при надавливании;
- наличие плотной опухоли, выступающей в просвет кишки.
Пальцевое исследование – первичный метод диагностики, который обязательно проводится при осмотре мужчины. Результат подкрепляется лабораторными и инструментальными исследованиями.
Стадии рака предстательной железы
Стадирование РПЖ и определение группы риска рецидивирования после возможной терапии производятся после гистологической верификации заболевания.
Стадирование при стандартном подходе подразумевает остеосцинтиграфию и МРТ органов малого таза. Магнитно-резонансная томография нужна, чтобы выявить степень локального распространения процесса в зоне простаты (прорастание в семенные пузырьки, выход новообразования за капсулу железы), а также определить, есть ли поражение регионарных лимфоузлов.
Рис. 3. Пути распространения рака предстательной железы в лимфоузлы таза.
В случае необходимости дополнительно проводится КТ органов груди или брюшной полости.
Цель проведения остеосцинтиграфии – выявление возможного поражения опухолью костей скелета.
Могут назначиться дополнительные исследования – рентгенография (прицельная), УЗИ, урофлоуметрия.
Группа риска определяется, исходя из уровня ПСА на момент до начала терапии, суммы Глисона, согласно данным биопсии, и клинической стадии болезни. Группа риска может быть низкой, промежуточной и высокой. Ее определение крайне важно, чтобы выбрать оптимальный метод лечения.
Группы риска
| Низкая | Промежуточная | Высокая |
| сТ2а или менее | сТ2в — сТ2с | сТ3а |
| ПСА до 10 нг/мл | ПСА от 10 до 20 нг/мл | ПСА более 20 нг/мл |
| сумма Глисона 6 | сумма Глисона 7 | сумма Глисона 8-10 |
Признаки рака и заболевания простаты
Симптомы рака простаты напоминают симптомы гипертрофии — увеличения простаты в результате доброкачественного роста органа. Тем не менее, опухоль развивается в периферической части железы, в отличие от доброкачественного роста, поэтому она дает симптомы довольно поздно и имеет длительный бессимптомный период.
Кроме того, среди многих пожилых мужчин распространены симптомы простатита. Они обычно связаны с воспалением этой железы и тоже схожи с признаками рака.
Симптомы рака предстательной железы включают затруднение мочеиспускания, связанное с давлением на уретру, вызванным увеличением предстательной железы .
При больной простате возникают проблемы с мочеиспусканием, такие как:
- Частое мочеиспускание (поллакиурия);
- Необходимость ходить в туалет несколько раз ночью (никтурия);
- Несмотря на позыв на мочевой пузырь, моча вытекает в небольшом количестве, слабой струей;
- Внезапные позывы к мочеиспусканию. Появляются быстро, даже вскоре после опорожнения мочевого пузыря, вынуждая пациента быстро посещать туалет;
- Недержание мочи — пациент не может остановить отток мочи, особенно часто это происходит во время напряжения или кашля. Пациенты могут также жаловаться на спонтанную утечку мочи после окончания мочеиспускания;
- Трудности с началом мочеиспускания. Несмотря на полный мочевой пузырь, пациент должен сосредоточиться на мочеиспускании и ему нужно много времени, чтобы моча начала вытекать из уретры;
- Пациенты также жалуются на проблемы с прекращением мочеиспускания, которое уже началось.
Частое мочеиспускание
При раке предстательной железы симптомом также является слабый, прерывистый поток мочи.
Методики лечения
В соответствии с результатами многоцентрового проспективного рандомизированного исследования ProtecT (2016) лучевая терапия и хирургическое лечения демонстрируют раную противоопухолевую эффективность и обеспечивают надежный контроль над заболеванием у большинства (более 90%) больных раком предстательной железы с низким и промежуточным риском рецидива заболевания. В настоящее время решающим фактором при выборе противоопухолевого лечения у этой категории больных является безопасность терапии и снижение риска осложнений.
Рассмотрим основные виды терапии: хирургическое лечение, брахитерапия, стереотаксическое облучение, сочетанная лучевая терапия.
Гормонозависимая злокачественная опухоль простаты — срок жизни
Повышение уровня тестостерона в организме мужчины может привести к развитию гормонозависимого рака предстательной железы. Прогноз выживаемости при такой форме рака негативный. Опухоль отличается быстрым прогрессом, при появлении метастазов продолжительность жизни при раке простаты этого типа составляет не более 3-4 лет. Если обнаружена онкология предстательной железы, прогноз выживаемости составляется после полного обследования пациента, постановки диагноза.
В Юсуповской больнице проводится комплексная диагностика рака простаты. Определяется вид злокачественного заболевания и стадия развития опухоли. Диагностика заболевания проходит с помощью различных методов исследования:
- Тест ПСА. Проводится анализ крови на онкомаркер рака предстательной железы. Этот анализ позволяет выявить злокачественную опухоль на первой стадии развития. Ежегодно анализ назначают мужчинам, которые имеют наследственную предрасположенность к раку простаты.
- Проводится осмотр пациента врачом-урологом или онкологом. Врач выполняет ректальную пальпацию, определяя наличие образования, его локализацию, размер.
- Назначается трансректальное УЗИ предстательной железы.
- Для определения степени прорастания опухоли в соседние ткани, наличия метастазов в регионарных или отдаленных лимфатических узлах и органах врач направляет пациента на МРТ, КТ или ПЭТ-КТ исследования.
- После проведенных исследований назначают биопсию тканей простаты, пораженных опухолью.
В зависимости от показателей исследований, возраста, состояния здоровья пациента врач-онколог назначает лечение. В онкологическом отделении больницы применяют инновационные методы лечения рака простаты. Записаться на консультацию к врачу можно по телефону.
Хирургическое вмешательство
РПЭ, или радикальная простатэктомия, представляет собой хирургическое вмешательство по удалению предстательной железы, а также окружающей клетчатки и лимфоузлов. При такой операции с железой единым блоком удаляют семенные пузырьки и участок канала уретры.
Рис. 4. ПЭТ-КТ изображения больного М. с поражением тазовых лимфоузлов
РПЭ различается по виду доступа и степени инвазивности:
- Открытая. Проводится двумя основными видами доступа: промежностным и позадилонным.
Позадилонный доступ предполагает разрез в нижней части живота, через который удаляется простата и местные ткани.
Промежностная методика – это открытый способ, при котором небольшой надрез делается в зоне между анусом и кожно-мышечным мешком, то есть мошонкой. Методика позволяет удалить простату, но при ее применении нельзя также удалить неблагоприятные ткани и узлы, расположенные около железы. Если после проведения промежностной операции в органах малого таза обнаружатся раковые клетки, нужно будет дополнительно делать лимфаденэктомию. Сейчас промежностная методика применяется крайне редко.
- Лапароскопическая. Основные доступы: через предбрюшинное пространство или брюшную полость. Для выполнения операции делается несколько небольших разрезов на передней стенке живота. Через них в предбрюшинное пространство или брюшную полость вводят специальные манипуляторы и удаляют предстательную железу, жировую клетчатку малого таза, а также регионарные лимфатические узлы.
Лапароскопическая методика – наиболее щадящая. Врач имеет доступ к пораженному органу через маленький разрез внизу живота. В него вводится камера и все нужные хирургу инструменты. Камера подает на экран изображение органов малого таза, благодаря чему врач полностью контролирует процесс, а пациент получает минимум вреда. При таком способе минимизированы кровопотери, посторонние органы почти не травмируются, эректильная функция сохраняется частично или полностью и т. д.
Рассмотрим также наиболее распространенные осложнения, которые могут возникнуть после операции на простате:
- Недержание мочи. Это осложнение возникает в 95% случаев сразу после снятия с мочевого пузыря пациента специального катетера. Далее в 45% случаев это осложнение проходит через 6 месяцев после удаления РПЖ. В 15% случаев недержание сохраняется до 1 года.
- Потеря эректильной функции – полная или частичная. Существенно снизить такое осложнение врачам удается при проведении лапароскопической простатэктомии. При такой методике минимизировано повреждение нервных стволовых клеток органов малого таза. Если после хирургического вмешательства наблюдается расстройство эректильной функции, то пациенту прописывается курс медикаментозной терапии и наружных препаратов, расширяющих сосуды.
Лечение рака простаты и шансы на выздоровление
При локализованных формах рака простаты (T1-2N0M0) высока вероятность стойкого излечения после радикальной простатэктомии (удаления простаты) и/или курса лучевой терапии. Хирургическое лечение рака простаты в Германии по технологии Да Винчи позволит полностью удалить опухоль, сохранив нервы и сосуды, питающие анатомические структуры. При выполнении робот-ассистированной операции вероятность сохранить потенцию и функцию удержания мочи превышает 90 %.
Если онкологический процесс уже распространившегося на окружающие простату органы, пациентам на стадии заболевания ≥T3a может быть предложена радикальная простатэктомия (РПЭ), совмещенная с лимфаденэктомией (удалением пораженных лимфатических узлов). В этом случае робот-ассистированная операция по технологии Да Винчи обеспечивает высокую точность хирургического вмешательства и хороший функциональный результат в отдаленной перспективе, сохранение потенции не является приоритетом.
На стадии Т3b — Т4 при выявлении метастазов в отдаленных органах радикальное удаление опухоли возможно далеко не всегда. Поэтому так важно обращаться к врачу при первых признаках рака простаты, когда хирургическое лечение еще возможно и, в идеале, может быть выполнено по нервосберегающей технологии.
Брахитерапия
Брахитерапия представляет собой введение в ткани источников излучения. Эта методика – самая «молодая» среди способов лечения РПЖ. Сегодня это один из наиболее востребованных методов облучения простаты, обеспечивающий очень высокую избирательность подведения дозы. Основная особенность брахитерапии заключается в том, что простата облучается изнутри – источник облучения вводится непосредственно в нее. Такой метод дает возможность применять высокие дозы (100-140 Гр и более), при этом избегая высокого риска лучевого поражения не подверженных раку тканей.
Стремительный рост клинического применении брахитерапии, по сравнению с хирургическими вмешательствами, обуславливается высокой эффективностью, которая сопоставима с простатэктомией, при гораздо более низкой частоте возникновения осложнений.
Различают 2 вида брахитерапии, в зависимости от способа введения источника излучения в железу и его мощности:
- высокомощная, для которой характерно кратковременное введение источника излучения высокой мощности в ткани;
- низкомощная – источник низкой мощности устанавливается на все время лечения.
При проведении низкомощностной брахитерапии в ткани простаты вживляется источник излучения и остается в них до полного распада. Долгое время при РПЖ именно этот вид брахитерапии применялся чаще всего. Наиболее часто для выполнения терапии используется изотоп радиоактивного йода, то есть I125.
Согласно многочисленным исследованиям, брахитерапия низкой мощности обеспечивает не очень высокую точность облучения. Это объясняется смещением источника излучения, изменением формы и размеров простаты, затрагиванием прилежащих здоровых органов. Ввиду этого низкомощностная методика показана в основном пациентам с самыми начальными стадиями, когда опухоль небольшая и не выходит за пределы железы. Такая брахитерапия имеет и другие существенные недостатки. Первый – это высокая частота осложнений, возникающих со стороны мочевыводящих путей, может даже возникнуть острая задержка мочи и необходимость эпицистостомы, то есть формирования надлобкового мочепузырного свища, на долгий срок. В основе осложнений – отек предстательной железы из-за того, что в ней остается несколько сотен зерен (инородных тел). Кроме того, радиоактивные зерна, если они долго находятся в организме, представляют собой источники излучения, представляющие определенную опасность для других людей. Из-за этого контакт пациента с родными ограничен (нельзя близко общаться с маленькими детьми).
Рис. 5. Высокомощностная (высокодозная) брахитерапия
Самая современная методика внутритканевой терапии – высокомощностная брахитерапия. Источники излучения автоматически загружаются и извлекаются. Эта лучевая терапия обладает принципиальным плюсов – высокой точностью облучения, достигаемой путем введения игл под контролем специального УЗ-аппарата. Одновременно в автоматическом режиме рассчитываются дозы и возможность быстрой корректировки плана лучевого лечения. Источник излучения находится в организме пациента временно, поэтому уровень осложнений – самый низкий, по сравнению со всеми радикальными методиками терапии РПЖ, включая низкодозную разновидность брахитерапии.
Технологические особенности методики позволяют предлагать ее большинству больных, вне зависимости от размеров злокачественного новообразования и его распространенности за пределы простаты. Кроме того, высокомощностная брахитерапия – это «золотой стандарт» при комбинированном лечении, то есть одновременном использовании с дистанционным облучением у больных с неблагоприятными характеристиками новообразования.
Самый большой недостаток высокомощностной методики – высокие требования, касающиеся квалификации медицинского персонала, а также необходимость использования высокотехнологичного оборудования. Этим объясняется малая распространенность метода в России.
Противопоказания к брахитерапии подразделяются на общие и урологические. Самые частые урологические противопоказания – это серьезные нарушения процесса мочеиспускания:
- IPSS (индекс опросника качества мочеиспускания) более 20-ти;
- объем остаточной мочи более 50-ти мл;
- самая высокая скорость мочеиспускания, зарегистрированная при урофлоуметрии, – до 10 мл/сек;
- проведенная трансуретральная резекция мягких тканей предстательной железы менее чем за 9 месяцев до предполагаемой брахитерапии.
Нужно отметить, что большой объем простаты, который имеет значение для низкодозной брахитерапии (50-60 см3), почти не ограничивает возможности лечения в режиме высокомощностной методики.
Общие противопоказания:
- отдаленные метастазы;
- злокачественные опухоли, инфекции и воспаления мочевого пузыря;
- злокачественные опухоли, инфекции и воспаления прямой кишки;
- непереносимость анестезии;
- отсутствие прямой кишки ввиду предшествующих операций.
Данные противопоказания относятся не только к брахитерапии, но и к другим методикам лучевой терапии РПЖ.
Какой метод лечения более эффективен
Эффективность хирургического и медикаментозного метода одинакова, однако преимуществом медикаментозной гормонотерапии является возможность проведения прерывистого лечения и его отмены, что невозможно после удаления яичек.
Гормонотерапия РПЖ может использоваться отдельно или сочетаться с другими методами лечения, а также применяться для лечения рецидива заболевания.
Следует знать, что гормонотерапия не излечивает РПЖ, но может замедлить его рост, уменьшить размеры опухоли и облегчить симптомы, вызванные опухолью!
Стереотаксическое облучение
СТЛТ (стереотаксическая лучевая терапия) – высокоточная методика лечения очага РПЖ высокими дозами ионизирующего излучения.
Рис. 6. Стереотаксический лучевой ускоритель
Сегодня СТЛТ при раке простаты реализуется несколькими основными методами, каждый из которых обладает своими особенностями, плюсами и минусами:
- Протонное облучение. Основное преимущество – наличие пика Брегга, который обеспечивает высокие градиент дозировки. Однако такая техника более трудоемкая и на порядок больше стоит, если сравнивать с фотонной лучевой терапией (в т.ч. с аппаратом кибер-нож и СТЛТ, проводимой на линейном ускорителе).
- Cyber-Knife (установка кибер-нож) отличается существенным плюсом, заключающемся в почти неограниченном числе направлений пучка излучения. Это дает возможность достаточно точно повторить геометрию новообразования. К недостаткам относятся: длительность сеанса до 40-50 минут (в течение этого времени повышается вероятность смещения больного и риск изменение взаимного расположения и геометрии органов малого таза), а также малая равномерность распределения дозировки в очаге.
- СТДТ на линейном ускорителе по технологии RapidArc и VMAT отличается малой продолжительностью сеанса (4-6 минут), комфортностью для пациента и равномерностью распределения дозировки в очаге заболевания.
Сравнительная характеристика техник СТЛТ простаты
| Характеристика | Протонная | На аппарате кибер-нож | По методам ViMAT и RapidArc |
| Цена | + | ++ | +++ |
| Длительность сеанса облучения | ++ | + | +++ |
| Лучевая нагрузка на пораженные органы | +++ | ++ | ++ |
СТЛТ применяется, когда больного можно отнести к группе низкого или промежуточного риска, при условии, что злокачественный процесс не вышел за пределы простаты: во время инструментальных обследований не получено данных о поражении регионарных лимфоузлов, нет МР-признаков того, что процесс вышел за пределы капсулы железы.
Нужно сказать, что из всех радикальных методов лечения РПЖ техника СТЛТ является единственной неинвазивной и часто выбирается, если лечить пациента другими методами нельзя из-за наличия противопоказаний.
Этапы проведения СТЛТ:
- В ткань простаты под контролем УЗИ или ТРУЗИ имплантируются рентгенконтрастные золотые маркеры.
- Спустя 2-3 дня делаются КТ- и МРТ-топометрические исследования. С целью топометрической подготовки применяется КТ-симулятор с широкой апертурой, это нужно для того, чтобы точно оконтурировать органы и спланировать облучение.
- После КТ и МРТ полученные результаты направляются в планирующую систему комплекса для СТЛТ. Изображения КТ и МРТ совмещаются в планирующей системе методом сопоставления локализации имплантированных на первом этапе маркеров.
- Когда дозиметрическое планирование завершено, можно проводить лучевую терапию, состоящую из 5-ти сеансов (по 1-му раз в день).
Весь курс лечения, включая подготовку, длится 7-8 дней и может реализовываться амбулаторно.
Может ли профилактика предотвратить заболевание?
Нет надёжных данных, подтверждающих, что диета с низким содержанием животных жиров может предотвратить или снизить интенсивность развития заболевания. Возможно, вы читали о пользе употребления продуктов, богатых селеном, или витамина E для профилактики рака. Исследование Selenium and Vitamin E Cancer Prevention Trial не подтвердило эту гипотезу.
Добросовестные врачи говорят не о профилактике, а о раннем выявлении рака простаты. Ранняя диагностика позволит пройти курс лечения без ущерба для качества жизни и удалить опухоль, сохранив потенцию и функцию удержания мочи.
Сочетанная лучевая терапия
Проведение сочетанного облучения целесообразно пациентам, которые относятся к группе высокого риска рецидивирования РПЖ. Это связано с риском того, что поражены регионарные лимфоузлы. Такое лечение предполагает комфортное дистанционное облучение зоны малого таза на протяжении 1,5 месяцев: 1 сеанс в день на протяжении 5-ти дней с перерывом на выходные, всего 25 сеансов. Облучение проводится на линейном ускорителе, к простате подводится дополнительная доза в виде 2-х сеансов высокомощностной брахитерапии или нескольких сеансов стереотаксического облучения.
МРТ малого таза с контрастированием
Магнитно-резонансная томография – точный метод диагностики, который используется для уточнения результатов ультразвукового исследования. Для определения характера опухоли проводят МРТ с констатированием – в вену вводят препарат с парамагнетическими веществами, которые делают изображения тканей и сосудов более четкими. Злокачественная опухоль быстро накапливает контраст, после чего ее легко распознать на снимке. Мультипараметрическая МРТ безопасна для организма, введенные вещества не вызывают аллергических реакций. Томография позволяет определить расположение опухолей, степень поражения окружающих тканей. МРТ назначают при подготовке к фьюжн биопсии.
Подозрительные очаги классифицируют по шкале Pirads:
- 1-2 балла – рак отсутствует.
- 3-4 бала – возможная онкология.
- 5 баллов – высокий риск рака.
Рецидивирование рака простаты при лучевой терапии
Лучевая терапия относится к самым эффективным и современным методам лечения пациентов с раком простаты. Однако после ее применения возможны рецидивы.
Методом самой ранней диагностики возможного рецидива РПЖ является определение уровня ПСА, он же служит основанием к применению более дорогих и сложных способов диагностики (остеосцинтиграфия, МРТ, ПЭТ).
Рис. 7. ПЭТ-КТ изображение поражения предстательной железы у больного В.
После облучения уровень ПСА должен понизиться, если сравнивать с исходным показателем. Большое значение для оценки эффективности терапии имеют динамика снижения и минимальный показатель. При этом нужно помнить, что определять уровень ПСА нужно каждый раз в одной и той же лаборатории, так как тест-системы имеют разную чувствительность, поэтому могут быть значимые расхождения в показателях, если забирать биоматериал у одного и того же пациента, но исследовать его в разных лабораториях.
Общепринятое определение рецидива после лечения – это повышение уровня ПСА на более чем 2 нг/мл относительно самого низкого его значения. Значение самого низкого уровня ПСА индивидуально и зависит во многом от исходных клинических показателей новообразования (степень злокачественности, локальная распространенность процесса).
При определении уровня ПСА после облучения нужно принимать во внимание 3 важных фактора:
- Ионизирующее излучение разрушается опухолевые клетки в простате. Это может на первом этапе сопровождаться временным повышением ПСА, по сравнению с начальным значением. Поэтому делать контрольный анализ после облучения нужно не раньше, чем через 3 месяца после его окончания. Дальнейшие определения уровня ПСА проводятся 1 раз в 3 месяца на протяжении нескольких лет.
- Процесс понижения ПСА после облучения может протекать длительно, в отличие от радикальной простатэктомии: уже к концу первого месяца после операции обычно уровень ПСА доходит до низшего значения. Это объясняется тем, что сохраненная предстательная железа продолжает вырабатывать малое количество ПСА. В медицине описаны случаи, когда после облучения уровень ПСА постепенно снижался на протяжении 5-ти лет наблюдения.
- У 30% пациентов после облучения могут быть периоды повышения ПСА во время последующего наблюдения. Этот феномен называется «доброкачественный рецидив» либо «биохимический скачок». Уровень маркера повышается очень незначительно (до нескольких десятых долей нг/мл) и временно. В основе этого процесса лежит то же представление о том, что простата сохраняется и вырабатывает малое количество ПСА. Обычно это наблюдается у больных с аденомой и большим объемом железы.
Вопросы и ответы
Сколько живут с раком простаты?
Около 80% мужчин, прошедших лечение рака простаты, живут более 10 лет. При отсутствии лечения срок жизни зависит от стадии болезни и агрессивности опухоли, причем летальный исход в течение нескольких лет становится неизбежным.
Как выглядит рак простаты?
Внешние признаки опухоли отсутствуют, поэтому самостоятельно обнаружить наличие онкопатологии невозможно. Начальные симптомы напоминают признаки простатита или аденомы простаты. Для диагностики необходимо обратиться к урологу или онкологу.
Лечится ли рак простаты?
В настоящее время злокачественные опухоли простаты в большинстве случаев благополучно излечиваются при условии своевременного выявления. При появлении любых признаков ухудшения мочеиспускательной функции необходимо как можно скорее посетить уролога и пройти качественное обследование.
Внимание! Вы можете бесплатно вылечить это заболевание и получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (выскокотехнологичной медицинской помощи). Чтобы узнать подробности, позвоните, пожалуйста, по телефону +7(495) 775-73-60, или на странице ВМП по ОМС
Прогноз
Показателями выживаемости определяется эффективность не только облучения, но и других радикальных методик терапии РПЖ. Согласно данным многочисленных исследований, основной фактор, влияющий на выживаемость пациентов после облучения, – это величина дозы, подведенной к предстательной железе. По сегодняшним представлениям доза должна быть от 72 Гр.
Таблица зависимости 5-летней выживаемости без рецидива от суммарной очаговой дозы, которая была подведена к простате
| Показатель суммарной очаговой дозы, Гр | Процент 5-летней выживаемости без рецидивов |
| 65 | 48-52% |
| 70 | 57-60% |
| 80 | 82-84% |
| 90 | 91-95% |
Устаревшие методики облучения не позволяли воздействовать на простату в указанных дозах без сильного негативного влияния на находящиеся рядом органы. Это объясняет сравнительно малое количество пациентов, выбравших облучение в качестве метода лечения.
Современные методики дают возможность подводить к предстательной железе дозы, которые превышают 90 Гр. Уровень лучевых осложнений при этом низок. Поэтому обеспечиваются равные или превосходящие показатели выживаемости, по сравнению с оперативным вмешательством.
Кто в группе риска?
Прежде всего, это мужчины старше 45 лет с генетической предрасположенностью к заболеванию. Подтверждено, что наследственные факторы играют ключевую роль в развитии клинически значимых форм рака простаты. Если у отца был диагностирован рак простаты, риск для сына увеличивается как минимум в 2 раза. Выявление заболевания у двух и более близких родственников (например, у отца и брата) повышает риск уже в 5 – 11 раз.
Случаи рака груди или яичников у матери и/или сестры – еще один повод внимательнее следить за своим здоровьем. Мутации в генах BRCA1/2 многократно повышают риск агрессивного, рано проявляющегося рака молочной железы и предстательной железы. Для мужчин в возрасте 50 – 70 лет без неблагоприятного семейного анамнеза статистически значимое влияние на рост риска РПЖ оказывают артериальная гипертензия и окружность талии >102 см. Индекс массы тела (ИМТ) от 32,5 ухудшает прогноз результативности лечения на 30 %.
Какое лечение назначается в таких случаях?
Решение о методах лечения принимается на основе жалоб пациента, общего состояния его здоровья, возраста и имеющихся заболеваний. Обычно назначают медикаментозную терапию альфа-блокаторами, альфа-5 ингибиторами редуктазы, низкими дозами ингибиторов 5-фосфодиэстеразы (PDE5i) и их комбинациями.
Пациентам, которым не помогло медикаментозное лечение, может быть рекомендовано хирургическое вмешательство:
- малоинвазивная эндоскопическая лазерная хирургия;
- TUR-простатэктомия;
- робот-ассистированная изолированная трансвезикальная простатэктомия;
- открытая простатэктомия при сильном увеличении железы.
Оценка риска метастатического поражения лимфоузлов
| Группа риска | Стадия РПЖ | ПСА, нг/мл | Сумма баллов по шкале Глисона | Вероятность метастазирования в лимфоузлы | Выживаемость без рецидивов в течение 10 лет |
| Низкий. Все факторы | T1 – T2a | < 10 | 2 — 6 | < 5 % | 70 – 90 % |
| Промежуточный. один из факторов | T2b – T2c | 10 — 20 | 7 | 5 – 15 % | 60 – 75 % |
| Высокий один из факторов | T3a | > 20 | 8 — 10 | 16 – 49 % | 43 – 60 % |
Основные пути разрастания метастазов
- По кровеносным сосудам (гематогенный путь)
- По лимфатическим сосудам (лимфогенный путь)
Наиболее уязвимы печень, лёгкие, головной мозг, костный мозг, кости осевого скелета. Основные органы-мишени – тазовые и забрюшинные лимфатические узлы, подвздошные лимфоузлы, реже органы ЦНС.