Что такое бактериофаги?
xорошо известно, что бактериофаги умеют адаптироваться к новым условиям благодаря мутациям, но из признаков «живого» им присущи только способность к размножению и передаче потомкам наследственной информации. Именно эти свойства позволили человеку использовать их как альтернативу антибиотикам для борьбы с инфекциями и уничтожения болезнетворных бактерий.
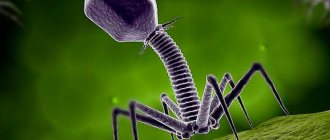
Бактериофаги — это вирусы, мельчайшие природные структуры, похожие на молекулярные кристаллы. Но, в отличие от большинства известных человечеству вирусов, они поражают не высшие организмы (например — человека), а только низшие — одноклеточные, недаром «бактериофаг» буквально переводится как «пожиратель бактерий». Бактериофаги устроены настолько просто, что даже не могут размножаться самостоятельно – для этого им, как и другим вирусам, нужна «чужая» живая клетка.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
ВОЗ предупреждает, что мир вскоре вступит в «постантибиотиковую» эру, когда лечить обычные бактериальные инфекции будет нечем. И на этом фоне фаготерапия выглядит весьма перспективным направлением, развитие которого может привести к созданию эффективных персонализированных методов лечения заболеваний. Для этого есть как необходимые знания о фагах и механизмах их взаимодействия с бактериальными клетками, так и технологии работы с вирусными агентами.
Для фаговой терапии сегодня используют только вирулентные лизирующие фаги, в основном «хвостатые» фаги порядка Caudovirales, а также нитчатые фаги семейств Leviviridae (с одноцепочечным РНК-геномом) и Inoviridae (с одноцепочечным кольцевым ДНК-геномом).
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Из чего состоит бактериофаг
Типичный фаг состоит из «головы» с плотно упакованной генетической программой, состоящей из нуклеиновых кислот (ДНК или РНК), и «хвоста», с помощью которого «впрыскивает» свои гены в клетку бактерии. Зараженная бактерия начинает с помощью собственных внутриклеточных систем и ресурсов синтезировать белки и нуклеиновые кислоты, необходимые для сборки новых вирусных частиц. Зрелые фаги выходят на поиски новой добычи, а «родительская» бактериальная клетка погибает.
Благодаря последним исследованиям стало понятно, что бактериофаги играют важную для поддержания глобального «микробного баланса» роль в биосфере: каждые двое суток они уничтожают половину мировой популяции бактерий и тем самым препятствуют этим быстро размножающимся организмам покрыть толстым слоем земную поверхность.
Бактериофаги появляются везде, где живут бактерии: на суше и в океанах, в почве и в воде, в растениях и животных. Даже в желудочно-кишечном тракте человека содержится около 1012 бактериофагов – на порядок больше, чем звезд в нашей Галактике! И хотя размер фаговых частиц не превышает 0,0001 мм, биомасса фагов на планете достигает фантастической цифры – 1 млрд тонн. Поэтому эти невидимые глазом, но вездесущие создания называют иногда «темной материей» биосферы.
«Счетчики» бактерий
Бактериофаги служат не только разносторонним терапевтическим и «дезинфицирующим» средством, но и удобным и точным аналитическим инструментом микробиолога. К примеру, благодаря своей высокой специфичности они являются природными аналитическими реагентами для выявления бактерий определенного вида и штамма.
В простейшем варианте такого исследования в чашку Петри с питательной средой, засеянную бактериальной культурой, добавляют по капле различные диагностические бактериофаги. Если бактерия окажется чувствительной к фагу, то на этом месте бактериального «газона» образуется «бляшка» — прозрачный участок с убитыми и лизированными бактериальными клетками.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Сейчас для выявления и количественного определения разных штаммов микроорганизмов применяют специальные референсные виды
фагов. Очень быстрые, работающие практически в режиме реального времени аналитические системы могут быть созданы на основе генетически модифицированных бактериофагов, которые при попадании в бактериальную клетку запускают в ней синтез репортерных флуоресцирующих (или способных к люминесценции) белков, таких как
люцифераза
. При добавлении к подобной среде необходимых субстратов в ней будет появляться люминесцентный сигнал, величина которого соответствует содержанию бактерий в образце. Такие «меченные светом» фаги были разработаны для детекции опасных патогенов — возбудителей чумы, сибирской язвы, туберкулеза, а также инфекций растений.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Преимущества бактериофагов
| Бактериофаги – антибактериальные агенты и природные антисептики | Безопасны и не токсичны, не имеют побочных эффектов, применяются у новорождённых детей, беременных и кормящих женщин |
| Действие бактериофагов не затрагивает полезную микрофлору организма, в отличие от антибиотиков | Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность |
| Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри | Бактериофаги выводятся из организма естественным путем |
Журнал для профессионалов аптечного бизнеса
Бактериофаги – одни из самых загадочных препаратов аптечного ассортимента. Сейчас они переживают второе рождение – и в нашей стране, и за рубежом снова возник к ним интерес, в журналах появляется не только пересмотр старых результатов, но и масса новых публикаций. Что можно рассказать покупателю, который заинтересовался именно этими средствами?
Вехи истории
Ученые обнаруживали следы жизнедеятельности бактериофагов задолго до того, как возникла вирусология. Британский бактериолог Эрнест Ханкин еще в 1896 году обратил внимание, что некий агент, способный проходить через очень тонкий фарфоровый фильтр, убивает возбудителя холеры. Развитию науки в новом направлении помешала Первая мировая, поскольку финансирование было перенаправлено разработчикам боевых газов, взрывчатых веществ и других более актуальных вещей.
Первооткрывателями бактериофагов считаются два исследователя – британский бактериолог Фредерик Творт, описавший странный фильтрующийся агент в 1915 году, и канадский микробиолог французского происхождения Феликс Д’Эрелль, независимо от Творта сообщивший о точно такой же находке в 1917-м.
За рубежом бактериофагами интересовались в первую очередь микробиологи, так что их находки не имели прикладного значения. Очень долгое время, например, фаг считался не вирусом, а ферментом. В СССР работы изначально велись медиками, в Грузии в 1923 году был создан будущий Всесоюзный центр фаготерапии, собравший на пике своего расцвета коллекцию из более чем 3 тыс. образцов. Однако затем и у нас, и за рубежом дело фаготерапии было практически уничтожено появившимися антибиотиками. Их массовое распространение после Второй мировой создавало впечатление, что изобретена панацея против инфекций и остальные направления исследований – тупиковые.
О бактериофагах ученые вспомнили, когда перед ними в полный рост встала проблема антибиотикорезистентности. Вирусы снова стали объектом экспериментов, в них увидели реальную альтернативу морально и иногда даже физически устаревшим противомикробным препаратам.
Натуральный враг
Бактериофаг, как следует хотя бы из названия, – вирус, пожирающий бактерии. По сути, это такой «грипп бактерий», только летальные исходы случаются куда чаще, чем в человеческом варианте.
Фаги гораздо разнообразнее, чем какие-либо другие известные вирусы, нельзя сказать, что они выглядят однотипно. Чаще всего в качестве иллюстрации используется изображение вирусов группы А по классификации Бредли, она же – группа V по классификации Тихоненко. Такие вирусы устроены сложнее всего, в них имеется головка и отросток с множеством дополнительных элементов (рис. 1). Всего групп выделяют шесть, только в одной из них геном фага представлен одноцепочечной РНК, во всех остальных случаях – это одна- или двухцепочечная ДНК.
Бактериофаги нельзя назвать гигантами, но по своим размерам они, скорее, относятся к крупным и занимают промежуточное положение между самыми большими вирусами табачной мозаики и вирусом иммунодефицита человека 1-го типа (рис. 2).
Вирусы группы А (V) вводят свою ДНК в клетку-мишень очень красиво, процесс чем-то напоминает посадку исследовательского модуля на поверхность Луны или Марса – точно так же он сначала «присаживается» на «опоры», а затем прижимается к мембране бактерии своей базальной пластиной, «пробуравливает» оболочку жертвы и впрыскивает в цитоплазму свой геном. После этого бактериофаг можно считать мертвым, если так вообще можно сказать о вирусах.
Быстро или помучиться?
По механизму действия все бактериофаги можно разделить на две большие группы. Первая – литические, или вирулентные фаги, которые в 100% случаев убивают инфицированную клетку сразу. В случае, показанном на рисунке 3, вирус сразу же уничтожает геном бактерии, используя его исключительно для целей собственной репликации. После наработки максимально возможного числа новых вирусных частиц микроб либо сразу гибнет в момент их выхода, просто разрываясь на части, либо погибает в ближайшее время из-за того, что все критически важные внутренние механизмы физически уничтожены.
Вторая группа – лизогенные, или умеренные фаги. Их геном встраивается в геном носителя и может существовать там в стелс-режиме долгое время, передаваясь из поколения в поколение. Активируется эта «бомба с замедленным действием» под влиянием различных неблагоприятных внешних факторов вроде дефицита питательных веществ. Единичные фаги умеют сочетать оба варианта, отпочковываясь и не разрушая бактериальную клетку сразу, лишь используя часть ее мембраны в качестве оболочки, одновременно оставляя «закладку» в ее геноме. На одного микроба могут напасть сразу несколько фагов с разными механизмами взаимодействия.
Плюсы и минусы
К несомненным достоинствам фагов можно отнести их прицельность, они специализируются на конкретных видах бактерий, так что можно отобрать именно те вирусы, которые уничтожают только патогенную флору, в отличие от антибиотиков, «бьющих по площадям», не разбирая при этом, свой или чужой попадает под обстрел.
По той же причине у фагов либо меньше побочных эффектов, либо их совсем нет. С резистентностью история схожая, она если и развивается, то только у конкретной бактерии-мишени. С помощью генной инженерии реально перепрограммировать вирус и натравить его на какого-нибудь другого возбудителя, еще не знакомого с вирусом.
Немаловажным фактором в пользу бактериофагов можно считать дешевизну и простоту их производства, особенно по сравнению с новыми перспективными антибиотиками. Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Недостатки тоже есть, и они тесно связаны с вирусной природой фагов. Прежде всего, их сложно хранить и перевозить, они весьма требовательны к условиям содержания. Кроме того, фаги способны нападать только на свободно плавающие бактерии, внутрь человеческих клеток их никто не пустит. Агрессивная среда желудка уничтожает многие вирусы, не разбирая, кто пришел с миром, а кто нет. И главное, для достижения максимального эффекта терапии бактерию-возбудителя нужно фаготипировать, то есть выделить и в лабораторных условиях доказать, что против нее может быть применен вот этот конкретный вирус.
Тем не менее фаги остаются перспективным направлением разработок, особенно после открытия канадского биолога Джозефа Бонди-Деноми, работающего в Калифорнийском университете. Он обнаружил новый вирус, прицельно уничтожающий синегнойную палочку, к которому устойчивость не развивалась. Изучая феномен, ученый выяснил, что ДНК этого фага защищена белковой оболочкой, с которой не справляется иммунитет бактерии. Если такой «чехол» надевать на все остальные ДНК и РНК бактериофагов, они могут стать еще более грозным оружием для своих естественных врагов. Главное, чтобы на человека не переключились.
Факты
В СССР активно изучали медицинское применение бактериофагов, но публикации были либо на русском, либо на грузинском языках, поэтому мировая наука о них не знала и с удивлением изучает и цитирует их уже в наше время.
Работы по бактериофагам удостоены Нобелевской премии. В 1969 году она была присуждена американским исследователям Максу Дельбрюку, Альфреду Херши и Сальвадору Лурия за открытия, касающиеся механизма репликации и генетической структуры вирусов.
В ГРЛС зарегистрированы и обращаются на российском рынке следующие разновидности бактериофагов: брюшнотифозный, дизентерийный, против клебсиелл и отдельно – против клебсиеллы пневмонии, против кишечной палочки, протейный, сальмонеллезный, стафилококковый и против синегнойной палочки. Самый часто используемый в амбулаторной практике препарат – стафилококковый фаг.
1. Keen E.C. Phage Therapy: Concept to Cure // Frontiers in Microbiology. 2012. 3: 238. doi: 10.3389/fmicb.2012.00238. 2. Keen E.C. Tradeoffs in bacteriophage life histories // Bacteriophage. 2014. 4 (1): e28365. doi: 10.4161/bact.28365. 3. Kutter Elizabeth et al. (2010). Phage Therapy in Clinical Practice: Treatment of Human Infections // Current Pharmaceutical Biotechnology. 11 (1): 69–86. doi: 10.2174/138920110790725401. 4. McGrath S. and van Sinderen D. (editors). Bacteriophage: Genetics and Molecular Biology (1st ed.). Caister Academic Press. 2007. ISBN 978-1-904455-14-1. 5. Stineke van Houte et al. The diversity-generating benefits of a prokaryotic adaptive immune system // Nature. 2021. DOI: 10.1038/nature17436. 6. Поздеев О.К., Федорова Е.Р., Валеева Ю.В. Микробиология. Бактериофаги/Учебно-методическое пособие для студентов медицинских вузов. Казань, 2012.
Алексей Водовозов
Журнал «Российские аптеки» №1-2, 2020
Вам могут понравиться другие статьи:
Подробности
Поздравляем коллег!
В конце декабря у всех очень напряженный график и одна большая проблема: нужно успеть выбрать и купить подарки для друзей и домашних. А руководителям – еще и подумать о коллективе. Как порадовать и…
Подробнее
Подробности
За зимней сказкой
Коронавирус не оставляет шансов на зарубежные поездки и в этом году, а низкие темпы вакцинации в России заставляют задуматься, а так ли уж и надо куда-то лететь или ехать. Но если сомнений нет,…
Подробнее
Подробности
Светлое будущее
Борьба с пигментацией – дело непростое, но достичь победы вполне реально. Результат будет зависеть от причины появления пятен, их «возраста» и метода терапии.
Подробнее
Подробности
Укрепить позиции
Лето позади, и может показаться, что волосы отдохнули и набрались здоровья. Но на самом деле вместо силы и блеска они зачастую обретают слабость и ломкость. Главная причина – изрядная порция ультра…
Подробнее
Подробности
Ночной дозор
Ночные кремы всегда вызывали неоднозначную реакцию. Одни критикуют подобные средства, утверждая, что в темное время суток кожа должна отдыхать, в то время как другие стремятся использовать все …
Подробнее
Подробности
Пополнение для книжной полки
Книги на медицинскую и околомедицинскую тематику выходят с завидной регулярностью. Издательства активно переводят зарубежные бестселлеры, отечественные врачи и ученые не отстают.Подробнее
Применение бактериофагов
Сразу после открытия бактериофагов, препараты на их основе стали использовать для борьбы с инфекционными болезнями человека. Однако в результате изобретения антибиотиков и недостатка знаний о бактериофагах их лечебный потенциал не был реализован.
Спустя полстолетия бактериофагами заинтересовались молекулярные биологи. Они выяснили, что эти простые «наноустройства» с короткими генетическими программами являются удобными объектами для экспериментальных исследований по изучению устройства и работы генома. Дальнейшее изучение фагов и механизмов, с помощью которых бактерии защищаются от врагов, открыло науке один из самых эффективных инструментов редактирования генома – CRISPR-CAS, основанный на системе «бактериального иммунитета».
Фаги нашли применение в разных сферах человеческой деятельности, включая био- и нанотехнологии. Например, как простые системы для наработки белков с заданными свойствами или как основа для создания материалов с заданной архитектурой в каталитической химии.
В качестве «умных» молекулярных устройств их используют для транспорта лекарств в организме и как диагностические сенсоры – например, для выявления патогенных бактерий в продуктах питания. Препараты фагов применяются для дезинфекции в сельском хозяйстве и в пищевой промышленности. Это увеличивает экологическую чистоту продуктов.
Но все-таки медицина, как и столетие назад, остается главной областью применения этих врагов бактерий. С ростом лекарственной устойчивости бактерий к химическим антибиотикам возросло значение фаготерапии для профилактики и лечения инфекционных болезней человека.
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc
. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
Современная история
К настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний.
Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.
Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
В качестве специфичных агентов, уничтожающих бактерии, бактериофаги сегодня находят применение в терапии заболеваний не только людей, но и животных, а также для защиты растений и при консервации пищевой продукции. Так, в 2006 г. FDA разрешила применение бактериофаговых коктейлей для обработки мясных и других сельскохозяйственных продуктов. В этом случае фаги получили статус пищевых добавок. Они также были разрешены к применению в качестве средства дезинфекции. Препараты фагов (в виде аэрозолей) были успешно испытаны в экспериментах по защите сельскохозяйственных птиц на крупных фермах, а также в рыбоводческих хозяйствах
В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии.
Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии.
Поэтому лечение заинтересованных больных проводится в режиме медицинского туризма. (Калифорния, США) направляет пациентов из разных стран, страдающих от хронических заболеваний, вызванных лекарственно устойчивыми бактериями, либо в Центр фаговой терапии в Тбилиси, либо в свою клинику в Мексике.