Возбудителем лейшманиоза являются паразитирующие простейшие рода Leishmania, который насчитывает более 20 видов. Установлено, что переносчиками паразитов Leishmania могут быть более 90 видов москитов. Существует 3 основные формы заболевания:
- Висцеральный лейшманиоз (ВЛ), также известный как кала-азар, который при отсутствии лечения в 95% случаев приводит к летальному исходу. Для него характерны нерегулярные приступы лихорадки, потеря веса, увеличение селезенки и печени и анемия. Большинство случаев происходит в Бразилии, Восточной Африке и Индии. По оценкам, в мире ежегодно происходит от 50 000 до 90 000 новых случаев ВЛ, однако ВОЗ получает уведомления лишь о 25-45% из них. Эта форма лейшманиоза остается одной из паразитарных инфекций с наиболее высоким эпидемическим потенциалом и смертностью. В 2018 г. более 95% новых случаев болезни, о которых была извещена ВОЗ, были зарегистрированы в 10 странах: Бразилии, Китае, Эфиопии, Индии, Ираке, Кении, Непале, Сомали, Южном Судане и Судане.
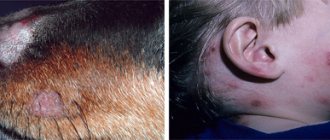
- Кожный лейшманиоз (КЛ) является наиболее распространенной формой лейшманиоза и сопровождается поражениями кожного покрова, главным образом язвами, на открытых участках тела. Поражения кожи могут оставлять перманентные шрамы и приводить к инвалидности или стигматизации. Около 95% случаев КЛ отмечаются в странах Америки, Средиземноморского бассейна, Ближнего Востока и Центральной Азии. В 2021 г. более 85% новых случаев КЛ были зарегистрированы в 10 странах: Афганистане, Алжире, Боливии, Бразилии, Колумбии, Иране (Исламской Республике), Ираке, Пакистане, и Сирийской Арабской Республике и Тунисе. По оценкам, в мире ежегодно имеет место от 600 000 до 1 миллиона новых случаев заболевания.
- Слизисто-кожный лейшманиоз приводит к частичному или полному разрушению слизистых оболочек носа, рта и гортани. Более 90% случаев слизисто-кожного лейшманиоза отмечаются в Боливии (Многонациональное Государство), Бразилии, Эфиопии и Перу.
Механизм передачи
Паразиты Leishmania передаются при укусах инфицированных самок москитов, которые питаются кровью для откладывания яиц. Эпидемиологические характеристики лейшманиоза могут быть разными в зависимости от вида паразитов и москитов, особенностей экологиии районов, где происходит передача инфекции, наличия у популяции контактов с возбудителем в данный момент или в прошлом, а также поведенческих факторов. Установлено, что естественными резервуарами паразитов Leishmania являются около 70 видов животных, в том числе человек.
Особенности эпидемиологии заболевания в различных регионах ВОЗ
Африканский регион
Висцеральная, кожная и слизисто-кожная формы лейшманиоза являются высокоэндемическими в Алжире и странах Восточной Африки. В Восточной Африке вспышки висцерального лейшманиоза – частое явление.
Регион стран Америки
Эпидемиология кожного лейшманиоза в странах Америки отличается высокой сложностью и большой неоднородностью в том, что касается циклов передачи, резервуаров, видов москитов-переносчиков, клинических проявлений и ответной реакции на лечение; кроме того, в одном и том же географическом районе могут циркулировать разные виды Leishmania. В 2021 г. более 97% случаев ВЛ в этом регионе было зарегистрировано в Бразилии.
Регион Восточного Средиземноморья
На этот регион приходится 70% всех случаев кожного лейшманиоза в мире. Висцеральный лейшманиоз является высокоэндемическим в Ираке, Сомали и Судане.
Европейский регион
Этот регион эндемичен по кожному и висцеральному лейшманиозу. В 2018 г. в регионе было зарегистрировано более 200 случаев, завезенных главным образом из Африки и региона стран Америки.
Регион Юго-Восточной Азии
Наиболее распространенной формой болезни в этом регионе является висцеральный лейшманиоз, но регион также эндемичен по кожному лейшманиозу. Это единственный регион, в котором реализуется региональная инициатива по ликвидации висцерального лейшманиоза как проблемы общественного здравоохранения к 2021 г. В 2021 г. в регионе было отмечено менее 5000 случаев заболевания, что стало беспрецедентно низким показателем. Регион уверено движется к достижению поставленной цели, и страны региона намерены получить от ВОЗ подтверждение элиминации заболевания к 2023 г.
Немного статистики
Каждый год лейшманиозом заболевают более 11-12 млн. человек в мире. Из них около 1,5 млн. человек болеют впервые в жизни. Практика международного туризма и постоянные военные действия в ряде стран обусловили периодические вспышки инфекции в последние годы.
К группе риска по лейшманиозу относят:
- ВИЧ-инфицированных;
- больных СПИДом;
- туристов, отдыхающих в эпидемиологически опасных регионах;
- «неблагополучных» граждан;
- коренных жителей развивающихся государств.
Официально утверждённой вакцинации против болезни пока нет.
Пост-кала-азарный кожный лейшманиоз (ПККЛ)
Пост-кала-азарный кожный лейшманиоз (ПККЛ), как правило, является последствием висцерального лейшманиоза и проявляется в виде макулезной, папулезной или узелковой сыпи, чаще всего на лице, плечах, туловище и других частях тела. Эта клиническая форма заболевания характерна в основном для стран Восточной Африки и индийского субконтинента, где она регистрируется у 5‑10% пациентов с висцеральным (кала-азарным) лейшманиозом. Обычно кожные высыпания появляются в промежутке от 6 месяцев до одного или более лет после исчезновения признаков перенесенного висцерального лейшманиоза, однако это может произойти и раньше. Люди с ПККЛ считаются потенциальным источником инфекции.
Использованная литература
- Потекаев, Н.С. Зоонозный кожный лейшманиоз: исторический экскурс и клиническое наблюдение. Клин. дерматология и венерология, — 2015. — № 5. — С. 41-50.
- Понировский, Е.Н. Лейшманиозы: особенности эпидемиологии, клиника, диагностика, лечение, профилактика. Качество жизни, 2005. — № 1(8). — С. 58-56.
- Тумольская, Н.И., Завойкин, В.Д., Мазманян, М.В. и др. Туризм, завозные паразитозы и их профилактика. Мед. паразитол., 2012. — № 4. — С. 3-7.
- Control of the leishmaniases. World Health Organ. Tech.Rep. Ser., 2010. — Vol. 949. — Р. 202.
- Handler, Z. Cutaneous and mucocutaneous leishmaniasis: Differential diagnosis, diagnosis, histopathology, and management. J. Am. Acad. Dermatol., 2015. — Vol. 73(6). — Р.911-926.
- Bari, A., Rahman, B. Many faces of cutaneous leishmaniasis. Indian J. Dermatol. Venereol. Leprol., — 2008. — Vol. 74(1). — P. 23-27.
Основные факторы риска
Социально-экономические условия
Нищета является фактором риска заболевания лейшманиозом. Плохие жилищные условия и антисанитарная обстановка (например, отсутствие системы утилизации отходов, открытая канализация) могут способствовать увеличению числа мест, благоприятных для размножения и жизни москитов, а также их близости к человеку. Москитов привлекают скученные жилищные условия, благоприятные для питания кровью людей. Поведенческие факторы, такие как сон на открытом воздухе или на земле, также могуть быть связаны с повышенным риском заражения.
Неполноценное питание
Белково-энергетическая недостаточность и дефицит железа, витамина А и цинка в рационе повышают риск развития клинической формы заболевания в случае инфекции.
Перемещение населения
Эпидемии двух наиболее распространенных форм лейшманиоза часто связаны с миграцией и перемещением не имеющих иммунитета людей на территорию районов, где циркулирует инфекция. Важными факторами заболеваемости остаются профессиональная деятельность и масштабное сведение лесов.
Экологические изменения
Факторами заболеваемости лейшманиозом могут быть урбанизация и повышение интенсивности хозяйственной деятельности в лесных районах.
Изменение климата
Эпидемиология лейшманиоза зависит от ряда климатических факторов:
- изменение температурного режима, режима осадков и влажности могут оказывать значительное влияние на ареал распространения, выживаемость и размеры популяций переносчиков и резервуаров инфекции;
- небольшие колебания температуры могут оказывать глубокое воздействие на цикл развития промастигот лейшманий в организме москитов, что может создавать условия для передачи простейших в районах, ранее не являвшихся эндемичными по этой болезни;
- засуха, голод и наводнения могут провоцировать массовое перемещение и миграцию населения в районы циркуляции лейшманиоза, а плохое питание может негативно сказываться на иммунитете.
Диагностика и лечение
Диагностика висцерального лейшманиоза выполняется на основе клинической картины в сочетании с паразитологическими или серологическимм исследованиями (например, экспресс-тестированием). Для диагностики кожного и слизисто-кожного лейшманиоза серологические исследования не представляют большого интереса; в этих случаях диагноз ставится на основе клинической картины и результатов паразитологического исследования.
Выбор лечения при лейшманиозе зависит от ряда факторов, таких как клиническая форма, наличие сопутствующих патологий, вид паразита и географический район. Лейшманиоз поддается лечению и может излечиваться полностью, однако эффективность лекарственных препаратов зависит от состояния иммунной системы пациента, и при ослабленном иммунитете не исключены рецидивы. Всем пациентам с висцеральным лейшманиозом показано безотлагательное назначение полного курса лечения. Детальная информация о лечении разных форм лейшманиоза в зависимости от географического района приведена в серии технических докладов ВОЗ №949, посвященной борьбе с лейшманиозом.
Разновидности лейшманиоза
Классифицировать простейших непросто, поэтому ни один вид классификации не является официальным. Обычно применяют два самых простых способа классификации: согласно клинической форме и географическому ареалу.
Различают три клинических вида инфекции:
- кожную. Она может локализоваться в определённых местах на коже, а также выглядеть рассеянно либо диффузно. Часто инфекция имеет рецидивирующий характер, с тяжёлыми дермальными проявлениями на слизистых оболочках;
- висцеральную;
- висцеотропную.
На основании географического положения выделяют два вида лейшманиоза: обнаруженный в Старом Свете (паразит обитает в африканских, азиатских, ближневосточных, средиземноморских странах, а также в Индии) и найденный в Новом Свете. Это Южная и Центральная Америка. Для возбудителя более характерными являются кожная, висцеральная и кожно-слизистая формы проявления.
Бесплатная консультация по вопросам обучения
Наши консультанты всегда готовы рассказать о всех деталях!
Профилактика и контроль
Профилактика и контроль лейшманиоза требуют комбинированного подхода, поскольку передача инфекции происходит в рамках сложной биологической системы, в которой участвуют человек или животное-резервуар (хозяева), паразит и его переносчик (москит). К основным мерам профилактики лейшманиоза относятся:
- Ранняя диагностика и быстрое начало эффективного лечения способствуют уменьшению распространенности болезни и предотвращают инвалидность и смерть пациентов. Это дает возможность снизить интенсивность передачи инфекции и вести мониторинг распространения и бремени болезни. В настоящее время существуют высокоэффективные и безопасные препараты для лечения лейшманиоза, особенно его висцеральной формы, хотя их применение может быть сопряжено с трудностями. Благодаря усилиям ВОЗ по согласованию цен и программе бесплатного обеспечения препаратами при посредничестве ВОЗ доступ к лекарственным средствам был значительным образом расширен.
- Борьба с переносчиками способствует снижению заболеваемости или прерыванию передачи инфекции путем сокращения численности популяций москитов. Для борьбы с переносчиками применяются распыление инсектицидов, обработанные инсектицидом сетки, меры инженерно-экологического обустройства и средства индивидуальной защиты.
- Эффективный эпиднадзор имеет большое значение, поскольку позволяет вести оперативный мониторинг обстановки и принимать меры во время эпидемий и в ситуациях, когда среди пациентов, находящихся на лечении, отмечаются высокие коэффициенты летальности.
- Контроль численности популяций животных-резервуаров инфекции требует сложного комплекса мероприятий и поэтому должен выполняться с учетом местных условий.
- Социальная мобилизация и укрепление партнерств: мобилизация и санитарное просвещение местного населения и проведение эффективных мероприятий, направленных на изменение поведения, всегда должны осуществляться с учетом местной специфики. Решающее значение имеют работа в партнерстве и сотрудничество с различными заинтересованными сторонами и программами по борьбе с другими трансмиссивными болезнями.
Деятельность ВОЗ
Работа ВОЗ по вопросам борьбы с лейшманиозом ведется по следующим направлениям:
- техническое и финансовое содействие национальным программам по борьбе с лейшманиозом в интересах обновления методических документов и составления планов борьбы с заболеванием, охватывающих создание устойчивых и эффективных систем эпиднадзора и систем обеспечения готовности к эпидемиям и реагирования на них;
- мониторинг эпидемиологических показателей и оценка эффективности мероприятий по борьбе с заболеванием, что способствует повышению осведомленности и ведению информационно-разъяснительной работы по вопросу о глобальном бремени лейшманиоза, а также обеспечению равноправного доступа к медицинской помощи;
- разработка научно обоснованных стратегий и стандартов в области профилактики лейшманиоза и борьбы с ним, а также мониторинг их осуществления;
- укрепление сотрудничества и координации среди партнеров и заинтересованных сторон;
- содействие научным исследованиям и использованию эффективных средств борьбы с лейшманиозом, в том числе безопасных, эффективных и доступных по стоимости лекарств, диагностических средств и вакцин;
- оказание поддержки национальным программам по борьбе с заболеванием в интересах обеспечения доступа пациентов к лекарственным препаратам гарантированного качества.
Кожный лейшманиоз (leishmaniosis cutanea
, син.: язва пендинская, Боровского болезнь) — трансмиссивное протозойное заболевание, вызванное лейшманиями (
Leishmania tropica
), эндемичное для районов тропического и субтропического климата, развивающееся после укусов человека москитами, инфицированными лейшманиями, характеризующееся поражениями кожи с образованием бугорков, узлов, их изъязвлением и рубцеванием.
Лейшманиоз является эндемическим заболеванием в 98 странах мира, и риску заражения подвергаются предположительно 350 млн человек. По оценкам ВОЗ, в мире в настоящее время инфицированы 14 млн человек, и ежегодно возникает около 2 млн новых случаев заболевания [1].
Лейшманиоз распространен преимущественно в тропических и субтропических странах. Наиболее активные очаги лейшманиоза расположены в Северной и Центральной Африке (Марокко, Алжир, Тунис, Ливия, Египет, Эфиопия, Судан и др.) и в Азии (Сирия, Ирак, Израиль, Иордания, Турция, Иран, Саудовская Аравия, Пакистан, Индия и Афганистан) [2].
В Европе небольшое количество больных регистрируют в Греции, Италии, Испании, Португалии и на юге Франции. Особая форма лейшманиоза, близкая по клинической картине к кожному лейшманиозу Старого Света, встречается во многих странах Латинской Америки. Зоонозный кожный лейшманиоз распространен в Туркмении и Узбекистане [2]. Антропонозный кожный лейшманиоз за последние 10 лет в указанных регионах регистрировали очень редко [2]. Принято считать, что в России лейшманиоз (за исключением отдельных, так называемых завозных случаев) практически не встречается1.
Исторический экскурс
Лейшманиоз известен с глубокой древности. Первые описания внешних проявлений, сходных с кожным лейшманиозом, найдены на глиняных табличках Ашурбанипала, датируемых VII веком до н.э. Существуют и более ранние тексты возрастом 1500—2500 лет до н.э.
Кожный лейшманиоз отображен в керамических фигурках перуанских инков (2000 лет до н.э.), под различными названиями упоминается в памятниках письменности многих народов, например, за 1500 лет до н.э. в «Papyrus Ebers» (G. Ebers, 1874), в Пятикнижии (казни бога Яхве на головы египтян, противодействовавших исходу евреев из Египта), «гидра острова Лемне» в «Илиаде» Homeros (около 460—377 до н.э.), «azar» Александра Македонского в «Шах-наме» Фирдоуси (994 г.). У древних евреев практиковались прививки «язвы» девочкам на кожу ног, чтобы избежать поражения лица. Впервые кожный лейшманиоз описан английским врачом Pococke (1745) во время путешествия по Малой Азии как «bouton d’Aleppe». Клиническая картина болезни («восточной язвы») подробно освящена в трудах братьев Russel (1756), русских военных врачей — в диссертации «о солеке» Н.А. Арендта в Тегеране (1862, монографии «Пендинская язва» Л.Л. Гейденрейха (1888) и многих других исследователей [3].
Персидские врачи, в том числе Авиценна, в Х веке н.э. давали подробные описания так называемой болезни Балха. Индийские врачи называли эту болезнь кала-азар (kala azar на языках Урду, Хинди и Хиндустани означает «черная лихорадка»; kala — «черный», azar — «болезнь, лихорадка»). На Американском континенте наиболее ранние свидетельства кожного лейшманиоза, датируемые I веком н.э., найдены в Эквадоре и Перу в виде изображений обезображенных лиц и других кожных проявлений на керамических изделиях того времени. Существуют записи XV—XVI вв.еков, созданные во времена цивилизации Инков и Испанской колонизации, в которых упоминается «болезнь долин», «Андская болезнь», «белая проказа», сходные с картиной кожного лейшманиоза.
Знакомство российских врачей с данной патологией началось еще во времена завоевания Кавказа, а также в период установления дипломатических отношений России с Ираном. Первая отечественная работа по кожному лейшманиозу принадлежит Арендту, врачу русской миссии в Тегеране (1862). В 1864 г. была опубликована статья Скорова о так называемом «елизавет-польском годовике». Русские врачи были осведомлены о своеобразном кожном заболевании, встречающемся в Средней Азии; однако действительное их знакомство с этой болезнью произошло уже после взятия генералом Черняевым Ташкента (1865) и занятия Кокандского ханства [4].
В настоящее время не существует единого мнения о том, кто же открыл микроорганизм-возбудитель кожного лейшманиоза.
В 1900 г. английский врач W. Leishman в Лондоне в препарате селезенки солдата, погибшего от «dum-dum fever» спустя 7 мес после возвращения из Индии (из Dum Dum в окрестностях Калькутты, где производились английские пули «dum-dum»), обнаружил трипаносомных паразитов. В 1903 г. C. Donovan в Мадрасе (Индия) обнаружил таких же паразитов в селезенке, а в 1905 г. — и в крови больных с неправильной лихорадкой, спленомегалией и анемией (Piroplasma
Donovani
, по A. Laveran и F. Mensil, 1903) [3].
Возможно, первым его идентифицировал майор Британской Индийской армии хирург Кеннингхем, не связавший его при этом с данным заболеванием. Однако доподлинно известно, что еще в 90-е гг. XIX века российский военный хирург Петр Фокиевич Боровский, работавший в Ташкенте, проводил исследование этиологии местного заболевания, известного как «сартовская болезнь». В 1898 г. он опубликовал первое подробное описание паразита и поражаемых им тканей и отнес его к простейшим. Но поскольку работа была опубликована на русском языке и издана малым тиражом, Боровский при жизни не получил международного признания своих трудов. Только Рональд Росс предположил, что эти тельца — не что иное, как внутриклеточная стадия развития неизвестного раннее паразита, которого он назвал Leishmania donovani
. Ее связь с болезнью кала-азар первым предположил сам Чарльз Донован, но окончательно наличие
Leishmania donovani
у больных черной лихорадкой было подтверждено Чарльзом Бентли.
Уже к началу второй половины XIX века возникла мысль о паразитарной природе данного заболевания. Первые сообщения о паразитарной природе язв были малодоказательны. Как на курьез можно указать на работы Смита (Smith, 1868) и Флеминга (Fleming, 1873), открывших на срезах «делийской язвы» яйца двуусток. Впервые в печати предположение о бактериальной природе язв было высказано Лавераном (Laveran) в 1880 г. на основании того, что язвы чаще появлялись на месте нарушения целости кожного покрова. Дюкло и Гейденрейх (Duclaux и Heidenreich, 1885) выделили микрококка из крови больного и склонны были считать именно его возбудителем. Этот микрококк был назван ими Micrococcus
biskra
, так как больной заболел в Бискре. Аналогичные наблюдения были сделаны Шантемессом (Chantemesse) у больного «нильской язвой» [4].
Многие зарубежные исследователи [4] до сих пор считают, что первым (как уже упоминалось выше) обнаружил и описал возбудителя кожного лейшманиоза англичанин Кеннингхем (Cunningham), опубликовавший свою работу в 1885 г. Однако в данной работе обнаруженные микроорганизмы не связывались непосредственно с заболеванием, а принимались как контаминаты.
В 1894 г. П.Ф. Боровский начал свою работу по «сартовской язве», как ее тогда называли, результаты исследований опубликовал только в 1898 г. сначала в виде доклада на съезде хирургов в Киеве. В том же году на заседании Русского хирургического общества Пирогова (протокол № 162) он сделал доклад «К этиологии сартовской (восточной) язвы», сопровождавшийся демонстрацией микроскопических препаратов. Он избрал иной путь исследования: «…Мы же следовали в этом случае плану Рапчевского и брали для исследования случаи сартовской язвы без всяких воспалительных явлений». При первых же поисках П.Ф. Боровский обнаружил самую разнообразную воздушную микрофлору, попадавшую в его посевы, но оценил эти находки как случайные. Мазки из сока папул на стеклах, фиксированные на пламени «…дали отрицательный результат в смысле присутствия микробов». После этого Боровский приступил к исследованию сока папул, разведенного бульоном или физиологическим раствором в висячей капле, и был поражен «…присутствием множества телец круглой и неправильной формы». Боровский подробно описал найденные тельца. Величина телец в свежем состоянии колеблется от 1,5 до 3 µ, редко достигая 4 µ. «…В срезах из уплотненной ткани они меньше 1−2 µ, но больше 1—1,5µ». Наибольшее количество телец в свежих папулах, по мере старения язвы число их уменьшается, в застарелых же язвах Боровский находил эти тельца только в единичных случаях. Описание возбудителя, окрашенного раствором Леффлера, отличается большей достоверностью и содержит все основные морфологические элементы, свойственные ему. Боровский описал их следующим образом: «…Окрашенные чужеядные представляются большей частью в виде круглых телец с резко окрашенным ядром непостоянной формы — то круглой, то продолговатой, то серповидной, — и слабо окрашенной протоплазмой; ядро большей частью расположено на периферии, так что многие тельца имеют перстневидную форму; чужеядные, расположенные в клетке, оттесняют ядро клетки к периферии и сами иногда окружаются как бы сумкой; в последнем случае получается киста, наполненная чужеядными; такие кисты наблюдались и вне клеток». Также были приведены детали строения паразита: «Наблюдаются чужеядные, от ядра которых идет тонкий отросток к противоположному краю, и на этом отростке небольшое утолщение». Боровский описал начало деления паразита с деления ядра: «…Затем (наблюдались) такие тельца, где ядра помещаются на противоположных концах, так что является предположение о предварительном делении ядра клетки, а затем уж и самой клетки — чужеядного». В заключение доклада Боровский делает основной вывод: «…На основании строения чужеядных, а также на основании их свойств передвигаться и менять форму, мы склонны отнести их к Protozoa
», впервые высказывая тем самым мысль о протозойной природе возбудителя кожного лейшманиоза [4].
Основная работа Боровского «О сартовской язве», как указывалось выше, появилась в 1898 г. в Военно-медицинском журнале. Общая конструкция статьи была та же, что и доклада [4].
Боровский дал точное описание внешнего вида паразита, обнаружил в нем ядро, причем определенно указал на него именно как на ядро Protozoa
, отметил значение этого ядра в процессе деления паразита, описал вакуоль; в его работе имелось явное указание на наличие кинетопласта. Автор показал, что возбудитель восточной язвы — внутриклеточный паразит; описал шаровидные обрывки протоплазмы с лежащими в них лейшманиями, доказал, что паразит исчезает из старых язв и сменяется обычной раневой микрофлорой по мере приближения к выздоровлению, и выявил закономерности распределения лейшманий в инфильтрате. Наконец, Боровский первый опубликовал правильное изображение возбудителя. Таким образом, учение о кожном лейшманиозе было впервые поставлено на истинно научную почву [4].
В 1903 г. ординатор Московской клиники кожных болезней С.Л. Богров и микробиолог Е.И. Марциновский независимо от П.Ф. Боровского описали возбудителя кожного лейшманиоза. Авторы обнаружили у больного с «персидской язвой» овальных микроорганизмов, которым дали наименование «Ovoplasma
orientale
» и доказали, что эти микроорганизмы относятся к типу простейших
Protozoa
(«К вопросу об этиологии восточной язвы», 1904) [5]. Таким образом, исследование Е.И. Марциновского и С.Л. Богрова убедительно подтвердило открытие П.Ф. Боровского в 1898 г. [5, 6].
В 1907 г. Ch. Nicolle и Cassuto в Тунисе у 2-летнего ребенка выделили L.
infantum
. В том же году Е.И. Марциновский защитил диссертацию, посвященную этиологии и клинике лейшманиоза [3].
Значимой вехой в развитии учения о лейшманиозе стала работа Г.И. Мещерского [7] «К клинике кожного лейшманиоза», вышедшая в свет ровно столетие назад — в 1915 г. В статье с исчерпывающей полнотой дано описание клинической картины кожного лейшманиоза и впервые отмечен ряд типичных для этого заболевания проявлений: развитие бугорка в качестве первичного элемента, затем образование язвы, наличие узелковых лимфангоитов (по современной терминологии — лимфангитов, Н.С. Потекаев), имеющих «холодное» течение, выраженную наклонность к «произвольному обратному развитию» и другие признаки [8].
В том же номере «Русского журнала кожных и венерических болезней» проблеме кожного лейшманиоза посвящена еще одна работа за авторством С.Л. Богрова «К анатомии восточной язвы и сопутствующих ей узловатых лимфангоитов» (1915). Автор доказал, что узловатые лимфангоиты представляют собой не случайное осложнение восточной язвы, как это считалось ранее, а являются специфическим компонентом этого заболевания [8]. Этим самым была разрешена давняя дискуссия дерматологов о природе узловатых лимфангитов при кожном лейшманиозе.
Большое значение в изучении лейшманиозов имели также работы В.Л. Якимова (1913), Н.И. Ходукина и М.С. Софиева (1929) [3].
Систематика
Выделяют два основных клинико-эпидемиологических варианта кожного лейшманиоза: антропонозный (городской, поздно-изъязвляющийся, лейшманиоз кожный сухой) и зоонозный (сельский, остронекротизирующийся, лейшманиоз кожный влажный) типы, возбудителей которых рассматривают как самостоятельные виды. Среди местного населения болеют главным образом дети, среди приезжих — люди любого возраста. В МКБ-10 в разделе «Протозойные болезни» под кодом B.55 выделяют лейшманиоз кожный, кожно-слизистый, висцеральный, неуточненный.
Возбудители относятся к типу Sarcomastigophora
, подтипу
Mastigophora
, классу
Zoomastigophorea
, отряду
Kinetoplastida
, подотряду
Trypanosomatina
, семейству
Trypanosomatidae
, роду
Leishmania
2. Лейшмании переносятся москитами3 (
Phlebotomus, Lutzomyia, Psychodopygus
и др.). Сезон заражения связан с летним периодом.
В организме человека и других позвоночных лейшмании имеют внутриклеточную неподвижную лейшманиальную стадию амастиготы, а в кишечнике переносчика (флеботомуса) и на искусственных средах (при 25 °С) — жгутиковую подвижную лептомонадную стадию (промастигот) [2].
В связи с этим для осуществления трансмиссивного пути необходимым условием является стабильно высокая температура окружающей среды (24—27 °С) на протяжении 3—4 нед [9].
Источником возбудителей антропонозного кожного лейшманиоза является больной человек, зоонозного — мелкие млекопитающие (песчанки).
На месте внедрения возбудителя развивается гранулема — лейшманиома, которая проходит стадию инкубации, пролиферации (бугорок), деструкции (язва) и репарации (рубцевание). В результате суперинфекции могут возникнуть несколько лейшманиом последовательно или одновременно (при множественных укусах). По ходу лимфатических путей от первичного очага до регионарного лимфатического узла появляются бугорки обсеменения. Заболевание может приобрести хроническое рецидивирующее течение в виде мелких рецидивирующих бугорков в области рубца (туберкулоидный лейшманиоз).
Иммунитет к кожному лейшманиозу у человека стойкий и возникает только в результате естественного или искусственного (после прививки) заболевания. Дети, родившиеся от иммунных родителей, остаются восприимчивыми к процессу. Среди постоянного населения эндемичных по лейшманиозу очагов заболевание поражает преимущественно детей раннего возраста, вследствие этого невосприимчивость приобретается в первые годы жизни. Поэтому среди взрослого постоянного населения этих регионов кожный лейшманиоз встречается относительно редко. Иммунологические сдвиги при кожном лейшманиозе проявляются не только в возникновении стойкого иммунитета, но и в развитии готовности к аллергической реакции на введение специфического антигена [10]. При этом оба типа кожного лейшманиоза отличает стойкость и единство иммунных реакций, что обусловливает высокую профилактическую эффективность культуральных лейшманийных прививок (Н.Ф. Родякин, 1957, 1982) [10].
Лейшманиоз кожный антропонозный
имеет инкубационный период 2—8 мес. Первичная лейшманиома в виде гладкого медленно растущего буровато-красного бугорка через 6 мес достигает 1—2 см в диаметре, затем его поверхность начинает шелушиться и через 5—10 мес изъязвляется. Вокруг язвы могут появиться бугорки обсеменения. Через 1 год (иногда более) инфильтрат уменьшается, а язва рубцуется [9].
Лейшманиоз кожный зоонозный
отличается более коротким инкубационным периодом (обычно 1—4 нед, но не более 2 мес), быстрым ростом и превращением бугорка в элемент типа фурункула с мощным воспалительным инфильтратом, нечеткими границами, отеком. Центральная часть элемента быстро подвергается некрозу с образованием кратерообразной язвы с гнойным отделяемым. Процесс сопровождается болезненностью, развитием отеков стоп, голеней. Через 3—6 мес процесс заканчивается рубцеванием [9]. Часто возникают лимфангиты (определяются в виде узловатых безболезненных тяжей), лимфадениты, которые могут изъязвляться и рубцеваться [3]. Сельский тип лейшманиоза отличает частое возникновение добавочных бугорков вокруг лейшманиом в результате диссеминации возбудителя [11].
Туберкулоидная форма, описанная И.И. Гительзоном (1932) и названная вначале металейшманиозом, развивается через несколько месяцев, а иногда и лет вокруг рубца от бывших лейшманиом, и характеризуется мелкими плотными бугорками желтовато-бурого цвета, клинически сходными с проявлениями плоской туберкулезной волчанки и дающими при диаскопии симптом «яблочного желе». Бугорки располагаются в виде колец, дуг, иногда на поверхности самого рубца, и не склонны к изъязвлению. Процесс имеет тенденцию к длительному течению (многие годы) и медленному периферическому росту [11]. Описаны также лепроматоидная и промежуточная формы лейшманиоза. Диффузно-инфильтрирующая лейшманиома практически не встречается. Ассоциация микробной флоры осложняет течение лейшманиоза и задерживает выздоровление [3].
Различают географические типы болезни — лейшманиозы Нового и Старого Света. Принципиальных различий в патогенезе и клинической картине кожных поражений нет. Однако при первом язвы обычно более глубокие (вплоть до гиподермы), сопровождаются иногда лимфангитом и лимфаденитом. Важнейшей особенностью кожного лейшманиоза Нового Света является нередкое вовлечение в патологический процесс слизистых оболочек. Как правило, слизистые оболочки поражаются через 1—2 года после развития язв на коже. Язвенно-некротические изменения на слизистых оболочках приводят к глубокой деформации носа, ушей, носовой части глотки, дыхательных путей, половых органов, уродующих и инвалидизирующих больных [3].
Известно несколько форм кожного лейшманиоза Нового Света: мексиканский кожный лейшманиоз
(возбудитель
L.mexicana
) с доброкачественным, но затяжным течением и редким поражением слизистых оболочек;
перуанский кожный лейшманиоз
(«ута», возбудитель
L.peruviana
), который встречается главным образом у детей в сухих и горных районах (северные склоны Анд в Перу и Аргентине, в Боливии);
венесуэльский кожный лейшманиоз
(возбудитель
L.garnhami
), встречающийся в высокогорных районах (800–1800 м над уровнем моря) западной части Венесуэлы как в сельской местности, так и в городах;
гвианский кожный лейшманиоз
(возбудитель
L.guyanensis
), при котором резервуаром возбудителя служат щетинистые крысы, обитающие в лесах северных районов Южной Америки (Гайана, Панама, Суринам);
панамский кожный лейшманиоз
(возбудитель
L.panamensis
) — одна из наиболее тяжелых и распространенных форм кожного лейшманиоза Нового Света, которая регистрируется в большинстве стран Центральной Америки [3].
Диагностика заболевания включает анализ анамнестических, эпидемиологических, клинических данных, результаты лабораторных исследований: микроскопию (обнаружение амастигот в содержимом края язв, мазках-отпечатках, аспирационной жидкости из инфильтрата путем окраски по Романовскому—Гимзе, Райту), гистологическую, культуральную и паразитологическую диагностику, молекулярно-биологические методы (ПЦР), иммунохроматографический экспресс тест rK39, биологический тест.
При зоонозном лейшманиозе в язвах обнаруживают мало лейшманий, поэтому поиски возбудителя в содержимом язв, соскобах и биоптатах кожи должны быть более настойчивыми [3].
Наряду с классической клинической картиной кожного лейшманиоза имеются описания не совсем типичных клинических проявлений заболевания. Особое место занимают хронические формы, протекающие по типу грануляционного воспаления. В статье «Лимфоцитомаподобный лейшманиоз кожи» (Н.С. Потекаев, Ю.В. Постнов, Н.Н. Потекаев, Ю.П. Грибунов, А.Н. Львов, 2009 г.) приводится описание наблюдения хронического лейшманиоза кожи у женщины 40 лет (жительница Дагестана), протекающего по типу лимфоцитомы на протяжении более чем 15 лет [12]. Неоднократно (в том числе и за рубежом) ошибочно предполагались различные нозологии (эозинофильная гранулема, базалиома и др.), и лишь в 2006 г. диагноз лейшманиоза был выставлен сначала клинически одним из авторов настоящей статьи (Н.С. Потекаев), а затем подтвержден патогистологически (Ю.В. Постнов).
Работа «Эволюция клинических проявлений кожного лейшманиоза, приводящая к диагностическим ошибкам» (Д.Д. Агакишиев, А.Т. Гаджиева, В.Р. Гусейнова, 2005) содержит описание клинического наблюдения лейшманиозного процесса у девочки 12 лет, у которой после пребывания в эндемической зоне в Азербайджане появились высыпания на кончике носа. Ребенок получал лечение с диагнозом пиодермии, а затем по поводу папилломы кожи, но без эффекта. После проведения патоморфологического анализа с очага поражения была констатирована инфильтративная форма кожного лейшманиоза. Описанный случай свидетельствует о том, что, несмотря на ликвидацию эндемических очагов кожного лейшманиоза, встречаются спорадические случаи заболевания [13]. С точки зрения дифференциальной диагностики интересна статья «Лейшманиоз — сюрприз с Востока» в журнале «Здоровье ребенка» (И.В. Богадельников, Ю.В. Вяльцева, И.З. Каримов, А.А. Дегтярева, 2012). В статье представлен клинический случай лейшманиоза кожной формы у ребенка 4 лет, приехавшего в Крым из эндемичного по лейшманиозу района — Республики Узбекистан. Девочку неоднократно осматривали педиатры, хирурги, инфекционисты, дерматологи, ошибочно предполагая наличие контагиозного моллюска. Диагноз был подтвержден путем взятия мазка с язвы и обнаружения телец Боровского [14]. В 2003 г. М.И. Курдиной описан случай бугоркового лейшманиоза у пациентки 16 лет, жительницы Подмосковья, заразившейся лейшманиозом городского типа во время отдыха на Кипре. Была диагностирована редкая бугорковая форма лейшманиоза — туберкулоид, при этом лейшмании микроскопически в соскобах с очагов поражения не были обнаружены. Диагноз был подтвержден гистологически проф. Ю.В. Постновым [15].
Дифференциальный диагноз
проводят с бугорковым сифилидом, туберкулезной волчанкой, хронической язвенной пиодермией, фурункулом (карбункул), мелкоузелковым саркоидозом, красной волчанкой, туберкулоидным типом лепры, глубокими микозами, различными новообразованиями кожи.
От бугоркового сифилида проявления лейшманиоза кожи отличаются локализацией сыпи главным образом на открытых участках тела, меньшей плотностью бугорков, расположением элементов на рубце, положительным феноменом «яблочного желе», более поздним изъязвлением, характером рубцов (при сифилисе рубец мозаичный, при лейшманиозе — втянутый), отрицательными серологическими реакциями на сифилис [16].
От туберкулезной волчанки проявления отличаются тем, что процесс может возникнуть в любом возрасте, а не преимущественно в детском. Бугорковые элементы значительно плотнее, в связи с чем феномен проваливания зонда отрицательный. Значение имеет и характер рубца: при туберкулезной волчанке рубец поверхностный, при лейшманиозе — глубокий втянутый [16]. Однако «свежие» бугорковые элементы могут располагаться на рубце при обоих процессах.
От хронической язвенной пиодермии кожный лейшманиоз отличается также локализацией высыпаний, множественностью, быстрым развитием лимфангита и лимфаденита, характером течения кожного процесса (лейшманиоз протекает в среднем до года, рецидивы заболевания бывают редко, в то время как пиодермия протекает длительно, торпидно, с волнами обострений процесса). От фурункула лейшманиома отличается как локализацией (фурункул присутствует только в тех зонах кожи, где есть волосяные фолликулы), так и отсутствием гнойно-некротического стержня.
От высыпаний при мелкоузелковом саркоидозе лейшманиомы отличаются склонностью к изъязвлению (при саркоидозе это встречается очень редко), образованием регионарных лимфаденитов, диаскопической картиной (феномен «запыленности» при саркоидозе).
От туберкулоидного типа лепры лейшманиоз отличается отсутствием склонности лейшманиом группироваться в фигурные элементы (в противоположность бугоркам при лепре), характером течения процесса (спустя 4—6 мес лейшманиомы изъязвляются, а в среднем через 1 год процесс заканчивается рубцеванием, течение же лепры многолетнее), отсутствием расстройств чувствительности и полиневритов.
Лечение
Тактика терапии зависит от формы и стадии заболевания, общего состояния пациента, вида возбудителя. Назначают рифампицин 600 мг в сутки в течение 6 мес, иногда до 1 года. Возможен более короткий прием рифампицина по 600 мг/сут — от 3 нед до 3 мес (иногда дольше) в сочетании с дапсоном в дозе 2 мг на 1 кг массы тела в сутки в течение 3 нед. На фоне системной терапии обязательно проводят обкалывание очагов препаратами пятивалентной сурьмы (глюкантим, пентостам) по 0,3—0,8 мл (всего на курс 5—6 мл). Обкалывание возможно в сочетании с триамцинолоном; проводится каждые 2 дня. Процедура отличается болезненностью и требует определенного навыка. При проведении только лишь обкалывания очагов клинический эффект не всегда достаточный. Наружные лекарственные формы пятивалентной сурьмы (мази, пасты) при лечении туберкулоидного кожного лейшманиоза малоэффективны [17].
В отдельных случаях препараты сурьмы (пентостам, глюкантим) рекомендуют вводить внутримышечно или внутривенно. Расчет дозы действующего вещества для пентостама проводят следующим образом: 10—20 мг на 1 кг массы тела в сутки (максимально 850 мг/сут, или 8 мл препарата), продолжительность курса — 20 дней; или 20 мг/кг/сут продолжительностью 28 дней. Излечение достигается у 80—90% пациентов. Возможны побочные эффекты: тошнота, рвота, миалгии, расстройства кровообращения, в связи с чем системное лечение препаратами сурьмы проводится в условиях специализированного стационара. Эти эффекты являются дозозависимыми; при плохой переносимости препараты вводятся через день [17].
Имеются сообщения об эффективности кетоконазола в дозе 400 мг/сут в течение 3 мес, или 600 мг/сут на протяжении 28 дней. В последнее время используют итраконазол в дозе 200 мг/сут (4 мг на 1 кг массы тела в сутки) в течение 1—3 мес [17].
Другие препараты из апробируемых — аллопуринол, трихопол, делагил — значительно менее эффективны. Данные об их эффективности зачастую противоречивы и недостоверны. В качестве экспериментальных схем предлагается обкалывание очагов рекомбинантным интерфероном-γ [17].
Приводим результаты нашего наблюдения.
Пациентка З
., 53 лет, поступила в Филиал «Клиника им. В.Г. Короленко» Московского научно-практического центра дерматовенерологии и косметологии (МНПЦДК) 8 ноября 2013 г. с диагнозом направившего учреждения: «Микробная экзема». При поступлении: жалобы на множественные высыпания на кожном покрове, сопровождающиеся болезненностью. Из анамнеза стало известно, что пациентка считает себя больной с конца сентября 2013 г., когда отметила появление первых высыпаний на коже лица, болезненность в области правой руки, увеличение и болезненность лимфатических узлов. Высыпания появились во время пребывания пациентки в сельской местности Узбекистана (с 05.09.13). Врач экспедиции расценил их как проявление гнойничкового заболевания кожи. Получала лечение: доксициклин 100 мг 2 раза в сутки в течение 5 дней; гентамицин по 0,4 2 раза в сутки в течение 5 дней; наружно — мазь левомеколь, синтомициновую мазь, метрогил гель, без положительной динамики (появились новые высыпания на коже конечностей, отек кистей). С 31.10.13 г. развился отек тканей окологлазничной области слева. После возвращения в Москву с 05.11.13 развился отек кожи над левой голеностопной областью (рис. 1). Обратилась в поликлинику № 1 МВД России, была направлена на стационарное лечение в Филиал «Клиника им. В.Г. Короленко» МНПЦДК. Аллергический анамнез: на введение новокаина отмечается отек Квинке, на прием сульфаниламидов — розеолезная сыпь. Сопутствующие заболевания: гипертоническая болезнь I—II степени, риск II. Ожирение II степени. Хронический гастрит, ремиссия. Хронический панкреатит, ремиссия. Анемия, легкое течение. Варикозная болезнь нижних конечностей. Грыжа пищеводного отверстия. Ангиопатия сетчатки. Пресбиопия. OS — реактивный отек.
Рис. 1. Динамика кожного процесса.
Кожный статус на момент поступления: патологический кожный процесс носит островоспалительный распространенный характер, локализуется на лице (рис. 2, а), ушной раковине слева (см. рис. 2, б), кистях (см. рис. 2, в), в области передней поверхности правого коленного сустава (см. рис. 2, г), в области правой голени спереди и сзади (см. рис. 2, д), в области средней трети левой голени спереди (см. рис. 2, е). Представлен множественными округлыми и инфильтрированными очагами ярко-красного цвета размерами от 2 до 10 см в диаметре. В центре некоторых элементов имеются изъязвления, покрытые корочкой. В высыпаниях наблюдается гнойный компонент по типу фурункулов. При нажатии на бугорки появляется отделяемое желтоватого цвета. При пальпации очагов отмечается локальная болезненность. По ходу лимфатических сосудов определяются уплотнения в виде валиков (четки).
Рис. 2. Пациентка З., 53 лет. Высыпания в области лба (а), в области ушной раковины (б), в области левой кисти (в), в области передней поверхности правого коленного сустава (г), в области голеней (д), в области средней трети левой голени спереди (е).
Данные лабораторного обследования (19.11.13): в клиническом анализе крови СОЭ — 24 мм/ч; показатели клинического анализа мочи, коагулограммы в пределах нормы; в биохимическом анализе крови уровень общего белка составляет 64 г/л; данные ЭКГ, рентгенографии органов грудной клетки не показали патологических изменений; при УЗИ органов брюшной полости визуализированы признаки хронического холецистита, диффузных изменений поджелудочной железы; при анализе отделяемого из очагов высыпаний (18.11.13) обнаружены лейшмании. В препарате из содержимого язвы от 18.11.13 окрашенного по Романовскому при прямой микроскопии (Ув. 1000) в цитоплазме макрофагов, а также свободно лежащими обнаружены овальные тельца, цитоплазма которых окрашена в серовато-голубой цвет. Ядра оттеснены к периферии, окраска их несколько темнее. В цитоплазме хорошо виден кинетопласт — палочковидное образование, окрашенное более интенсивно, чем ядро (рис. 3). Заключение: обнаружены лейшмании, форма амастигот.
Рис. 3. Препарат фагоцитированных лейшманий (Ув. 1000). Окраска по Романовскому—Гимзе. 1 — фагоцит с включением лейшманий; 2 — лейшмании (тельца Боровского); 3 — кинетопласт.
На основании анамнестических данных, клинической картины, положительного анализа отделяемого из очагов высыпаний на лейшмании был выставлен диагноз: «Зоонозный тип кожного лейшманиоза».
28.11.13 пациентка была консультирована у специалиста-паразитолога КДЦ № 1 Первого МГМУ им. И.М. Сеченова проф. Н.И. Тумольской, которая подтвердила диагноз кожного лейшманиоза (форма L.
major
).
В стационаре было проведено лечение доступными антибактериальными препаратами (цефтриаксон по 1,0 2 раза в сутки внутримышечно; гентамицин по 0,8 2 раза в сутки внутримышечно; доксициклин по 100 мг 2 раза в сутки перорально), противогрибковыми препаратами (флуконазол по 50 мг/сут, орунгамин по 200 мг/сут); противопротозойными препаратами (метрогил по 100,0 внутривенно капельно); аминохинолиновыми препаратами (плаквенил по 200 мг 2 раза в сутки); другими классами препаратов (метилурацил по 500 мг 2 раза в сутки, эссенциале по 300 мг 3 раза в сутки, ксизал по 5 мг 1 раз в сутки, сорбифер по 100 мг 2 раза в сутки). Наружно были назначены чистый ихтиол, 3% борная кислота.
Паразитолог назначил следующее лечение: глюкантим из расчета 60 мг на 1 кг массы тела в сутки. Дозу разделить следующим образом: в 1-й день — 1 ампула внутримышечно, во 2-й день — 2 ампулы внутримышечно глубоко, на 3-й день — 3 ампулы внутримышечно, на 4-й день — полная доза 5 ампул (25 мл). Курс 10—15 дней (неполноценно эффективен при L. major
). Паромимицин по 0,5 3 раза в сутки в течение 10—15 дней (специфический препарат при
L. major
).
Была получена выраженная положительная динамика. После передачи сведений о диагнозе согласно положениям приказа № 20/9 от 13.01.04 Департамента здравоохранения Москвы и Центра государственного санитарно-эпидемиологического надзора в Москве «О порядке специального учета инфекционных и паразитарных заболеваний в Москве» для дальнейшего лечения больная была переведена под наблюдение специалиста-паразитолога.
В заключение следует отметить, что противоэпидемические и профилактические мероприятия в очагах зоонозного кожного лейшманиоза значительно сложнее и менее эффективны, чем при антропонозном лейшманиозе, и зависят от структуры очага, вида преобладающего резервуара инфекции, состояния природного биоценоза в данной местности. Основу всех мероприятий составляет широкое использование всех способов истребления диких пустынных грызунов. В качестве профилактической меры используют вакцинацию, которую проводят в осенне-зимний сезон (но не позднее, чем за 3 мес до выезда в эндемический по зоонозному кожному лейшманиозу очаг), в результате чего развивается стойкий пожизненный иммунитет [3]. В районах с жарким климатом всем находящимся на открытом воздухе следует применять специальные противомоскитные сетки, которые в данном случае являются индивидуальными средствами защиты, а также репелленты. Нельзя переоценить своевременность выявления и лечения всех заболевших, что дает возможность предотвратить распространение кожного лейшманиоза среди населения.
В 1950—1970 гг. в СССР осуществлялась целенаправленная работа по борьбе с лейшманиозами, в результате которой заболеваемость некоторыми формами (антропонозный кожный, городская форма висцерального лейшманиоза) была практически ликвидирована. Однако в ранее опубликованной нами работе убедительно показана возможность заражения антропонозным лейшманиозом в Дагестане [8].
Предполагается, что в составе семейства трипаносоматид лейшмании существуют уже около 35—25 млн лет, т. е. появились еще до разделения континентов [3].
Идея о возможности распространения лейшманиоза флеботомусами была высказана Pressot (1905), но ее экспериментальное подтверждение было получено позже. Зоонозную природу одной из форм кожного лейшманиоза установили Н.Н. Латышев и др. (1941) [3].