Проблема остеоартроза
Проблема остеоартроза в Российской Федерации является одной из наиболее актуальных, занимая лидирующее положение среди всех болезней костно-мышечной системы по распространенности. Эпидемиологические исследования, проведенные в течение последних 3-5 лет показывают, что верифицированный остеоартроз по клиническим и рентгенологическим проявлениям присутствует не менее, чем у 13% населения различных возрастов, причем его распространенность значительно увеличивается у пожилых. Это заболевание негативно влияет на работоспособность, социальную активность, самообслуживание в быту, существенно ухудшая качество жизни.
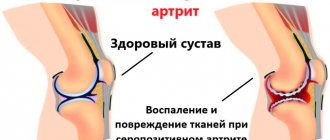
Раньше остеоартроз называли дегенеративным заболеванием, в настоящее время, по мнению ведущих специалистов, это хронический воспалительный процесс, поражающий не только хрящевую ткань, но и суставную капсулу, сухожилия, связки, субхондральную кость. Особый интерес представляет поражение плечевых суставов, при этом следует отметить, что мнение по этиопатогенезу и клиническим проявлениям этой патологии неоднозначно.
В настоящее время дефиниция «плечелопаточный периартрит» не используется, в проведенном нами исследовании в соответствии с современной классификацией включались пациенты со следующей нозологией, относящейся к периартикулярному поражению плечевых суставов:
- Тендиниты мышц вращательной манжеты плеча и биципитальный тендинит М 75.2;
- Кальцифицирующий тендинит М 75.3;
- Субакромиальный (impigment) синдром столкновения М 75.1;
- Ретрактильный капсулит М 75.0;
Цель исследования: оценить эффективность, безопасность и переносимость препаратов «Артрадол» и «Артракам» у пациентов с периартикулярными поражениями плечевых суставов (плечелопаточным периартритом).
Материалы и методы: в исследование были включены 120 пациентов с периартикулярными поражениями области плечевых суставов, а именно:
- Тендиниты мышц вращательной манжеты плеча и биципитальный тендинит — 34 человека
- Кальцифицирующий тендинит — 38 человек
- Субакромиальный (impigment) синдром столкновения — 27 человек
- Ретрактильный капсулит — 21 человек
Нами в динамике наблюдались 47 (39,17%) мужчин и 73 (60,83%) женщин, средний возраст которых оставил 54,5±8,37 лет в диапозоне от 45 до 75 года. Работающих в составе групп наблюдения было 32 (26,66%). Неработающих работоспособного возраста 11 (9,17%), пенсионеров 77 (64,17%).
В первой (контрольной) группе наблюдения не назначались хондропротективные препараты, в том числе «Артрадол» и «Артракам».
Во второй группе через день внутримышечно вводился «Артрадол», сухое вещество растворяли в 1мл воды для инъекций. Первые три инъекции содержали дозу 0,1г, начиная с четвертой инъекции – доза увеличивалась до 0,2г.
В третьей группе в качестве хондропротектора назначался «Артракам», содержимое одного пакетика растворялось больными в 200мл воды и принималось внутрь 1 раз в сутки в течение 6 недель.
В четвертой группе проводилась комбинированное назначение «Артрадола» и «Артракама» по схеме чередования через день внутримышечного введения «Артрадол» 0,2мг и «Артракам» 1 пакетик внутрь.
В проводимом исследовании на курс лечения на одного пациента назначалось 35 ампул по 0,1мг «Артрадола» и 20 пакетиков «Артракама».
В исследование включались больные с периартикулярным поражением плечевых суставов (диагноз плечелопаточного периартита согласно критериям ACR от 1987 года). Они имели рентгенографическую стадию остеоартроза ключично-акромиального сочленения II или III по Kellgren-Lawrence. Все пациенты подписывали информированное согласие.
Исходными критериями исключения были пациенты с вторичным гонартрозом, инфекционным артритом, системными воспалительными заболеваниями, подагрой, псевдоподагрой, болезнью Педжета, внутрисуставными переломами, охранозом, акромегалией, гемохроматозом, болезнью Вильсона, первичным хондроматозом, с хондрокальцинозом, сопутствующими тяжелыми заболеваниями (неконтролируемая артериальная гипертензия, нестабильная стенокардия, сердечно-сосудистая недостаточность, сахарный диабет 1 типа. Тяжелые заболевания печени и почек), с язвой желудка или двенадцатиперстной кишки в течение последнего месяца, с кровотечениями или склонностью к кровоточивости, с тромбофлебитами в анамнезе, беременностью, периодом лактации, а также с индексом массы тела более 40 кг/м2. Также лица, включенные в исследование, не должны были проводить внутрисуставные введения любых препаратов в течение 6 недель до начала исследования. Исключались пациенты с известной повышенной чувствительностью к хондроитин сульфату или глюкозамину сульфату.
У наблюдаемых пациентов была выраженная потребность в приеме нестероидных противовоспалительных препаратов (НПВП) (в течение 30 дней за последние 3 месяца). В начале проведения исследования НПВП не отменялись, больные продолжали прием данной группы препаратов в соответствии с индивидуальным наличием противопоказаний с последующим снижением дозы или отменой НПВП по самочувствию. Так, они принимали: Нимесулид в суточной дозе 200мг в виде саше или таблеток Найз, Кетопрофен внутримышечно по 100мг или по 2 капсулы (200мг) в сутки, Мелоксикам таблетки или инъекции по 15мг в сутки, Ибупрофен 1200мг-2400мг в капсулах в сутки, Аэртал по 1 таблетке 2 раза в сутки или по 1 саше 2 раза в сутки, Найзилат 600мг 2 раза в сутки в виде таблеток, строго за 1 час до еды, Ибуклин по 1 таблетке 3 раза в сутки до еды или через 2-3 часа после еды, не разжевывая.
Оценивая потребность в НПВП подчеркиваем, что регулярный прием НПВП осуществляли 97,5% от включенных в исследование пациентов. Как упоминалось выше, контролировался персонифицированный подбор НПВП с учетом противопоказаний и прогнозируемых нежелательных побочных эффектов. Подбиралась оптимальная доза НПВП, так как более чем у 13,33% она была необоснованно завышена или занижена.
В период терапии не проводились внутрисуставные инъекции глюкокортикоидов, препаратов гиалуроновой кислоты и любых других препаратов. Также исключались из списка назначений препараты, которые обладают хондропротективными свойствами, такие как антикоагулянты, антиагреганты, фибринолитики, не выполнялись физиопроцедуры.
Пациенты, включенные в исследование, страдали коморбидными заболеваниями. Мы выявили 58 больных с верифицированными нозологиями, которые составили 48,3% от всех обследованных. Отметим, что гипертоническая болезнь диагностировалась у 51 (42,5%), спондилоартроз грудного и пояснично-крестцового отделов позвоночника – у 29 (24,2%), атеросклероз – у 21 (17,5%), дисциркуляторная энцефалопатия 2 – у 4 (3,3%), ишемическая болезнь сердца – у 3 (2,5%), хронический обструктивный бронхит – 2 (1,6%), хронический холецистит вне стадии обострения– 2 (1,6%), язвенная болезнь двенадцатиперстной кишки (в анамнезе, обострения соответственно 1 и 2 года назад) – 2 (1,6%), хронический пиелонефрит, хроническая почечная недостаточность I степени – 1 (0,8%), сахарный диабет 2 типа в стадии компенсации – 1 (0,8%). У 62 больных коморбидные состояния не были диагностированы, что составило 51,6%.
Пациентам назначалась поддерживающая фармакотерапия сопутствующей патологии: мочегонные препараты в комплексе с ингибиторами АПФ, а также бета-адреноблокаторы для лечения гипертонической болезни, НПВП и хондропротекторы – для лечения спондилоартроза, статины – для коррекции дислипидемий, ноотропы – для больных с дисциркуляторной энцефалопатией, желчегонные средства и гепатопротекторы – больным хроническим холециститом, ингибиторы протонной помпы – больным с язвенной болезнью. Терапия коморбидных состояний согласовывалась со специалистами по профилю сопутствующей патологии.
У наблюдаемых пациентов исходно по визуально-аналоговой шкале (ВАШ, мм) определялись боли ночью в кровати, боли сидя или лежа, боли в вертикальном положении, боли при движении верхних конечностей (активных и пассивных) и болезненность при пальпации.
Таблица 1 Исходные параметры болевого синдрома у наблюдаемых пациентов (n=120)
| Характеристика болевого синдрома | ВАШ, мм |
| Боли ночью в кровати | 41,5±3,82 |
| Боли сидя и лежа | 43,2±4,03 |
| Боль в вертикальном положении | 45,4±4,12 |
| Боль при активных движениях верхних конечностей | 46,3±4,67 |
| Боль при пассивных движениях верхних конечностей | 49,7±5,11 |
| Болезненность при пальпации | 53,9±4,96 |
Таблица 2 Исходная выраженность болевого синдрома в группах наблюдения
| Характеристика болевого синдрома | 1-я группа | 2-я группа | 3-я группа | 4-я группа |
| Боли ночью в кровати | 41,5±3,82 | 41,2±2,63 | 40,6±3,15 | 41,2±3,87 |
| Боли сидя и лежа | 43,2±4,03 | 44,3±3,84 | 42,3±2,90 | 43,8±3,97 |
| Боль в вертикальном положении | 45,4±4,12 | 46,2±3,76 | 45,7±3,42 | 45,8±3,52 |
| Боль при активных движениях верхних конечностей | 46,3±4,67 | 47,1±4,85 | 46,4±4,71 | 46,7±4,72 |
| Боль при пассивных движениях верхних конечностей | 49,7±5,11 | 50,2±4,98 | 49,8±5,09 | 50,1±5,13 |
| Болезненность при пальпации | 53,9±4,96 | 54,6±4,87 | 54,2±4,93 | 54,4±4,63 |
Таблица 3 Исходные параметры опросника WOMAC у наблюдаемых пациентов (n=120)
| Разделы опросника WOMAC | Баллы (ср. значения) |
| Раздел А. Боль | 43,8±4,09 |
| Раздел Б. Скованность | 26,2±3,91 |
| Раздел В. Затруднения в повседневной деятельности | 53,52±4,87 |
Таблица 4 Исходная выраженность параметров опросника WOMAC в группах наблюдения
| 1-я группа | 2-я группа | 3-я группа | 4-я группа | |
| Раздел А. Боль | 42,6±3,57 | 43,5±4,01 | 44,8±4,16 | 44,5±3,94 |
| Раздел Б. Скованность | 25,4±3,25 | 26,7±3,84 | 28,3±4,06 | 27,9±4,11 |
| Раздел В. Затруднения в повседневной деятельности | 52,5±4,62 | 54,1±4,48 | 55,3±4,69 | 53,6±4,37 |
Исходно статистически достоверных различий по представленным параметрам в табл. 2 и табл. 4 в группах наблюдения не отмечалось.
Для количественной оценки координации в группах наблюдения нами проводился тест «Встань и иди», определявший возможность вставания со стула без опоры в течение расчетного времени в секундах, а также по числовой рейтинговой шкале (ЧРШ) в баллах.
Таблица 5 Исходные параметры теста «Встань и иди» в группах наблюдения
| 1-я группа | 2-я группа | 3-я группа | 4-я группа | |
| Невозможность вставания со стула без опоры (сек) | 9,1±3,71 | 8,9±4,24 | 8,1±3,55 | 9,0±4,05 |
| Невозможность вставания со стула без опоры (баллы ЧШР) | 9,2±3,83 | 8,5±3,96 | 8,0±3,37 | 8,8±3,67 |
Оценка безопасности проводилась по следующим показателям: частота и характер нежелательных явлений, развившихся за период наблюдения, их связь с исследуемым препаратом (связи нет, маловероятна, возможна, вероятна, определена, неизвестна).
Нежелательным явлением считался любой медицинский случай, происходящий с пациентом во время участия в исследовании вне зависимости от связи с проводимой терапией. Критерием досрочного исключения пациента их исследования считалось развитие серьезных нежелательных явлений (явлений приводящих к смерти, угрожающих жизни пациента, а так же требующих хирургического вмешательства и назначения дополнительной терапии). Все случаи нежелательных явлений фиксировались в исследовательской карте и первичной документации, а также направлялись спонсору исследования.
В ходе исследования контролировались показатели анализов крови: клинический (гемоглобин, лейкоциты, СОЭ) и биохимический (АСТ, АЛТ), анализ мочи.
При проведении открытого исследования исключались больные согласно следующим критериям: неэффективность терапии основного заболевания – сохранение или усиление болевого синдрома, требующего коррекции лечения, серьезные нежелательные явления, отказ от участия в исследовании, а также при нарушении протокола.
Артрадол (хондроитин сульфат) – новое средство в лечении остеоартроза
Причиной развития ОА являются различные генетические (у пациентов с врожденными заболеваниями костей и суставов; у женщин ОА встречается гораздо чаще, чем у мужчин) и приобретенные (пожилой возраст, избыточный вес, обменные нарушения, перенесенные операции на суставах, избыточные нагрузки – например, у артистов балета, грузчиков, или травмы суставов) факторы. Определенное значение имеет простуда (например, артроз у рабочих горячих цехов). Причинные факторы ОА представлены в таблице 1. С возрастом риск появления ОА существенно увеличивается. Часто симптомы ОА обнаруживаются уже в 30–40 лет, в возрасте старше 50 лет встречаются у 27% людей, после 60 лет этой болезнью страдают практически все. Наиболее часто встречаются ОА суставов нижней половины тела (тазобедренный, коленный, первый плюсне-фаланговый), а также поражения позвоночника. Со временем развивается деформирующий артроз, из–за искривлений пораженные места могут принимать причудливые очертания: «лебединая шея», «пуговичная петля». Дегенеративно–дистрофические заболевания хрящевой ткани – одна из основных причин хронического болевого суставного синдрома [1,4]. В начале заболевания боль в суставах практически отсутствует в покое, но появляется при нагрузке на сустав. Кроме боли отмечается хруст в суставе, со временем возникают скованность, уменьшение амплитуды движений. Запущенный артроз может привести к инвалидности. Диагностика первичного ОА не вызывает каких–либо затруднений у врачей. Она основывается на диагностических критериях Американского колледжа ревматологов (ACR), которые не претерпели существенных изменений за последние 20 лет. Эти критерии предусматривают обязательное наличие клинических проявлений ОА и специфичных рентгенологических признаков. Рентгенография суставов не только является важным инструментом диагностики ОА, но и позволяет по серии рентгенограмм сделать долгосрочный прогноз заболевания, судить об эффективности лечения и определять тактику ведения пациента при планируемых оперативных вмешательствах (эндопротезирование крупных суставов) [2]. Выбор способа лечения ОА определяется рядом факторов, среди которых основное значение имеют: выраженность боли и воспалительной реакции, функциональная недостаточность, степень структурных изменений, возраст и наличие сопутствующих заболеваний [1]. Как правило, используется комплексный подход в лечении ОА с применением различных немедикаментозных методов, фармакотерапии, а в некоторых случаях – и хирургического вмешательства (артродез, артропластика). Из немедикаментозных методов лечения ОА широко применяют физиотерапию (тепловые процедуры, ультразвук). При ОА назначают также диадинамические токи, электрофорез с обезболивающими и противовоспалительными средствами. Очень эффективно лечение грязью, богатой микроэлементами. Помогают и аппликации парафина с озокеритом, и радоновые ванны. При ОА может быть полезен массаж, но надо избегать непосредственного воздействия на больной сустав, так как это может увеличить в нем воспалительную реакцию. Пациентам следует объяснять, что при ОА противопоказаны резкие колебания температур (высокие температуры, холодовые воздействия). Летом, как правило, болезнь обостряется у тех, кто много времени проводит на пляже, а зимой ей особенно подвержены «моржи». Осенью важно не допускать переохлаждения организма. Эффективно при ОА применяется лечебная гимнастика, очень полезны танцы, причем быстрые, для пожилых – вальсирование, полезны также езда на велосипеде, плавание, прогулки на далекие расстояния. Диета при ОА должна содержать достаточное количество белков и витаминов (особенно С, D). Витамин D в оптимальных количествах содержится в печени трески, тунца, а также в молоке, сметане, йогуртах и сливках. Рекомендуется чаще включать в рацион всевозможные салаты, заправленные растительным маслом, орехи, мед и клюкву. На десерт полезны абрикосы, яблоки, сливы, черешня, вишня. Важно провести коррекцию веса, необходима профилактика ушибов и травм. Пациентам с ОА рекомендуется носить удобную кожаную обувь на невысоком каблуке и легкую одежду из натуральных тканей, не сковывающую движений. Использование ортезов в значительной степени сокращает нагрузку на пораженные суставы, уменьшая болевой синдром. В народной медицине выбор лекарственных растений при ОА достаточно широк: это багульник болотный, листья и почки березы, цветки черной бузины, плоды вишни, донник лекарственный, еловые и можжевеловые ветки для ванн, капустные листья, калужница болотная, крапива, облепиха, пижма, портулак, тимьян, ветреница, крестовник дубравный, купальница, лютики, полынь холодная, прострел, рододендрон. Однако доказательная база эффективности этих средств и возможность только с их применением решить проблемы, возникающие при ОА, в настоящее время отсутствуют. Очевидно, что многие пациенты с ОА не получают адекватную медицинскую помощь. Исследование, проведенное в Великобритании, показало, что только 33% пациентов старше 50 лет, испытывавших боль в коленных суставах в течение 1 года и более, посетили врача общей практики. Остальные пациенты занимались самолечением [2]. Длительное время лекарственными средствами для лечения ОА служили анальгетики и нестероидные противовоспалительные препараты (НПВП). Однако большое число побочных явлений, прежде всего со стороны желудочно–кишечного тракта (ЖКТ) и сердечно–сосудистой системы, ограничивает их широкое применение, особенно в старших возрастных группах [2,16]. Российские, европейские и американские руководства рекомендуют использовать НПВП при ОА в минимальных эффективных дозах и по возможности короткими курсами [1,3,42]. В 2003 г. в рекомендации Европейской антиревматической лиги EULAR по ведению больных ОА были включены так называемые препараты замедленного действия (SYmptomatic Slow Acting Drugs for OsteoArthritis (SYSADOA)). Типичным представителем SYSADOA является хондроитина сульфат (ХС). Международное общество по изучению ОА (OARSI) и EULAR включили ХС в рекомендации по ведению пациентов с ОА. ХС – основной компонент протеогликанов, составляющих вместе с коллагеновыми волокнами хрящевой матрикс, он входит в состав кости, хряща, сухожилий, связок, выполняя ряд важнейших обменных и биомеханических функций. Молекула ХС представляет собой сульфатированный глюкозаминогликан, который состоит из длинных неразветвленных цепей с повторяющимися остатками N–ацетилгалактозамина и глюкуроновой кислоты. Большинство N–ацетилгалактозаминовых остатков сульфатированы в 4–м и 6–м положениях. Подобное строение молекулы ХС обусловливает участие в процессах транспорта воды, аминокислот и липидов в аваскулярных участках хряща. Длинные цепи ХС, входящие в состав экстрацеллюлярного матрикса, определяют важнейшие биомеханические свойства хрящевой ткани [1,4,36]. Уникальные особенности молекулы ХС легли в основу его применения при ОА [1,4,15]. ХС используется в медицинской практике более 40 лет, основной источник его получения – трахея быков. Сырье представляет собой смесь молекул ХС различной массы и длины с вариациями в позиции сульфатных групп. Выпускаемые препараты имеют разную степень очистки от примесей. Все эти отличия могут в конечном счете обусловливать и различный эффект ХС, что следует учитывать при назначении оригинальных препаратов или дженериков [1,4,20,39]. При приеме per os ХС быстро адсорбируется из ЖКТ, при этом в системный кровоток попадают преимущественно низкомолекулярные дериваты (до 90% принятой дозы) и только 10% нативных молекул. Биодоступность ХС зависит от молекулярной массы, степени сульфатирования, наличия примесей и в среднем составляет от 10 до 20% [1,39]. Максимальная концентрация ХС в крови достигается через 3–4 ч после приема, а в синовиальной жидкости – спустя 4–5 ч. Выводится препарат преимущественно почками. Необходимым условием эффективности ХС является накопление его в тканях сустава. Так, F. Ronca и соавт. [35], используя радиоактивные метки, выявили повышенное накопление ХС как в хряще, так и в синовиальной жидкости. Стабильная концентрация ХС в системном кровотоке достигается через 3–4 сут., однако для развития клинического эффекта может понадобиться от 8 до 12 нед. терапии [1]. Механизм действия ХС сложен, многогранен и охватывает почти все ключевые стороны патогенеза ОА. Концепция применения ХС при лечении ОА возникла более 30 лет назад и предполагала воздействие на дегенеративные процессы в хрящевой ткани. ХС рассматривался скорее как «строительный материал» для поврежденного хряща, а нарастание концентрации ХС в экстрацеллюлярном матриксе должно было способствовать запуску репаративных процессов. Действительно, уже в ранних работах были выявлены анаболические свойства ХС: повышение синтеза коллагена II типа и протеогликанов, что подтверждалось и более поздними исследованиями [1,28,40]. Было также показано, что ХС может повышать синтез гиалуроновой кислоты клетками синовиальной оболочки [1,38]. В ходе последующих исследований патогенеза ОА был получен обширный материал, свидетельствующий о вовлечении в патологический процесс не только суставного хряща, но и субхондральной кости, синовиальной оболочки, капсулы сустава и периартикулярных тканей. Неслучайно в настоящее время ОА рассматривается как «органное заболевание», сопровождающееся персистирующим воспалением [1,30]. При дальнейшем изучении механизмов действия ХС оказалось, что препарат обладает большим спектром биологических реакций и оказывает влияние на самые разные звенья патогенеза ОА. В ряде исследований был обнаружен противовоспалительный эффект ХС. Так, при хроническом индуцированном артрите у кроликов ХС уменьшал экспрессию генов и синтез циклооксигеназы–2 (ЦОГ–2), лиганд 2 хемокина (С–Сmotive) в синовиальной мембране. Отмечалось снижение инфильтрации воспалительными клетками синовиальной мембраны и степени ее пролиферации [1,26]. Повышенный синтез ИЛ–1β и ФНО–α наблюдается у всех больных ОА, что имеет большое значение для развития и поддержания воспалительного процесса. ИЛ–1β совместно с ФНО–α индуцируют образование таких провоспалительных медиаторов, как ИЛ–8 и –6, матриксные металлопротеиназы (ММП), ЦОГ–2, оксид азота, простагландин Е2, оказывают катаболическое действие на обменные процессы хрящевой ткани [1,34]. В некоторых исследованиях in vivo было выявлено, что ХС может снижать концентрацию в тканях сустава ИЛ–1 β [1,34] и других провоспалительных медиаторов (ИЛ–6, синтаза нитрита азота, простагландин Е2) [1,8,11,12]. Важнейшая роль в обменных процессах хрящевой ткани принадлежит семейству внеклеточных эндопептидаз (ММП), способных разрушать все типы белков внеклеточного матрикса. Нативный коллаген разрушается преимущественно ММП–1, –8 и –13, причем последняя занимает особое место, поскольку участвует именно в разрушении коллагена 2–го типа [1,22]. Основная роль в патогенезе ОА отводится ММП–3 – ключевому звену гомеостаза суставных протеогликанов и ММП–9, принимающей активное участие в воспалительных реакциях, деградации костной и хрящевой ткани. Степень поражения тканей сустава при ОА может уменьшаться благодаря активности ММП. В ряде исследований показано, что ХС может подавлять индуцированную экспрессию ММП–13 в хондроцитах [1,19]. Использование ХС в экспериментальных моделях также продемонстрировало эффективное ингибирование ММП–3 и –9 [1,13,33]. ХС обладает антиоксидантными свойствами, защищая клетки путем ингибирования реакций окисления протеинов, перекисного окисления липидов и подавляя образование свободных радикалов. В некоторых исследованиях обнаружено, что ХС подавляет апоптоз хондроцитов [1,9,10,25]. Известно, что активация ядерного фактора κβ (NFκβ) является ключевым звеном в развитии воспалительных и иммунных реакций. Связывание NFκβ с промоутером соответствующего гена повышает экспрессию провоспалительных цитокинов, активирует синтазу оксида азота, ЦОГ–2, фосфолипазу А2, ММП, участвующие в воспалительных реакциях и тканевом повреждении. ХС снижает активизацию NFκβ и его ядерную транслокацию в хондроцитах и клетках синовиальной мембраны, что может объяснять некоторые терапевтические аспекты применения этого препарата при ОА. Полагают, что ХС может вызывать аналогичный эффект в макрофагах и гепатоцитах, а это открывает новые возможности для его использования при заболеваниях, сопровождающихся высокой воспалительной активностью. По мнению некоторых исследователей [1,37], применение ХС перспективно при воспалительных заболеваниях кишечника, атеросклерозе, болезнях Паркинсона, Альцгеймера, множественном склерозе, амиотрофическом латеральном склерозе, ревматоидном артрите и системной красной волчанке. Имеются указания на возможную эффективность ХС при псориазе [1,32]. ХС уменьшает процессы резорбции, подавляя экспрессию RANKL и активизируя синтез остеопротегерина, таким образом влияя на процессы ремоделирования субхондральной кости [1,24]. Способность ХС снижать выраженность воспалительных реакций, уменьшать боль и улучшать функциональные показатели изучалась во многих клинических исследованиях. В 2000 г. B.F. Leeb и соавт. [1,23] провели метаанализ 7 двойных плацебо–контролируемых исследований с параллельными группами. Эффективность ХС у 372 пациентов определяли с использованием индекса Лекена, показатели боли оценивали по ВАШ. Длительность исследований составляла от 56 до 1095 дней, в основном – от 90 до 180 дней. Было получено значимое превосходство ХС по сравнению с плацебо по всем показателям, включая боль – 0,9 (95% ДИ 0,8–1,0) и влияние на функцию суставов – 0,74 (95% ДИ 0,65–0,85). Авторы также отметили необходимость дальнейших исследований с большим числом участников. В том же году Т.Е. McAlindon и соавт. [1,29] выполнили метаанализ 15 двойных слепых плацебо–контролируемых исследований эффективности глюкозамина (ГА) и ХС (6 – ГА и 9 – ХС) в качестве симптоматических средств (уменьшение боли и улучшение функционального статуса) для лечения в течение > 4 нед. ОА коленных и тазобедренных суставов. Авторы оценивали силу эффекта (стандартизированное среднее различие): <0,2 – незначительный эффект, 0,5 – средний и >0,8 – выраженный. Согласно результатам анализа, общий эффект для ХС составил 0,78 (95% ДИ 0,6–0,95), однако при учете только крупномасштабных исследований или исследований, характеризующихся высоким качеством, сила эффекта снижалась. G. Bana и соавт. [1,6] проанализировали результаты 7 рандомизированных клинических исследований (РКИ), в которых показано достоверное уменьшение интенсивности боли и индекса Лекена на фоне применения ХС при ОА тазобедренных и коленных суставов. Учитывая появление новых крупных исследований и неоднозначные мнения об использовании медленно действующих препаратов для лечения ОА, экспертами Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартроза (European Society for Clinicaland Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO)) было принято решение о подготовке собственных рекомендаций по применению медленно действующих препаратов при ОА [1,7]. Все заключения основывались на использовании методики GRADE (Grading of Recomendations Assessment, Development and Evaluation): проводилась последовательная оценка качества доказательств с учетом баланса между преимуществами (уменьшение боли, улучшение функциональных показателей) и недостатками препарата (нежелательные явления (НЯ)) с последующим определением силы рекомендаций. В анализ вошли данные РКИ и метаанализов с 1950 по 2007 г. Было установлено, что преимущества применения ХС перевешивали его недостатки (НЯ) и данный препарат может быть рекомендован в качестве эффективного средства для лечения ОА. Для оценки симптом–модифицирующего эффекта в США было проведено многоцентровое двойное слепое РКИ эффективности и безопасности ХС, ГА, целекоксиба и комбинации ХС и ГА у пациентов с ОА коленных суставов [1,14]. Было рандомизировано 1583 пациента с ОА коленных суставов (II–III рентгенологическая стадия) и болевым синдромом длительностью >6 мес. Пациенты принимали стандартные дозы препаратов: 1500 мг/сут. ГА, 1200 мг/сут. ХС, комбинацию ХС и ГА, целекоксиб 200 мг/сут. или плацебо на протяжении 24 нед. Первичной конечной точкой было уменьшение боли в суставе на 20% к окончанию исследования. Авторы в целом не выявили значимого влияния ХС и ГА на показатели боли (эффект считался значимым при снижении ее интенсивности на 20%) по сравнению с плацебо. Однако комбинированное применение ХС и ГА у пациентов с умеренной и выраженной болью оказалось более эффективным по сравнению с плацебо (79,2% против 54,3% соответственно, р=0,002). Кроме того, ХС достоверно уменьшал припухлость сустава (р<0,013). Структурно–модифицирующий эффект этих препаратов выявить не удалось. Имеются данные и о положительном влиянии ХС при ОА суставов кистей. C. Gabay и соавт. [1,17] провели РКИ, включавшее 162 пациента с манифестным ОА суставов кистей. Участники исследования получали либо 800 мг ХС (n=80), либо плацебо (n=82) на протяжении 6 мес. При анализе данных выявлено, что в группе ХС отмечались более выраженное снижение интенсивности боли (общая оценка пациентом) по сравнению с плацебо (различия по ВАШ –8,7 мм, р=0,016), лучшие показатели функционального статуса (различия по FIHOA = –2,14; р=0,008) и меньшая продолжительность утренней скованности. Потребность в приеме ацетаминофена, частота НЯ в группах не различались. Таким образом, в большинстве исследований обнаружено влияние ХС на основные клинические проявления ОА. Структурно–модифицирующий эффект ХС изучался в нескольких РКИ. Оценивалось влияние ХС на динамику рентгенологического сужения суставной щели, являющуюся косвенным маркером поражения суставного хряща при ОА. В.А. Michel и соавт. [1,31] провели РКИ, которое включало 300 пациентов с ОА коленных суставов, получавших ХС в дозе 800 мг/сут. на протяжении 2 лет. Выявлено значимое стабилизирующее влияние ХС на ширину суставной щели. В международном РКИ (622 пациента) также обнаружено значимое протективное действие ХС на изменение ширины суставной щели у пациентов с ОА коленных суставов [1,21]. В то же время проведенный в 2010 г. метаанализ 3 РКИ продолжительностью до 2 лет [1,18] показал статистически значимое, но клинически небольшое снижение скорости сужения суставной щели – 0,13 мм (95% ДИ 0,06–0,19, р=0,002), что соответствовало силе эффекта 0,23 (95% ДИ 0,11–0,35, р=0,001). Аналогичные результаты получили и Y.Н. Lee и соавт. [1,27] при проведении метаанализа 6 РКИ (2 – ГА и 4 – ХС, 1502 пациента). Значимое влияние наблюдалось через 2 года терапии ХС и 3 года лечения ГА. Авторы отметили небольшой, но статистически значимый протективный эффект ГА и ХС в отношении рентгенологического прогрессирования ОА коленных суставов, составивший для ХС 0,261 (95% ДИ 0,131–0,392, р<0,001). Применение магнитно–резонансной томографии (МРТ) позволяет получить дополнительную информацию о суставах, в том числе об объеме суставного хряща, состоянии субхондральной кости, менисков, синовиальной оболочки. Так, L.M. Wildi и соавт. использовали МРТ для оценки структурно–модифицирующего эффекта ХС [1,41]. При поддержке Национального института здоровья Канады было проведено годовое пилотное многоцентровое РКИ, включавшее 69 пациентов с ОА коленных суставов и признаками синовита. Уже спустя 6 мес. в группе принимавших ХС в стандартной дозе 800 мг/сут. отмечалась меньшая потеря общего объема хряща (р=0,03), хряща в латеральных отделах (р=0,015) и в области большеберцовой кости (р=0,002), причем подобные результаты сохранялись на протяжении всего периода наблюдения. Авторы отметили также меньшую степень изменения субхондральной кости в основной группе по сравнению с контрольной. Различия достигали статистической значимости через 1 год после начала исследования и преимущественно наблюдались в латеральных отделах сустава. Таким образом, в литературе имеются указания на структурно–модифицирующий эффект ХС при ОА. Необходимы дальнейшие исследования с использованием новейших методов для подтверждения этого эффекта и определения его клинического значения. ХС обладает высоким профилем безопасности. Ни в одном из клинических исследований не выявлено значимых побочных эффектов ХС, в том числе и при длительном лечении. Метаболизм ХС происходит без участия системы цитохрома Р 450. Следовательно, риск возникновения побочных реакций при совместном применении ХС с другими препаратами чрезвычайно мал. Это весьма важно для пациентов старших возрастных групп, у которых отмечаются высокая коморбидность, а следовательно, и потребность в одновременном использовании большого количества лекарственных средств. Учитывая данные клинических и лабораторных исследований, EULAR рассматривает ХС в качестве одного из самых безопасных лекарственных препаратов для терапии ОА [1]. В настоящее время в терапии ОА используют различные лекарственные формы ХС. Широкое применение нашел препарат Артрадол, содержащий лиофилизированный порошок ХС для приготовления раствора для внутримышечных инъекций. Препарат производится из высококачественного сырья с использованием современных технологий. Артрадол, как и другие препараты ХС, обладает хондропротекторными свойствами, подавляет активность ферментов, вызывающих деградацию суставного хряща, стимулирует выработку хондроцитами протеогликанов, усиливает метаболические процессы в хряще и субхондральной кости, оказывает влияние на фосфорно–кальциевый обмен в хрящевой ткани. Препарат легко всасывается при внутримышечном введении, накапливается в хрящевой ткани и через 30 мин. обнаруживается в значительных концентрациях в крови, через 15 мин. – в синовиальной жидкости. Максимальная концентрация в суставном хряще достигается через 48 ч [2,4,5]. Артрадол обладает противовоспалительными и анальгезирующими свойствами, способствует снижению выброса в синовиальную жидкость медиаторов воспаления и болевых факторов через синовиоциты и макрофаги синовиальной оболочки, подавляет секрецию лейкотриена B4 и простагландина E2. Препарат способствует восстановлению хрящевых поверхностей суставов, препятствует коллапсу соединительной ткани, нормализует продукцию суставной жидкости, что ведет к улучшению подвижности суставов и уменьшению болей. Обладая структурным сходством с гепарином, Артрадол может препятствовать образованию фибриновых тромбов в синовиальном и субхондральном микроциркуляторном русле [1,2,4]. Показанием для назначения Артрадола являются: первичный артроз, ОА с поражением крупных суставов, межпозвонковый остеохондроз. Применяется внутримышечно, по 0,1 г через день. Перед применением содержимое ампулы растворяют в 1 мл воды для инъекций. При хорошей переносимости дозу увеличивают до 0,2 г начиная с 4–й инъекции. Курс лечения – 25–35 инъекций. Повторный курс – через 6 мес. Продолжительность повторных курсов лечения устанавливается врачом. С осторожностью следует применять при склонности к кровоточивости, тромбофлебитах, в периоды беременности и лактации. Возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертываемости крови при совместном применении. ОА относится к достаточно гетерогенным заболеваниям, при которых основные клинические проявления могут варьировать в широких пределах, и пациентам могут оказывать помощь врачи различных специальностей (терапевт, врач общей практики, ревматолог, невролог, ортопед–травматолог и др.). В таких случаях соблюдение преемственности может быть затруднено. В соответствии с утвержденным порядком оказания медицинской помощи пациентам с ревматическими болезнями (приказ Минздравсоцразвития РФ № 315н от 4 мая 2010 г.) в рамках первичной медико–санитарной помощи в амбулаторно–поликлинических условиях такая помощь осуществляется участковым врачом–терапевтом, врачом общей практики (семейным врачом) в соответствии с установленными стандартами с учетом рекомендаций врачей–ревматологов. Пункт 4 приказа говорит о том, что лечение пациентов с ОА мелких, средних и крупных суставов без синовитов и не нуждающихся в эндопротезировании осуществляется врачами–терапевтами и врачами общей практики с учетом рекомендаций врачей–ревматологов. Важно отметить, что при направлении к врачу–ревматологу участковые врачи–терапевты должны предоставить выписку из амбулаторной карты с указанием предварительного диагноза, сопутствующих заболеваний и клинических проявлений болезни, а также имеющихся данных лабораторных и функциональных исследований [2]. Таким образом, информация о новых эффективных лекарственных препаратах для лечения ОА важна не только узкоспециализированным врачам, но прежде всего врачам первичного звена здравоохранения (терапевт, врач общей практики). Планируется проведение исследований Артрадола в нескольких ведущих ревматологических центрах России. Литература 1. Аникин С.Г., Алексеева Л.И. Хондроитин сульфат: механизмы действия, эффективность и безопасность при терапии остеоартроза // Современная ревматология.2012. № 3. 2. Зоткин Е.Г., Шкиреева С.Ю. Особенности ведения пациентов с остеоартрозом в первичном звене здравоохранения // РМЖ. 2012. № 27. 3. Клинические рекомендации. Ревматология Под ред. акад. РАМН Е.Л. Насонова. М.: ГЭОТАР–Медиа, 2010. С. 326. 4. Никищенкова А.С., Жулев С.Н., Жулев Н.М., Овсянникова Н.А. Артрадол (хондроитина сульфат) в лечении остеохондроза и спондилоартроза позвоночника // Неврология/ревматология. Приложение Consilium Medicum. 2012. № 2. 5. Фоломеева О.М., Амирджанова В.Н., Якушева Е.О. и др. Анализ структуры XIII класса болезней // Рос. ревматол. 1998. № 1. С. 2–7. 6. Bana G., Jamard B., Verrouil E. et al. Chondroitin sulfate in the management of hip and knee OA: an overview // AdvPharmacol. 2006. Vol. 53. Р. 507–522. 7. Bruyere O., Burlet N., Delmas P.D. et al. Evaluation of symptomatic slow–acting drugs in osteoarthritis using the GRADE system // BMC Musculoskelet Dis. 2008. Vol. 9. Р. 165. 8. Campo G.M., Avenoso A., Campo S. et al. Chondroitin sulfate: antioxidant properties and beneficial effects // Mini Rev Med Chem. 2006. Vol. 6 (12). Р. 1311–1320. 9. Campo G.M., Avenoso A., Campo S. et al. Glycosaminoglycans modulate inflammation and apoptosis in LPS–treated chondrocytes // J Cell Biochem. 2009. Vol. 106 (1). Р. 83–92. 10. Caraglia M., Beninati S.D., Alessandro A.M. et al. Alternative therapy of earth elements increases the chondroprotective effects of chondroitin sulfate in mice // ExpMol Med. 2005. Vol. 37. Р. 476–481. 11.Chan P.S., Caron J.P., Rosa G.J. et al. Glucosamine and chondroitin sulfate regulate gene expression and synthesis of nitric oxide and prostaglandin E(2) in articular cartilage explants // OsteoarthrCartil. 2005. Vol. 13 (5). Р. 387–394. 12. Cho S.Y., Sim J.S., Jeong C.S. et al. Effects of low molecular weight chondroitin sulfate on type II collagen–induced arthritis in DBA/1J mice // Biol Pharm Bull. 2004. Vol. 27 (1). Р. 47–51. 13. Chou M.M., Vergnolle N., McDougall J.J. et al. Effects of chondroitin and glucosamine sulfate in a dietary bar formulation on inflammation, interleukin–1beta, matrix metalloprotease–9, and cartilage damage in arthritis // ExpBiol Med (Maywood). 2005. Vol. 230 (4). Р. 255–262. 14. Clegg D.O., Reda D.J., Harris C.L. et al. Glucosamine, chondroitin sulfate and the two in combination for painful knee osteoarthritis // N Engl J Med. 2006. Vol. 354 (8). Р. 795–808. 15. Conte A., Volpi N., Palmieri L. et al. Biochemical and pharmacological aspects of oral treatment with chondroitin sulfate // Arzneim Drug Res. 1995. Vol. 45. Р. 918–925. 16. DeHaan M., Guzman J., Bayley M. et al. Knee osteoarthritis clinical practice guidelines — how are we doing? // J. Rheumatol. 2007. Vol. 34. P. 2099–2105. 17. Gabay C., Medinger–Sadowski C., Gascon D. et al. Symptomatic effects of chondroitin 4 and chondroitin 6 sulfate on hand osteoarthritis: a randomized, doubleblind, placebo–controlled clinical trial at a single center // Arthr Rheum. 2011. Vol. 63 (11). Р. 3383–3391. 18. Hochberg M.C. Structure–modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta–analysis of randomized placebo–controlled trials of 2–year duration // OsteoarthrCartil. 2010. Vol. 18 (Suppl 1). Р. 28–31. 19. Нolzmann J., Brandl N., Zemann A. et al. Assorted effects of TGFbeta and chondroitin sulfate on p38 and ERK1/2 activation levels in human articular chondrocytes stimulated with LPS // OsteoarthrCartil. 2006. Vol. 14. Р. 519–525. 20. Imada K, Oka H, Kawasaki D et al. Anti–arthritic action mechanism of natural chondroitin sulfate in human articular chondrocytes and synovial fibroblasts // Biol Pharm Bull. 2010. Vol. 33 (3). Р. 210–214. 21. Kahan A., Uebelhart D., de Vathaire F. et al. Long–term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a twoyear, randomized, double–blind, placebocontrolled trial // Arthr Rheum. 2009. Vol. 60 (2). Р. 524–533. 22. Knäuper V., Lopez–Otin C., Smith B. et al. Biochemical characterization of human collagenase–3 // J BiolChem. 1996. Vol. 271 (3). Р. 1544–1550. 23. Kwan Tat S., Schweitzer H., Montag K. et al. A metaanalysis of chondroitin sulfate in the treatment of osteoarthritis // J Rheum. 2000. Vol. 27 (1). Р. 205–211. 24. Kwan Tat S., Pelletier J.P., Lajeunesse D. et al. The differential expression of osteoprotegerin (OPG) and receptor of nuclear factor kB ligand (RANKL) in human osteoarthritic subchondral bone osteoblasts is an indicator of the metabolic state of these disease cell // Clin Exp Rheum. In press. 25. Jomphe C., Gabriac M., Hale T.M. et al. Chondroitin sulfate inhibits the nuclear translocation of nuclear factor–kappa B in interleukin–1beta–stimulated chondrocytes // Basic ClinPharmacolToxicol. 2008. Vol. 102. Р. 59–65. 26. Largo R., Roman–Blas J.A., Moreno–Rubio J. идр. Chondroitin sulfate improves synovitis in rabbits with chronic antigeninduced arthritis // OsteoarthrCartil. 2010. Vol. 18 (Suppl. 1). Р. 17–23. 27. Lee Y.H., Woo J.H., Choi S.J. et al. Effect of glucosamine or chondroitin sulfate on the osteoarthritis progression: a meta–analysis // Rheum Int. 2010. Vol. 30 (3). Р. 357–363. 28. Legendre F., Bauge C., Roche R. et al. Chondroitin sulfate modulation of matrix and inflammatory gene expression in IL–1betastimulated chondrocytes–study in hypoxic alginate bead cultures // OsteoarthrCartil. 2008. Vol. 16 (1). Р. 105–114. 29. McAlindon T.E., LaValley M.P., Gulin J.P. et al. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta–analysis // JAMA. 2000. Vol. 283 (11). Р. 1469–1475. 30. Martel–Pelletier J., Lajeunesse D., Pelletier J.P. Etiopathogenesis of osteoarthritis. In: Arthritis and Allied Conditions: A Textbook of Rheumatology. W.J. Koopman, L.W. Moreland (eds). Baltimore: lippincott, Wikings W., 2005. Р. 2199–2296. 31. Michel B.A., Stucki G., Frey D. et al. Chondroitins 4 and 6 sulfate in osteoarthritis of the knee: a randomized, controlled trial // Arthr Rheum. 2005. Vol. 52 (3). Р. 779–786. 32. Möller I., Perez M., Monfort J. et al. Effectiveness of chondroitin sulfate in patients with concomitant knee osteoarthritis and psoriasis: a randomized, double–blind, placebo–controlled study // OsteoarthrCartil. 2010. Vol. 18 (Suppl 1). Р. 32–40. 33. Monfort J., Nacher M., Montell E. et al. Chondroitin sulfate and Hyaluronic acid (500–730 kDa) inhibit stromelysin–1 synthesis in human osteoarthritic chondrocytes // Drugs ExpClin Res. 2005. Vol. 31. Р. 71–76. 34. Pelletier J.P., Martel–Pelletier J., Abramson S.B. Osteoarthritis, an inflammatory disease: potential implication for the selection of new therapeutic targets // Arthr Rheum. 2001. Vol. 44 (6). Р. 1237–1247. 35. Ronca F., Palmieri L., Panicucci P. et al. Anti–inflammatory activity of chondroitin sulfate. OsteoarthrCartil. 1998. Vol. 6 (Suppl. A). Р. 14–21. 36. United States Senate Committee on Health, Education, Labor and Pensions, Sub committee on aging. Centre for Disease Control. Washington, D.C.: Department of Health and Human Services, 2004. 37. Valliеres M., du Souich P. Modulation of inflammation by chondroitin sulfate // OsteoarthrCartil. 2010. Vol. 18 (Suppl. 1). Р. 1–6. 38. Verbruggen G., Veys E.M. Influence of sulphatedglycosaminoglycans upon proteoglycan metabolism of the synovial lining cells // ActaRhumBelg. 1977. Vol. 1 (12). Р. 75–92. 39. Volpi N. Quality of different chondroitin sulfate preparations in relation to their therapeutic activity // J Pharm Pharmacol. 2009. Vol. 61 (10). Р. 1271–1280. 40. Wang L., Wang J., Almqvist K.F. et al. Influence of polysulphated polysaccharides and hydrocortisone on the extracellular matrix metabolism of human articular chondrocytes in vitro // Clin Exp Rheum. 2002. Vol. 20 (5). Р. 669–676. 41. Wildi L.M., Raynauld J.P., Martel–Pelletier J. et al. Chondroitin sulfate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double–blind, placebo–controlled pilot study using MRI // AnnRheumDis. 2011. Vol. 70 (6). Р. 982–989. 42. Zhang W., Nuki G., Moskowitz R.W. et al. OARSI recommendations for the Management of hip and knee osteoarthritis Part III: changes in evidence following systematic cumulative update of research published through January 2009 // OsteoarthrCartil. 2010. Vol. 18 (4). Р. 476–499.
Результаты исследования
По итогам проведенного наблюдения за группами пациентов нами выявлена динамика клинических показателей (табл. 6, 7).
Таблица 6 Динамика болевого синдрома в группах наблюдения
| 1-я группа | 2-я группа | 3-я группа | 4-я группа | |||||
| До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | |
| Боли ночью в кровати | 41,5±3,82 | 40,9±4,11 | 41,2±2,63 | 35,1±2,41* | 40,6±3,15 | 32,4±2,77* | 41,2±3,87 | 15,3±1,96** |
| Боли сидя и лежа | 43,2±4,03 | 42,9±4,14 | 44,3±3,84 | 41,6±3,50* | 42,3±2,90 | 38,2±3,33* | 43,8±3,97 | 16,5±1,85** |
| Боль в вертикальном положении | 45,4±4,12 | 42,3±3,96 | 46,2±3,76 | 38,3±2,97* | 45,7±3,42 | 41,5±3,64* | 45,8±3,52 | 17,1±1,93** |
| Боль при активных движениях верхних конечностей | 46,3±4,67 | 44,7±4,43 | 47,1±4,85 | 42,6±3,92* | 46,4±4,71 | 42,1±4,25* | 46,7±4,72 | 18,9±2,03** |
| Боль при пассивных движениях верхних конечностей | 49,7±5,11 | 46,2±4,93 | 50,2±4,98 | 43,9±2,86* | 49,8±5,09 | 41,6±4,11* | 50,1±5,13 | 20,1±4,35** |
| Болезнен-ность при пальпации | 53,9±4,96 | 49,4±3,85 | 54,6±4,87 | 45,2±3,76* | 54,2±4,93 | 46,1±3,86* | 54,4±4,63 | 22,6±3,72** |
Примечание: * p<0,05; ** — p<0,01 – достоверность межгрупповых различий после лечения.
Таблица 7 Динамика выраженности параметров опросника WOMAC в группах наблюдения
| 1-я группа | 2-я группа | 3-я группа | 4-я группа | |||||
| До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | |
| Раздел А. Боль | 42,6±3,57 | 39,5±3,26 | 43,5±4,01 | 19,6±2,82** | 44,8±4,16 | 21,4±3,18** | 44,5±3,94 | 11,2±1,37** |
| Раздел Б. Скованность | 25,4±3,25 | 22,1±2,97 | 26,7±3,84 | 19,1±1,74* | 28,3±4,06 | 18,2±2,45* | 27,9±4,11 | 13,5±2,06** |
| Раздел В. Затруднения в повседневной деятельности | 52,5±4,62 | 45,3±4,39 | 54,1±4,48 | 23,5±3,26** | 55,3±4,69 | 24,4±2,83** | 53,6±4,37 | 18,7±2,12** |
Примечание: * p<0,05; ** — p<0,01 – достоверность межгрупповых различий после лечения.
В результате проведенной терапии как во второй-третьей группах, так и при проведении комбинированной терапии, отмечалась положительная динамика болевого синдрома, скованности и затруднений повседневной деятельности, что доказывает высокую эффективность монотерапии препаратами «Артрадолом» и «Артракамом», с синергическим эффектом их совместного назначения.
Таблица 8 Динамика количественной оценки координационного теста «Встань и иди»
| 1-я группа | 2-я группа | 3-я группа | 4-я группа | |||||
| До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | |
| Невозмож-ность вставания со стула без опоры (сек) | 9,1±3,75 | 8,6±2,65 | 8,9±4,26 | 4,5±2,54* | 8,1±3,51 | 3,6±2,57* | 9,0±4,05 | 0,6±0,41** |
| Невозмож-ность вставания со стула без опоры (баллы ЧШР) | 9,2±3,84 | 8,5±2,74 | 8,5±3,97 | 4,4±2,15* | 8,0±3,38 | 3,5±2,62* | 8,8±3,63 | 0,5±0,34** |
Примечание: * p<0,05; ** — p<0,01 – достоверность межгрупповых различий после лечения.
Значительная динамики координационного теста «Встань и иди» характеризует расширение активности повседневной деятельности и улучшение самообслуживания наблюдаемых пациентов.
В исследовании проводилась оценка эффективности терапии врачом и пациентом, которая была рассчитана на фоне постоянного приема НПВП.
Таблица 9 Эффективность исходной терапии у пациентов, включенных в исследование, оцениваемая врачами и пациентами
| Оценка | Количество больных | ||
| n | % | ||
| Больного | Очень хорошо | 0 | 0 |
| Хорошо | 19 | 1583 | |
| Удовлетворительно | 61 | 5084 | |
| Плохо | 38 | 3166 | |
| Очень плохо | 2 | 167 | |
| Врача | Очень хорошо | 0 | 0 |
| Хорошо | 26 | 2167 | |
| Удовлетворительно | 90 | 75 | |
| Плохо | 4 | 333 | |
| Очень плохо | 0 | 0 | |
Таблица 10 Нежелательные побочные явления, выявленные при наблюдении в группах исследования
| Нежелательные побочные реакции | 1 группа (n=30) | 2 группа (n=30) | 3 группа (n=30) | 4 группа (n=30) | ||||
| Гастралгии | 1 | 333% | 2 | 667% | 1 | 333% | 2 | 667% |
| Диарея | 1 | 333% | 1 | 333% | 1 | 333% | 1 | 333% |
| Метеоризм | 1 | 333% | 0 | 0% | 0 | 0% | 0 | 0% |
| Покраснение лица | 1 | 333% | 0 | 0% | 0 | 0% | 0 | 0% |
| Синовит | 0 | 0% | 0 | 0% | 1 | 333% | 1 | 333% |
Согласно данным, представленным в табл.10 отмечается хорошая переносимость препаратов «Артрадол» и «Артракам», как в монотерапии, так и в комбинированной терапии. Наблюдалось появление нежелательных побочных реакций при проведении монотерапии «Артрадолом» у 10%, а «Артракамом» у 9,99%. При проведении курсовой комбинированной терапии выявлено повышение нежелательных побочных реакций до 3,32%. Серьезные нежелательные явления выявлены не были.
Связь нежелательных явлений с приемом препаратов была возможной или вероятной. Для коррекции нежелательных побочных эффектов проводились диетические мероприятия, при развитии гастралгий, отменялись НПВП и назначались спазмолитические средства (во всех группах однократно). При появлении тошноты, продолжительность которой не превышала 10 часов, назначался метоклопрамид. Появление метеоризма и покраснение лица не требовали назначение медикаментов. Синовит купировался назначением НПВП в адекватных дозах. Необходимости в отмене терапии в группах наблюдения не возникало.
Потребность в НПВП в группах наблюдения уменьшилась: через две недели у 24 (80%) пациентов во 2 группе, у 23 (76,7%) – в 3 группе, у 27 (90%) – в 4 группе. Через 1 месяц продолжала снижаться потребность в регулярном приеме НПВП. Отказались от приема нестероидных препаратов во 2 группе 27 (90%), в 3 группе – 28 (93,3%), в 4 группе – 29 (96,7%).
Осуществляя наблюдение за пациентами с коморбидной патологией, нами не было выявлено отрицательных реакций лекарственного взаимодействия, что не потребовало изменения рекомендаций специалистов соответствующего профиля.
Обсуждение
Новости медицины и фармакологии в области лечения заболеваний суставов и позвоночника
Артрадол лиофилизат для приготовления раствора для внутримышечного введения 100мг, 10 ампул
Владелец регистрационного удостоверения
ИНКАМФАРМ (Россия)
Лекарственная форма
Лекарственный препарат — Артрадол® (Artradol)
Описание
Лиофилизат для приготовления раствора для в/м введения
белая или белая с желтоватым оттенком пористая масса, уплотненная в таблетку.
1 амп.
хондроитина сульфат натрия 100 мг
Ампулы вместимостью 2 мл (5) — поддоны пластиковые (2) — пачки картонные. Ампулы вместимостью 2 мл (10) — держатели картонные (1) — пачки картонные.
Показания
Дегенеративно-дистрофические заболевания суставов и позвоночника (остеоартроз периферических суставов, межпозвонковый остеоартроз и остеохондроз), для ускорения формирования костной мозоли при переломах.
Противопоказания к применению
Повышенная чувствительность к хондроитина сульфату, склонность к кровоточивости, тромбофлебиты; для в/м введения и приема внутрь — детский возраст до 18 лет, беременность, период грудного вскармливания; для внутрисуставного введения — наличие активных воспалительных и инфекционных процессов в суставе, наличие активного заболевания кожи и кожной инфекции в области предполагаемой инъекции.
С осторожностью
Одновременное применение с антикоагулянтами прямого действия.
Фармакологическое действие
Средство, влияющее на фосфорно-кальциевый обмен в хрящевой ткани, является высокомолекулярным мукополисахаридом. Оказывает хондростимулирующее, регенерирующее, противовоспалительное и анальгезирующее действие. Хондроитин сульфат участвует в построении основного вещества хрящевой и костной ткани. Обладает хондропротекторными свойствами, усиливает обменные процессы в гиалиновом и волокнистом хрящах, субхондриальной кости; ингибирует ферменты, вызывающие деградацию (разрушение) суставного хряща; стимулирует выработку хондроцитами протеогликанов. Способствует снижению выброса в синовиальную жидкость медиаторов воспаления и болевых факторов, подавляет секрецию лейкотриенов и простагландинов. Замедляет резорбцию костной ткани и снижает потери кальция, ускоряет процессы восстановления костной ткани. Хондроитин сульфат замедляет прогрессирование остеоартроза и остеохондроза. Способствует восстановлению суставной сумки и хрящевых поверхностей суставов, препятствует коллапсу соединительной ткани, нормализует продукцию суставной жидкости.
Обладая структурной схожестью с гепарином, потенциально может препятствовать образованию фибриновых тромбов в синовиальном и субхондриальном микроциркуляторном русле.
Лекарственное взаимодействие
Возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертывания крови при совместном применении.
Режим дозирования
Внутрь взрослым — по 1.5-1 г 2 раза/сут.
В/м — по 100 мг хондроитина сульфат натрия через день. При хорошей переносимости дозу увеличивают до 200 мг , начиная с четвертой инъекции. Курс лечения — 25-30 инъекций. При необходимости возможно проведение повторных курсов лечения через 6 месяцев.
Для внутрисуставного введения разовая доза — 200 мг. Частота и длительность применения — по специальной схеме.
Побочное действие
Аллергические реакции: нечасто — кожный зуд, эритема, крапивница, дерматит, ангионевротический отек.
Со стороны пищеварительной системы: часто — диарея, боли в животе, тошнота; частота неизвестна — рвота.
Местные реакции: боль и геморрагии в месте инъекции.
Особые указания
При аллергических реакциях или геморрагиях лечение следует прекратить.
Применение при беременности и кормлении грудью
Ограничения при беременности — Противопоказано. Ограничения при кормлении грудью — Противопоказано.Противопоказано применение при беременности и в период грудного вскармливания.
Применение у пожилых пациентов
Ограничения для пожилых пациентов — С осторожностью.Специальные указания по применению у пациентов пожилого возраста отсутствуют.
Применение у детей
Ограничения для детей — Противопоказано.Противопоказано применение у детей и подростков до 18 лет.