Рассказывает наш эксперт – врач-эндокринолог- диетолог, создатель авторской программы питания Вадим Крылов.
Витамин В₁ – главнейший игрок в работе мозга и всей нервной системы. Его ещё можно называть «министром энергетики», так как он входит в состав нескольких ферментов, играющих ключевую роль в энергетическом обмене в клетке. И когда его мало, ферменты перестают работать и появляется нехватка энергии. Как показывают исследования, дефицит В₁ развивается достаточно быстро и может привести к весьма негативным последствиям в организме, а в тяжёлых случаях и к летальному исходу.
Статья по теме Парадоксальный биотин. Что такое витамин В7 и почему он так важен?
Болезнь императоров
Состояние, связанное с тяжёлым дефицитом витамина В₁, называется бери-бери, или болезнью китайских императоров. Дело в том, что аристократы в Китае, Японии и других странах этого региона ели только белый очищенный рис, считавшийся благородным. Но при шелушении риса с оболочками зёрен терялись полезные вещества, в том числе и витамин В₁. Из-за очень однообразного питания других источников тиамина в этих странах не было, что приводило к его тяжёлому дефициту.
Витамин В₁ – водорастворимый. Он не накапливается в организме, а избыток выводится с мочой. Эта особенность типична для всех витаминов группы В. Поэтому их нужно употреблять каждый день, чтобы не было дефицита. Важно, что передозировки витамином В₁ не бывает, даже если будете употреблять его во много раз больше рекомендуемой дневной нормы. Организм возьмёт всё что нужно, а остальное выведется через почки.
Прежде всего тиамин нужен для синтеза ацетилхолина – одного из важнейших нейромедиаторов нервной системы, от которого зависит проводимость сигналов в мозг и по нервам. Поэтому при недостатке тиамина в первую очередь страдают нервная система и психика: возникают слабость, быстрая утомляемость, ухудшается память. При тяжёлом дефиците, как при бери-бери, нарушается нервная проводимость, появляется паралич ног, люди перестают ходить и может наступить смерть.
Нажмите для увеличения
Витамин В1
Тиамин (витамин B1) является важным питательным веществом, которое служит кофактором для ряда ферментов, в основном с митохондриальной локализацией. Некоторые зависимые от тиамина ферменты участвуют в энергетическом метаболизме и биосинтезе нуклеиновых кислот, тогда как другие являются частью антиоксидантного механизма. Мозг очень уязвим для дефицита тиамина из-за его зависимости от митохондриальной продукции АТФ. Это положение более очевидно во время быстрого роста детей, при котором дефицит тиамина обычно связан с недоеданием или генетическими дефектами. Дефицит тиамина способствует возникновению ряда расстройств неврологических и психопатологических симптомов (спутанность сознания, снижение памяти и нарушения сна) до тяжелой энцефалопатии, атаксии, застойной сердечной недостаточности, мышечной атрофии и даже смерти.
Основным питательным веществом тиамина (витамин B1) является водорастворимый серосодержащий витамин, принадлежащий к комплексу витаминов группы B. Не будучи эндогенно синтезированным, единственным доступным источником тиамина являются некоторые продукты питания (говядина, птица, крупы, орехи и бобы). Организм не хранит тиамин > 30 мг, а период полураспада для тиамина составляет всего 9–18 дней. При среднем потреблении продуктов питания на уровне в 2000 ккал,( потребляемом ежедневно), минимальная потребность в тиамине составляет 0,66 мг , однако, рекомендуемая суточная доза для взрослых мужчин и женщин составляет 1,2 и 1,1 мг соответственно. Во время беременности или кормления грудью потребность в витамине В1 увеличивается до 1,4 мг / день. У детей рекомендуемая диета (RDA) зависит от возраста и составляет от 0,2 мг (от рождения до 6 месяцев) до 0,6 мг (от 6 месяцев до 8 лет). В организме человека богатыми тиамином ткани являются скелетные мышцы, сердце, печень, почки и мозг.
В развитых странах преобладающее использование промышленной обработки пищевых продуктов часто истощает содержание тиамина наряду с другими витаминами и питательными веществами. Повышенное потребление обработанных пищевых продуктов в форме простых углеводов, не дополненных адекватными уровнями тиамина, было названо «калорийным недоеданием». С другой стороны , по меньшей мере, у 29% пациентов с ожирением, которым предстоит хирургическое операции на бариатрической стадии, отмечается как дефицит тиамина. Поскольку тиамин является ключевым фактором метаболизма глюкозы, увеличение потребления углеводов будет пропорционально увеличивать диетическую потребностьи в тиамине (минимум 0,33 мг на 1000 ккал). Таким образом, вместо того, чтобы сосредоточиться на RDA тиамина, важно сопоставить его потребление с потреблением углеводов, а также с общим потреблением калорий.
В развивающихся странах дефицит тиамина остается широко распространенной проблемой из-за высоких показателей потребления белого риса. Поскольку домашние методы измельчения заменяются промышленным измельчением и переработкой риса, важные питательные вещества (такие как тиамин) в отрубях удаляются. Азиатские страны потребляют около 90% риса, произведенного во всем мире, реализуя , по оценкам специалистов , 60% суточной потребности населения в потреблении энергии с пищей, и, следовательно, дефицит тиамина достаточно распространен среди 15% подросткового населения. Дефицит тиамина может развиться при употреблении в пищу диет, загрязненных метаболизирующими тиамин ферментами (например, тиаминазой) или подверглись инактивации тиамина нагреванием и / или диоксидом серы. Чрезмерное употребление танинсодержащих или пищевых продуктов, богатых кофеином, теобромином и теофиллином (например, содержащихся в кофе, шоколаде и чае соответственно), может инактивировать тиамин, тем самым нарушая его статус.
Другие факторы риска , которые увеличивают вероятность недостаточного потребления тиамина включают старение, низкий экономический статус, расстройства пищевого поведения, соматические заболевания , в частности, влияющие на желудочно — кишечный тракт, искусственное питание, бариатрическая хирургия, диабет и злоупотребление алкоголем. Сообщается о неудовлетворенных потребностях в увеличении потребления тиамина в пищу во время лактации, беременности и повышенной физической активности. Во время лактации у детей повышается риск развития авитаминоза , в частности, у дефиците тиамина у матерей. Например, у 27% женщин детородного возраста в Камбодже имеет место дефицит тиамина, а у 38% младенцев диагностирован дефицит тиамина, что является критической проблемой, которая в значительной степени способствует смертности 3-месячных детей. Однако даже при наличии достаточного потребления тиамина его дефицит может быть обусловлен генетическими факторами, то есть патогенными мутациями генов в ключевых регуляторах пути трансформации тиамина, включая тиаминпирофосфокиназу 1 (ТПК1), тиаминдифосфаткиназу (TDPK), тиаминтрифосфатазу (THTPA) и переносчики тиамина (SLC25A19, SLC19A2 / THTR1 и SLC19A3 / THTR. также было показано, что переносчик органических катионов 1 (OCT1) действует как транспортер тиамина в печени.
Независимо от основной причины дефицита тиамина большинство симптомов проявляются на неврологическом уровне. Дефицит тиамина может вызвать повреждение тканей головного мозга, ингибируя использование энергии мозга, учитывая критическую роль тиамин-зависимых ферментов, связанных с использованием глюкозы. Это подтверждается значительным уровнем поглощения тиамина гематоэнцефалическим барьером, что подчеркивает высокую потребность мозга в тиамине и потребность в его снабжении для поддержания адекватных функций мозга, особенно в тех областях мозга, где требуются высокий уровень метаболизма и оборот тиамина.
Как и у большинства гидрофильных микроэлементов, поглощение тиамина происходит в основном в тонком кишечнике. В пищеварительном тракте пищевые белки гидролизуются, выделяя тиамин. В просвете кишечника щелочные фосфатазы катализируют гидролиз тиаминфосфорилированных производных в свободный тиамин. Нефосфорилированный свободный тиамин в концентрациях, превышающих 1 мкМ, поступает в энтероцит путем пассивной диффузии, тогда как на более низких уровнях он транспортируется через систему насыщения тиамином / H + ( переносчик тиамина 1 или THTR1) в зависимости от количества энергии. В условиях дефицита тиамина в клетках Caco2 в культуре наблюдалась активация экспрессии переносчика тиамина 2 (THTR2), что позволяет предположить, что диета может модулировать экспрессию этого транспортера . Внутри энтероцита тиамин фосфорилируется до тиаминпирофосфата (TPP) с помощью TPK1. Затем большая часть TPP дефосфорилируется до тиаминмонофосфата (TMP), чтобы пересечь базальную мембрану энтероцита. TMP высвобождается в кровоток через ATPase-зависимую транспортную систему. Свободный тиамин также может попасть в кровь через транспортер тиамина 2 (THTR2), расположенный в основном на базолатеральной мембране энтероцита. Попадая в кровь, в то время как очень низкие уровни TMP и тиамина циркулируют свободно в плазме или сыворотке, более 90% фосфорилированного тиамина (в форме TPP) присутствует в эритроцитах и лейкоцитах. Примечательно, что изоформа 3 носителя SLC44A4 недавно была описана как носитель TPP в толстой кишке. Первоначально SLC44A4 был описан как транспортер холина, связанный с не нейрональным синтезом холина и необходимый для эфферентной иннервации волосковых клеток в оливо-кохлеарном пучке для поддержания физиологической функции наружных волосковых клеток и защиты волосковых клеток. от акустической травмы. Последние данные указывают на то, что этот носитель может опосредовать абсорбцию микробиоты, генерируемой TPP (особенно у младенцев), и способствовать гомеостазу тиамина хозяина.
Клеточное поглощение тиамина из кровотока может быть опосредовано любым из двух высокоаффинных носителей: THTR1 (кодируется SLC19A2) и THTR2 (кодируется SLC19A3). Эти транспортеры выражены повсеместно, но THTR1 наиболее распространен в кишечнике, скелетных мышцах, нервной системе и глазах, за которым следуют плацента, печень и почка, тогда как THTR2 находится в основном в жировой ткани, печени, лимфоцитах, селезенке, желчном пузыре, плаценте. поджелудочной железе и мозге. После внутриклеточной транспортировки свободный тиамин быстро фосфорилируется до TPP с помощью тиаминпирофосфокиназы (TPK1). Вторая киназа, TDPK, добавляет фосфатную группу к TPP для генерирования тиаминтрифосфата (TTP). TPP и TTP могут быть дефосфорилированы, соответственно, до TMP и TPP с помощью фосфатаз — простатической кислой фосфатазы (ACPP) и THTPA соответственно.
До 90% от общего количества тиамина в организме остается в его дифосфате , метаболически активной форме (TPP), тогда как остальное находится в виде TMP и TTP. TPP является кофактором нескольких тиамин-зависимых ферментов, участвующих в метаболизме углеводов и жирных кислот, а именно цитозольной транскетолазы (TKT), пероксисомальной 2-гидроксиацил-CoA лиазы 1 и трех митохондриальных ферментов (пируватдегидрогеназы, α-кетоглутаратдегидрогеназы и разветвленных). -цепные α-кетокислотные дегидрогеназные комплексы. Биохимическая роль TPP хорошо понятна, но биологическая значимость и вклад TTP не совсем ясны. Ранее считалось, что это специфическая нейроактивная форма тиамина, но в последнее время сообщалось, что TTP (составляет ∼10% от общего пула тиамина мозга) участвует в возбудимости мембраны и нервной проводимости, действуя в качестве модулятора проницаемости хлоридно-натриевых каналов.
В цитозоле TPP действует как кофактор для TKT, ключевого фермента неокислительной ветви пентозофосфатного пути (PPP). Этот метаболический путь генерирует никотинамидадениндинуклеотидфосфат (NADPH) и рибозо-5-фосфат (R5P). NADPH является ключевым восстановителем в биосинтетических реакциях и является одним из субстратов биосинтетических ферментов (синтез жирных кислот) и антиоксидантных ферментов, таких как глутатионпероксидаза-редуктазная система и тиоредоксинпероксидазы.Важное участие R5P в биосинтезе ДНК и РНК подчеркивает критическую роль тиамина в высокопролиферирующих тканях.
Исходя из его роли в биохимических путях, предполагается , что дефицит тиамина приведет к усилению окислительного стресса и снижению пролиферации клеток, а также к снижению синтеза жирных кислот (включая миелин) с тяжелыми последствиями, особенно во время развития мозга. В соответствии с этим предположением, дефицит тиамина снижает активность TKT и приводит к нарушению PPP и снижению нейрогенеза в коре и гиппокампе во время развития нервной системы.
Пероксисомы играют важную роль в катаболизме перекиси водорода, а также в укорочении очень длинных жирных кислот (которые не могут подвергаться прямому катаболизму β-окисления митохондрий) и α-окислении. В последнем процессе TPP-зависимый фермент 2-гидроксиацил-СоА лиаза 1 (HACL1) катализирует расщепление 3-метилразветвленных и 2-гидрокси длинноцепочечных жирных кислот с прямой цепью. Фитановая кислота (3-метилзамещенная 20-углеродная жирная кислота с разветвленной цепью), в отличие от большинства жирных кислот, не может подвергаться β-окислению из-за наличия метильной группы в положении 3. Как таковой, он расщепляется HACL1 в результате первоначального α-окисления. Эта жирная кислота с разветвленной цепью получается из рациона, особенно из молочных продуктов и красного мяса. Нарушение катаболизма фитановой кислоты из-за неадекватных уровней TPP приводит к накоплению триглицеридов, что может вызывать негативные эффекты, такие как мозжечковая атаксия, периферическая полиневропатия, потеря зрения и слуха, аносмия, а в некоторых случаях дисфункция сердца и эпифизарная дисплазия. Симптомы, вызванные дефицитом тиамина, характерны для болезни Рефсума, которая вызвана патогенными мутациями в HACL1. Некоторые из симптомов также наблюдаются при аутосомно-рецессивном системном расстройстве, синдроме Зеллвегера и других пероксисомальных заболеваниях, включая неонатальную адренолейкодистрофию. Синдром Зеллвегера вызван патогенными мутациями в генах пексинов, которые кодируют белки, необходимые для сборки функциональных пероксисом. Он характеризуется дефицитом пути окисления пероксисомных жирных кислот, вызывающего тяжелую неврологическую и печеночную дисфункцию, а также черепно-лицевые нарушения.
Большая часть (∼90%) цитозольного TPP транспортируется в митохондрии с помощью митохондриального переносчика тиаминпирофосфата MTPPT, продукт гена SLC25A19. Этот транспортер обеспечивает обмен цитозольного TPP на митохондриальный TMP; Попав в цитозоль, TMP метаболизируется и превращается обратно в TPP. В митохондриях TPP является критическим кофактором для трех ферментов, а именно пируватдегидрогеназы, α-кетоглутаратдегидрогеназы и α-кетокислотной дегидрогеназы с разветвленной цепью (PDH, αKGDH и BCKDH, соответственно).
Пируватдегидрогеназный комплекс — мультисубъединичный комплекс катализирует TPP- зависимое декарбоксилирование пирувата, генерируя ацетил-КоА, который затем входит в цикл Кребса. Регуляция активности PDH представляет собой ключевой метаболический «переключатель», влияющий на выбор «топлива», то есть между окислением жирных кислот и гликолитическим потоком. Было высказано предположение, что неспособность регулировать выбор топлива для производства метаболической энергии лежит в основе «метаболической жесткости», приводящей к метаболическим нарушениям. Следовательно, опосредованное тиамином ингибирование комплекса PDH блокирует систему в окислении глюкозы в пируват, что приводит к увеличению лактата и снижению клеточной продукции АТФ. Как и ожидалось, в тяжелых случаях метаболический дефицит проявляется как фатальный лактоацидоз у новорожденных, тогда как в более легких случаях неврологические состояния могут приводить к структурным нарушениям в центральной нервной системе (ЦНС), судорогам, умственной отсталости и спастичности.
В случае дефицита тиамина наиболее пораженными участками мозга, по-видимому, являются мозжечок, мамиллярные тела, таламус, гипоталамус и ствол мозга у взрослых. Что касается дефицита тиамина, Zhao et al.(2009) показали, что у мышей депривация тиамина в течение 14 дней приводила к различной степени дефицита ферментов при тестировании на активность TKT, PDH и αKGDH в коре и гиппокампе.
Патогенные мутации в генах, кодирующих ферменты и транспортеры, участвующие в метаболизме тиамина, приводят к симптомам, сходным с теми, что обнаруживаются при дефиците тиамина на основе питания, и перекрываются с нарушениями митохондриальной дисфункции . Эти мутации, затрагивающие гены, ответственные за транспортеры тиамина 1 ( SLC19A2 ; OMIM 249270) и 2 ( SLC19A3 ; OMIM 607483), составляют основную причину субоптимального всасывания тиамина в кишечнике и, как следствие, недостаточного клеточного распределения тиамина по организму.
Как указано выше, патология дефицита тиамина влечет за собой нарушение выработки энергии из митохондрий в форме АТФ при использовании субстратов, генерирующих пируват (например, глюкозы), а также повышенный окислительный стресс. В этих условиях глюкоза черезгликолиз образует пируват, который не может войти в цикл Кребса в виде ацетил-КоА из-за низкой активности PDH. Как таковой, пируват трансаминируется в Ala или восстанавливается до лактата спомощью лактатдегидрогеназы. Это согласуется с повышенным уровнем лактата и органических кислот, наблюдаемых в CSF, моче и крови при дефиците тиамина.
Центральная нервная система человека обладает высокой потребностью в энергии: 2% массы тела контролируют около 20% общих метаболических расходов, большая часть которых расходуется на потенциалы возбуждающего действия, на передачу сигналов между нейронами, через химические синапсы, рост аксонов. и миелинизацию. Поскольку глюкоза является основным «топливом» для производства энергии в головном мозге, неудивительно, что митохондриальная дисфункция и последующее нарушение метаболизма глюкозы связаны с несколькими неврологическими расстройствами и нарушениями развития нервной системы и основными психическими заболеваниями, такими как депрессия и шизофрения.
Неврологические симптомы при дефиците тиамина сходны с дефектами, которые чаще всего проявляются как синдром Ли-Ли с вовлечением базальных ганглиев. Следовательно, нервная система, которая специализируется на использовании глюкозы для выработки энергии, кажется наиболее уязвимой для дефицита PDHC из-за истощения TPP. В мозге плохое производство АТФ в митохондриях будет ограничивать поддержание мембранного потенциала посредством действия Na + , K +-АТФазы, тем самым нарушая нервную проводимость и процессы в синапсах. Кроме того, повышенный окислительный стресс из-за более низкой активности TKT повредит критические биомолекулы, инициируя перекисное окисление липидов и окислительное повреждение белков, что приводит к фрагментации, посттрансляционным модификациям и перекрестным связям. Модификация эпитопов на нормальных, эндогенных молекулах может приводить к активации микроглии и иммунных клеток, усугубляя вызванное окислительным стрессом повреждение.
Уровни тиамина в крови и CSF предоставляют ограниченную информацию при оценке состояния тиамина у субъекта, поскольку они не обязательно отражают метаболическую функцию тиамина или прямую связь с его уровнями в тканях. Таким образом, оценки TKT эритроцитов и, если возможно, оценки других тканеспецифичных TPP-зависимых ферментов (PDH, αKGDH) считаются золотыми стандартами. Базовая активность TKT обычно выражается в единицах на грамм гемоглобина (г Hb), но, что более важно, рассчитывается процент активации TKT в добавках к TPP (0-15% считаются нормальными).
Коэффициент активации TKT (эритроциты) и / или активность TPP-зависимых ферментов (лейкоциты, фибробласты кожи и биопсия мышц) обычно сопровождаются тестированием уровней лактата и пирувата в сыворотке, BCAA, органических кислот, а также методами визуализации мозга. Единственными случаями, когда оценка свободного тиамина в плазме / сыворотке и CSF, по-видимому, является ценным диагностическим инструментом, являются случаи патогенных мутаций в SLC19A3. Точно так же экскреция тиамина с мочой также не является надежным методом для оценки его уровня в организме, поскольку он зависит от его потребления и всасывания. Как правило, он выражается в расчете на единицу креатинина для учета функции почек, и следует учитывать возраст, так как нормальные значения у детей различаются [120 нмоль / ммоль креатинина в возрасте 1–13 лет] и взрослые [220 нмоль / ммоль креатинина в возрасте> 18 лет ].
К сожалению, ранние симптомы дефицита тиамина не выражены или недостаточно различимы, чтобы поставить прямой диагноз. Они включают потерю аппетита, тошноту, слабость, апатию, усталость, раздражение, нарушения сна, анорексию и дискомфорт в животе. Кроме того, выявление конкретных клинических симптомов дефицита тиамина является проблематичным, поскольку оно скрывается за счет влияния других сопутствующих состояний (сопутствующих заболеваний), таких как инфекции и / или разнообразные нарушения питания.
Клиническая классификация дефицита тиамина обычно делится на «сухую» (или невритическую, характеризующуюся полиневропатией, сниженным коленным рефлексом и другими сухожильными рефлексами и прогрессирующей сильной слабостью мышц) и «влажную» (или сердечную, характеризующуюся отеком ног, тела и лица высокий сердечный выброс, желудочковая недостаточность и застой в легких).
При раннем подозрении на генерализованный дефицит тиамина рекомендуется незамедлительное введение тиамина и, как правило, эффективное лечение. В литературе сообщается о широком диапазоне терапевтических подходов и доз тиамина от 1,5 до 600 мг / день , с 10–20 мг / день в виде разделенных доз в течение нескольких недель от легкой полиневропатии и 20–30 мг / день. от умеренной до тяжелой, обычно до исчезновения симптомов. Как правило, дефицит тиамина купируеся с помощью доз 5–30 мг / сут внутривенно (в / в) или внутримышечно (в / м) три раза в день, затем 5–30 мг / сут перорально до исчезновения симптомов. Однако этот подход заметно менее эффективен для людей с хроническими формами нарушений, связанных с дефицитом тиамина, включая энцефалопатии или дефициты TPK1. В последнем случае стоило бы исследовать лечение непосредственно с помощью TPP; однако неясно, будет ли эта форма фосфорилированного тиамина преодолевать гематоэнцефалический барьер и / или достигать субклеточных мишеней, таких как PDH.
Ряд исследований показал обратную связь между уровнями тиамина и симптомами депрессии у взрослых. Исследование показало, что симптомы депрессии значительно улучшились у пациентов с большой депрессией после 6 недель приема тиамина по сравнению с плацебо. Эффекты от приема тиамина могут быть значительными в качестве паллиативного лечения при послеродовой депрессии и играть важную роль в последующем когнитивном развитии ребенка. PPD ассоциируется с повышенным риском развития неспособности к обучению, синдрома дефицита внимания / гиперактивности (ADHD) и тревожных расстройств у детей младшего возраста, что делает PPD критической проблемой как для матери, так и для младенца. Следовательно, добавки с тиамином могут в некоторой степени улучшить углеводный обмен, функцию митохондрий и выработку энергии в мозге.
Алкоголь и витамин B1
Последняя большая вспышка бери-бери была 65 лет назад на Филиппинах. Сейчас эту болезнь научились предупреждать, поэтому она не встречается даже в тех странах, где рис по прежнему остаётся главной едой. Однако своеобразный аналог этого недуга часто встречается даже в высокоразвитых странах. Называется он синдром Вернике-Корсакова – расстройство мозга из-за дефицита тиамина. У любителей спиртного, пьющих много и постоянно, дефицит витамина В₁ приводит к поражению нервов, начинают дрожать и плохо слушаться ноги, потом человек вообще перестаёт ходить. Дело в том, что при потреблении спиртного потребность в витамине В₁ существенно возрастает, а его поступление из-за плохого питания, типичного для алкоголиков, падает.
Похожая ситуация бывает и у сладкоежек. Большое количество углеводов в еде требует повышенного количества тиамина, но в сладком и в выпечке, которую обычно делают из рафинированной пшеничной муки, этого витамина нет. Он есть в оболочках зёрен, и если от них избавляются – витамин В₁ теряется. Поэтому выбирайте хлеб только из цельнозерновой муки, а каши – не шлифованные, сохранившие свои зерновые оболочки.
Пусть всегда будет солнце! Зачем нужен витамин D Подробнее
Прогноз и профилактические меры
Своевременное лечение гиповитаминозов позволяет рассчитывать на полное выздоровление пациента. Благоприятный прогноз формируется при умеренной витаминной недостаточности и нормализации рациона ребенка или взрослого. Тяжелые формы авитаминозов не всегда позволяют восстановить нормальную работу отдельных систем организма. Дефицит витаминов в запущенном виде может привести к летальному исходу.
Профилактика патологии основана на сбалансированной диете. Признаки авитаминоза не проявятся у детей и взрослых при систематическом употреблении достаточного количество овощей, фруктов, зелени. Осенью и зимой следует включать в рацион свежевыжатые соки, цитрусовые и квашеную капусту.
Симптомы дефицита
Поначалу никаких специфических симптомов нет. Слабость, быстрая утомляемость, одышка и сердцебиение при физнагрузке – всё это бывает и при массе других заболеваний. Как же определить, что вызвало подобные симптомы: недостаток витамина или что-то ещё? Во‑первых, подумайте, есть ли реальные причины таких проблем. Во‑вторых, проанализируйте своё питание – достаточно ли в нём продуктов с витамином В₁ (см. таблицу). Если причин нет, а состав продуктов неидеальный, скорее всего, дело в витамине.
Статья по теме
Лечим анемию. Чем опасен дефицит витамина В12
Лечение дефицита витаминов группы B
Выделяют два вида коррекции дефицита витаминов группы B: лечебную и профилактическую.
Лечебная тактика подразумевает применение высоких доз витаминов группы B длительными курсами. Коррекция проводится под строгим контролем врача при наличии клинических и лабораторных данных, подтверждающих витаминный дефицит. В настоящее время первичные алиментарные авитаминозы встречаются редко. В основном данная форма дефицита витаминов группы B развивается на фоне патологии желудочно-кишечного тракта или при наследственных нарушениях витаминного обмена. В этом случае прием пероральных форм препаратов не всегда оказывает ожидаемое лечебное воздействие, поэтому некоторым группам пациентов назначается инъекционное введение витаминных поли- или монопрепаратов.
Профилактическая тактика устранения дефицита витаминов группы B подразумевает прием препаратов в дозировке, близкой к суточной потребности. Такая терапия может назначаться и без доказанной витаминной недостаточности.
Медико-генетический проводит диагностику наследственных и приобретенных нарушений обмена витаминов, что позволяет подобрать тактику коррекции гипо- и авитаминозов.
Важно
Потребность в витамине В1 (мг) Детям
- до 12 мес. – от 0,3 до 0,5
- 1–3 года – 0,8
- 3–7 лет – 0,9
- 7–11 лет – 1,1
- 11–14 лет – 1,3
- 14–18 лет:
- мальчикам – 1,5,
- девочкам – 1,3
Взрослым
- Мужчинам и женщинам – 1,5
- Беременным – 1,7
- Кормящим матерям – 1,8
Где много тиамина
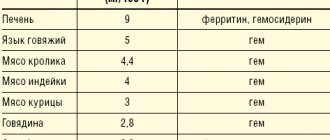
| Продукты | Содержание витамина B в 100 г | Процент ДНП для взрослых (1,5 мг/сутки) |
| Семечки подсолнечника. | 1,5–1,8 мг | 123% |
| Семена кунжута. | 1,27 мг | 85% |
| Свинина постная; качественные колбасы без добавок: браунгшвейская, сервелат; икра красная; арахис. | 0,5–0,55 мг | 35–37% |
| Овсяные каши: «Геркулес» и другие; фасоль; чечевица; орехи кешью и фундук. | 0,45–0,5 мг | 30–33% |
| Свинина жирная; гречка; пшено; мука пшеничная и ржаная низких сортов, обойная, цельнозерновая; орехи грецкие и кедровые. | 0,37–0,44 мг | 25–29% |
| Хлеб из цельнозерновой или обойной муки, со злаками; Бородинский из муки 1‑го сорта, но не высшего; зелёный горошек; качественные варёные колбасы без добавок: докторская, любительская, молочная, русская; печень говяжья; некоторые виды рыбы: горбуша, сёмга, кета; кальмары. | 0,16–0,35 мг | 11–25% |