Лекарства от аллергии: как это работает?
С началом цветения одними из самых актуальных сезонных лекарств становятся противоаллергические. Просмотрев рекламные ролики, многие пострадавшие мчатся в аптеку в полной уверенности, что популярное средство уж точно принесет им свободу от поллиноза. Однако на деле все не так просто: противоаллергические препараты бывают разными как по механизму действия, так и по времени наступления эффекта и его силе.
Неожиданная реакция
В норме мы дышим воздухом, насыщенным ароматами цветения ольхи, березы, ивы, клена и многих других деревьев и растений, наслаждаясь запахом весны и проснувшейся природы. Однако примерно у каждого пятого человека на земле проникающая в дыхательные пути пыльца вызывает сложный каскад патологической реакции.
Это происходит оттого, что организм аллергиков воспринимает вещество, входящее в состав пыльцы (антиген), как врага, которому немедленно объявляется жестокая война на поражение. На ее начальном этапе вырабатываются специальные антитела — иммуноглобулины класса Е. Они должны связаться с антигеном и обезвредить его. Но на самом деле антитела сначала прикрепляются к особым, тучным клеткам, которыми очень богата слизистая оболочка носовой полости и дыхательных путей.
Когда антигены пыльцы все-таки связываются с антителами, тучные клетки разрушаются и в окружающие ткани высвобождается их содержимое: гистамин и некоторые другие вещества. Именно они вызывают такие характерные симптомы аллергии, с которыми и призваны бороться противоаллергические препараты. Какими же путями они достигают желаемого эффекта?
Вариант первый: не оставить гистамину шансов
По этому принципу работают антигистаминные препараты. Они блокируют специальные Н1-гистаминовые рецепторы, с которыми связывается гистамин, и тем самым предотвращают его пагубное действие. Существует три поколения антигистаминных.
К первому поколению
относятся Диазолин, Тавегил, Супрастин, Фенкарол и многие другие. Их общая отличительная черта — седативное, т. е. успокоительное, действие. Препараты первого поколения, которые выпускаются в виде инъекций (Супрастин и Тавегил), оказываются незаменимыми в экстренных ситуациях, например, при отеке Квинке, поскольку начинают действовать намного быстрее, чем таблетки.
Более современные средства второго поколения
(Лоратадин, Семпрекс, Эбастин) в рекомендуемых дозировках хорошо переносятся, не вызывая седации, однако могут оказывать негативное влияние на сердечную мышцу1.
А наиболее хорошо переносимыми и мощными считаются антигистаминные третьего поколения
— Цетиризин, Левоцетиризин и Фексофенадин.
Принимая антигистаминные препараты, следует помнить, что они не позволяют связываться с рецепторами вновь выделяющимся порциям гистамина, в то время как высвободившееся до первого приема лекарств вещество уже давно с ними связалось и все еще может проявлять свою разрушительную силу. Именно поэтому значительное облегчение порой наступает через несколько дней постоянного приема препаратов, когда успевший наделать бед гистамин уже исчерпает свои возможности.
Выбор антигистаминного препарата: взгляд фармаколога
Для цитирования. Карева Е.Н. Выбор антигистаминного препарата: взгляд фармаколога // РМЖ. 2021. No 12. С. 811–816.
Антигистаминные препараты (АГП) являются препаратами первой линии терапии при большинстве аллергических заболеваний. Они относятся преимущественно к безрецептурным средствам, давно и прочно вошли в нашу практику и применяются уже на протяжении более полувека. Часто выбор этих препаратов осуществляется эмпирически или даже отдается на откуп пациентам, однако есть множество нюансов, определяющих, насколько эффективен будет тот или иной препарат для конкретного пациента, а значит, к выбору этих средств необходимо подходить не менее ответственно, чем, например, к выбору антибиотиков. Каждый специалист в своей клинической практике наверняка сталкивался с ситуациями, когда тот или иной препарат не оказывал должного клинического эффекта или же вызывал гиперергические реакции. От чего это зависит и как можно минимизировать риски? Вариативность ответа на лекарственное средство чаще всего связана с активностью ферментов метаболизма в печени у пациента, ситуация усугубляется в случае полипрагмазии (5 и более назначенных препаратов одновременно). Поэтому один из реальных путей снижения риска неадекватной реакции организма на препарат – выбор лекарственного средства, которое не метаболизируется в печени. Кроме того, выбирая АГП, важно оценить следующие параметры: сила и скорость наступления эффекта, возможность длительного применения, соотношение польза/риск (эффективность/безопасность), удобство применения, возможность применения при сопутствующей патологии в комбинации с другими препаратами у данного пациента, путь выведения, необходимость титрования дозы, цена. Для решения обозначенной задачи рассмотрим текущую информацию по гистамину и антигистаминным препаратам.
Гистамин и его роль в организме
Гистамин в организме человека осуществляет ряд физиологических функций, играет роль нейротрансмиттера и участвует во многих патобиологических процессах (рис. 1).
Основное депо гистамина в организме – тучные клетки и базофилы, где он находится в виде гранул в связанном состоянии. Наибольшее количество тучных клеток локализуется в коже, слизистых оболочках бронхов и кишечника. Гистамин реализует свою активность исключительно через собственные рецепторы. Современные представления о функциональной нагрузке рецепторов гистамина, их локализации и механизмах внутриклеточной сигнализации приведены в таблице 1.
Помимо физиологических функций, гистамин участвует в развитии воспалительного процесса любой природы. Гистамин вызывает зуд, чихание и стимулирует секрецию слизистой носа (ринорея), сокращение гладких мышц бронхов и кишечника, гиперемию тканей, дилатацию мелких кровеносных сосудов, повышение сосудистой проницаемости для воды, белков, нейтрофилов, образование воспалительного отека (заложенность носа). Не только при аллергических заболеваниях, но и при любых патологических процессах с выраженным воспалительным компонентом всегда повышен уровень гистамина в организме. Это показано при хронических инфекционно-воспалительных заболеваниях органов дыхательного и урогенитального трактов, острых респираторных вирусных инфекциях, гриппе [1–3]. При этом суточное количество гистамина в моче при гриппе примерно такое же, как и при обострении аллергических заболеваний. Следовательно, патогенетически обоснованным и клинически полезным шагом является снижение активности гистаминовой системы в условиях ее повышенной активности. Принципиально подавить гистаминергическую активность организма можно либо через уменьшение количества свободного гистамина (торможение синтеза, активация метаболизма, торможение высвобождения из депо), либо через блокаду сигналов гистаминовых рецепторов. В клинической практике нашли применение препараты, стабилизирующие мембраны тучных клеток, тем самым предотвращающие выделение гистамина. Однако наступления желаемого действия при их использовании приходится долго ждать, и терапевтическая эффективность данной группы лекарств весьма умеренная, поэтому они применяются исключительно с профилактической целью. Быстрый и выраженный эффект достигается при использовании антигистаминных препаратов.
Классификация антигистаминных препаратов
Согласно классификации, принятой Европейской академией аллергологов и клинических иммунологов, все антигистаминные препараты подразделяются на 2 поколения в зависимости от их влияния на ЦНС.
Антигистаминные препараты I поколения
H1-антагонисты первого поколения проникают через гематоэнцефалический барьер (ГЭБ) и могут как стимулировать, так и подавлять работу ЦНС (рис. 2). Как правило, у большинства пациентов происходит второе. Седативное действие при приеме АГП I поколения субъективно отмечают 40–80% больных. Отсутствие седативного действия у отдельных пациентов не исключает объективного отрицательного влияния этих средств на когнитивные функции, на которые пациенты могут не обратить внимания (способность к управлению автомобилем, обучению и др.). Нарушение функции ЦНС наблюдается даже при использовании минимальных доз этих средств. Влияние АГП I поколения на ЦНС такое же, как при использовании алкоголя и седативных препаратов. Стимуляция отмечается у некоторых пациентов, получавших обычные дозы АГП, и проявляется беспокойством, нервозностью и бессонницей. Обычно центральное возбуждение характерно для передозировки АГП I поколения, оно может приводить к судорогам, особенно у детей.
При приеме АГП I поколения, помимо седативного эффекта и влияния на когнитивные функции, наблюдаются: • кратковременный эффект (вынужденный прием 3–4 раза в сутки); • быстрое развитие тахифилаксии (необходимо менять препарат через каждые 7–10 дней); • низкая избирательность действия: помимо гистаминовых Н1-рецепторов, они блокируют рецепторы ацетилхолина, адреналина, серотонина, дофамина и ионные каналы, вызывая множество побочных эффектов: тахикардию, сухость слизистых оболочек, повышение вязкости мокроты. Они могут способствовать повышению внутриглазного давления, нарушать мочеиспускание, вызывать боли в желудке, запоры, тошноту, рвоту, увеличивать массу тела [4, 5]. Именно поэтому указанные препараты имеют ряд серьезных ограничений к применению среди пациентов с глаукомой, доброкачественной гиперплазией предстательной железы, сердечно-сосудистой патологией и т. д. При остром отравлении АГП I поколения их центральные эффекты представляют наибольшую опасность: больной испытывает возбуждение, галлюцинации, атаксию, нарушение координации, судороги и др. Фиксированные, расширенные зрачки на раскрасневшемся лице, вместе с синусовой тахикардией, задержкой мочи, сухостью во рту и лихорадкой весьма похожи на признаки отравления атропином. У детей при передозировке АГП I поколения могут возникать возбуждение и судороги, поэтому специалисты во многих странах призывают отказаться в лечении детей от этой группы препаратов или применять их под строгим контролем. К тому же седативный эффект может ухудшить обучение и успеваемость детей в школе.
Антигистаминные препараты II поколения
Новые АГП (II поколения) не проникают через ГЭБ, не оказывают седативного действия (рис. 2). Отметим: препараты III поколения пока не разработаны. Некоторые фармацевтические компании представляют новые препараты, появившиеся на фармацевтическом рынке, как АГП III – новейшего – поколения. К III поколению пытались отнести метаболиты и стереоизомеры современных АГП. Однако в настоящее время считается, что данные препараты относятся к АГП II поколения, поскольку между ними существенной разницы нет. Согласно Консенсусу по антигистаминным препаратам название «третье поколение» решено зарезервировать для обозначения синтезируемых в будущем АГП, которые по ряду основных характеристик будут отличаться от известных соединений. В отличие от старых препаратов, АГП II поколения практически не проникают через ГЭБ и не вызывают седативного эффекта, поэтому их можно рекомендовать водителям, людям, работа которых требует концентрации внимания, школьникам и студентам. Здесь применен термин «практически», т. к. в очень редких случаях и при приеме препаратов II поколения возможны случаи седации, но это скорее исключение из правила и зависит от индивидуальных особенностей пациента. АГП II поколения способны селективно блокировать H1-рецепторы, быстро оказывать клинический эффект с длительным действием (на протяжении 24 ч), как правило, не вызывают привыкания (нет тахифилаксии). В связи с их более высоким профилем безопасности они предпочтительны для пожилых пациентов (старше 65 лет).
Антигистаминные препараты II поколения
Особенности фармакокинетикиМетаболизм АГП II поколения
Все АГП II поколения разделяют на 2 большие группы, в зависимости от необходимости метаболической активации в печени (рис. 3).
Необходимость метаболической активации в печени сопряжена с рядом проблем, главными из которых являются опасность лекарственного взаимодействия и позднее наступление максимального терапевтического эффекта препарата. Одновременное применение двух и более препаратов, которые метаболизируются в печени, может привести к изменению концентрации каждого из лекарств. В случае параллельного применения индуктора ферментов лекарственного метаболизма (барбитураты, этанол, трава зверобоя и пр.) скорость метаболизма антигистамина увеличивается, концентрация снижается и эффект не достигается или слабо выражен. При одновременном использовании ингибиторов ферментов печени (противогрибковые азолы, грейпфрутовый сок и др.) скорость метаболизма АГП замедляется, что вызывает повышение кон в крови и увеличение частоты и выраженности побочных эффектов. Самым удачным вариантом АГП являются препараты, не метаболизируемые в печени, эффективность которых не зависит от сопутствующей терапии, а максимальная концентрация достигается в кратчайшие сроки, что обеспечивает быстрое начало действия. Примером такого АГП II поколения является препарат цетиризин.
Скорость наступления эффекта АГП II поколения
Одним из важнейших аспектов действия препарата является скорость наступления эффекта. Среди АГП II поколения самый короткий период достижения С max отмечен у цетиризина и левоцетиризина. Следует отметить, что антигистаминное действие начинает развиваться значительно раньше и является минимальным у препаратов, не требующих предварительной активации в печени, например у цетиризина – уже через 20 мин (табл. 2).
Распределение АГП II поколения
Следующей важнейшей характеристикой лекарственного средства является объем распределения. Этот показатель свидетельствует о преимущественной локализации препарата: в плазме, межклеточном пространстве или внутри клеток. Чем этот показатель выше, тем больше препарата поступает в ткани и внутрь клеток. Малый объем распределения свидетельствует о том, что препарат преимущественно находится в сосудистом русле (рис. 4). Для АГП локализация в кровотоке является оптимальной потому, что здесь представлены основные его клетки-мишени (иммунокомпетентные клетки крови и эндотелий сосудов).
Значения объема распределения (литр/кг) у АГП II поколения по возрастающей следующие: цетиризин (0,5) < фексофенадин (5,4–5,8) < дезлоратадин (49) < эбастин (100) < лоратадин (119) (рис. 5). Малый объем распределения обеспечивает: а) высокие концентрации данного АГП на поверхности клеток-мишеней, следовательно, точно направленное действие и высокую терапевтическую эффективность; б) отсутствие накопления в паренхиматозных органах и безопасность применения.
Особенности фармакодинамики
Фармакологические эффекты АГП опосредованы гистаминовыми рецепторами, селективность в отношении разных подтипов, сила и длительность связывания с которыми варьируют у разных препаратов. Отличительной характеристикой АГП II поколения цетиризина является его высокий аффинитет – способность надолго связывать гистаминовые Н1-рецепторы: их занятость через 4 ч после приема препарата составляет 90%, через 24 ч – 57%, что превышает аналогичные показатели других АГП. Важнейшим свойством антигистаминных препаратов является их способность снижать экспрессию гистаминовых Н1-рецепторов, тем самым уменьшать чувствительность тканей к гистамину [8, 9]. По силе антигистаминного действия АГП II поколения можно расположить в следующем порядке: цетиризин >> эбастин > фексофенадин >> лоратадин (рис. 6) [10].
Противоаллергический эффект отдельных АГП (цетиризин) включает так называемое дополнительное, вне-Н1-рецепторное действие, в совокупности с которым реализуется противовоспалительное действие препарата. Побочные эффекты АГП
Побочные эффекты АГП включают холинолитические эффекты (сухость во рту, синусовая тахикардия, запор, задержка мочи, нарушение зрения), адренолитическое (гипотензия, рефлекторная тахикардия, тревожность), антисеротониновое (повышение аппетита), центральное антигистаминное действие (седация, повышение аппетита), блокада калиевых каналов в сердце (желудочковая аритмия, удлинение QT) [11]. Избирательность действия препаратов на целевые рецепторы и способность проникать или не проникать через ГЭБ определяют их эффективность и безопасность [12]. Среди АГП II поколения наименьшим сродством к М-холинорецепторам, а значит, практически полным отсутствием холинолитического действия, обладают препараты цетиризин и левоцетиризин (табл. 3) [13].
Некоторые АГП могут вызывать развитие ари являются терфенадин и астемизол. Из-за способности вызывать потенциально фатальную аритмию – трепетание-мерцание (нарушение метаболизма при болезни печени или на фоне ингибиторов CYP3A4) терфенадин и астемизол запрещены к применению с 1998 и 1999 гг. соответственно. Среди существующих в настоящее время АГП эбастин и рупатадин обладают кардиотоксичностью, и их не рекомендуется применять лицам с удлиненным интервалом QT, а также с гипокалиемией. Кардиотоксичность повышается при одновременном их приеме с препаратами, удлиняющими интервал QT, – макролидами, противогрибковыми средствами, блокаторами кальциевых каналов, антидепрессантами, фторхинолонами.
Цетиризин
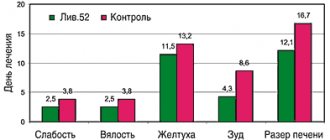
Особое место среди препаратов II поколения занимает цетиризин. Наряду со всеми преимуществами неседативных антигистаминов, цетиризин демонстрирует свойства, выделяющие его из ряда препаратов нового поколения и обеспечивающие его высокую клиническую эффективность и безопасность [5, 14]. В частности, он обладает дополнительной противоаллергической активностью, быстрой скоростью наступления эффекта, у него отсутствует опасность взаимодействия с другими лекарственными веществами и продуктами питания, что открывает возможность безопасного назначения препарата пациентам при наличии сопутствующих заболеваний. Эффект действия цетиризина складывается из влияния на обе фазы аллергического воспаления. Противоаллергический эффект включает так называемое вне-Н1-рецепторное действие: торможение высвобождения лейкотриенов, простагландинов в слизистой оболочке носа, коже, бронхах, стабилизацию мембран тучных клеток, торможение миграции эозинофилов и агрегацию тромбоцитов, подавление экспрессии ICAM-1 клетками эпителия [7, 15]. Многие авторы, как зарубежные, так и отечественные, считают цетиризин эталоном современного АГП. Он является одним из наиболее изученных АГП, доказавшим свою эффективность и безопасность во множестве клинических исследований. Для пациентов, которые плохо отвечают на другие АГП, рекомендуется именно цетиризин [16]. Цетиризин полностью соответствует требованиям, предъявляемым к современным АГП [17]. Для цетиризина характерны время полувыведения 7–11 ч, длительность эффекта – 24 ч, после курсового лечения эффект сохраняется до 3-х суток, при длительном применении – до 110 нед., не наблюдается привыкания. Длительность эффекта цетиризина (24 ч) объясняется тем, что эффект АГП определяется не только концентрацией в плазме, но и степенью связывания с белками плазмы крови и с рецепторами. Цетиризин практически не метаболизируется в печени и выводится преимущественно почками, поэтому может применяться даже у пациентов с нарушениями функции печени. А вот для больных с почечной недостаточностью требуется коррекция дозы препарата.
Цетрин – эффективный качественныйдженерик цетиризина по доступной цене
В настоящее время из препаратов цетиризина, помимо оригинального (Зиртек), зарегистрировано 13 генерических препаратов (дженериков) разных производителей [18]. Актуальным является вопрос о взаимозаменяемости дженериков цетиризина, их терапевтической эквивалентности оригинальному препарату и выборе оптимального средства для лечения аллергических заболеваний. Стабильность лечебного эффекта и терапевтическая активность воспроизведенного препарата определяются особенностями технологии, качеством активных субстанций и спектром вспомогательных веществ. Качество субстанций препаратов разных производителей может существенно отличаться. Любое изменение в составе вспомогательных веществ может сопровождаться фармакокинетическими отклонениями (снижением биодоступности и возникновением побочных эффектов) [18]. Дженерик должен быть безопасным в применении и эквивалентным оригинальному препарату. Два лекарственных препарата считают биоэквивалентными (фармакокинетически эквивалентными), если они после введения одним путем (например, внутрь) в одинаковой дозе и схеме имеют одинаковую биодоступность (доля лекарственного средства, попавшего в кровоток), время достижения максимальной концентрации и уровень этой концентрации в крови, время полувыведения и площадь под кривой «время-концентрация». Перечисленные свойства необходимы для проявления должной эффективности и безопасности препарата. Согласно рекомендациям Всемирной организации здравоохранения, биоэквивалентность дженерика следует определять по отношению к официально зарегистрированному оригинальному лекарственному препарату. Исследование биоэквивалентности стало обязательным при регистрации препаратов с 2010 г. FDA (Food and Drug Administration – Управление по контролю качества пищевых продуктов и лекарственных препаратов, США) ежегодно издает и публикует «Оранжевую книгу» с перечнем препаратов (и их производителей), которые считаются терапевтически эквивалентными оригинальным. Кроме того, важно обращать внимание на соблюдение международных стандартов производства (GMP) при изготовлении препаратов. К сожалению, пока не все производители (особенно отечественные) имеют производство, соответствующее требованиям GMP, а это может сказаться на качестве препаратов, а значит, на эффективности и безопасности дженериков. Таким образом, при выборе дженериков существует ряд надежных ориентиров: авторитет фирмы-производителя, соблюдение GMP, включение в «Оранжевую книгу» FDA [19]. Всем перечисленным критериям полностью соответствует препарат Цетрин компании Dr. Reddy’s Laboratories Ltd. Цетрин выпускается международной фармацевтической компанией, производственные площадки которой сертифицированы по GMP. Он биоэквивалентен оригинальному препарату [20], включен в «Оранжевую книгу» FDA как препарат с доказанной терапевтической эквивалентностью. Кроме того, Цетрин имеет длительный успешный опыт применения на территории России и большую собственную доказательную базу. В сравнительном исследовании терапевтической эффективности и фармакоэкономики препаратов цетиризина разных производителей в лечении хронической крапивницы показано, что наибольшее количество пациентов, достигших ремиссии, было в группах, получавших Зиртек и Цетрин, при этом лучшие результаты с точки зрения экономической эффективности продемонстрировала терапия Цетрином [21, 22]. Длительная история использования Цетрина в условиях отечественной клинической практики доказала его высокую терапевтическую эффективность и безопасность. Цетрин – препарат, обеспечивающий практическую потребность клинической медицины в эффективном и безопасном противогистаминном лекарственном средстве, доступном широкому кругу пациентов.
Кромоглициевая кислота — «нескорая» противоаллергическая помощь
Кромоглициевая кислота и ее производные стабилизируют мембраны тучных клеток, препятствуя открытию кальциевых каналов и выходу кальция в тучные клетки. Благодаря этому угнетается дегрануляция тучных клеток, что предотвращает выход из них гистамина, лейкотриенов и других биологически активных веществ-медиаторов аллергического воспаления.
Важный аспект, который касается всех кромогликатов, — медленное наступление клинического эффекта. В связи с этим их целесообразней использовать для профилактики поллиноза, а не для его лечения.
При аллергических реакциях применяются препараты кромоглициевой кислоты в форме назального спрея и глазных капель.
Кромогликаты, как, впрочем, и другие препараты от аллергии нового поколения, имеют мощную доказательную базу, подтверждающую их эффективность и высокий профиль безопасности [5].
Большинство ЛС кромоглициевой кислоты относится к группе ОТС. Но есть и исключения. Так, по рецепту врача отпускаются некоторые глазные капли, поэтому, предлагая покупателю ТН, важно изучить инструкцию и уточнить, к какой группе принадлежит конкретный препарат.
Назальный спрей
можно рекомендовать для лечения и профилактики поллиноза взрослым и детям старше 5 лет. Терапевтический эффект развивается спустя несколько дней или даже недель постоянного применения ЛС. В среднем курс лечения длится 4 недели, причем отмену препарата нужно проводить постепенно, на протяжении еще 7 дней [2].
Капли глазные
, как и назальный спрей, проявляют заметный терапевтический эффект только спустя несколько дней после начала применения. Назначают для облегчения симптомов аллергического конъюнктивита у взрослых и детей старше 4 лет.
О чем предупредить клиента?
После того как будет достигнут лечебный эффект, можно уменьшить дозу и назального спрея, и капель в нос, используя их только при контакте с аллергенами, например, пыльцой растений. Не забудьте рассказать о необходимости медленной отмены препаратов кромоглициевой кислоты.
«
Активные метаболиты препаратов 2 поколения
Существуют абсолютно современные разработки, которые практически лишены недостатков лекарств от аллергии предыдущих поколений. Они не влияют на сердце и центральную нервную систему, не подавляют психические реакции, не приводят к привыканию.
К этим препаратам можно отнести фексофенадин и дезлоратадин. Первый показан при сезонном аллергическом рините и при хронической крапивнице, препятствует выбросу гистамина и развитию реакций на аллерген. При этом действие начинается примерно через 1 час после приема дозы, и длится до суток. Второй препарат назначается при аллергическом насморке, крапивнице. Он блокирует выброс биологически-активных факторов аллергии и предупреждает симптомы заболевания. Снимает спазм, уменьшает отеки и зуд, нормализует проницаемость капилляров. Эффект появляется относительно быстро, примерно в течение 30 минут после приема дозы и продолжается до 24 часов.
Аллергия готовься!
Для начала выясним, что способствует развитию аллергической реакции. От чего у нас могут появится внезапный кожный зуд, отек слизистой дыхательных путей, боли в животе и прочие проявления острой аллергии? Виной тому — выброс гистамина, медиатора, который выделяется в ответ на попадание аллергена.
Поэтому в борьбе с проявлениями аллергии важное место занимает прием препаратов, блокирующих рецепторы гистамина, снижающих его влияние на организм. Они называются антигистаминными. Существует два поколения антигистаминных лекарственных препаратов.1, 2 Рассмотрим их подробнее.
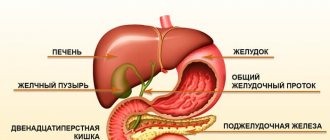
Антигистамины и желудок
Сам по себе гистамин активизирует выработку желудочного сока. Поэтому есть мнение, будто его блокировка угнетает секрецию. Это не совсем так. Для устранения симптомов аллергической реакции используются H1-блокаторы. Выработку желудочного сока могут уменьшить H2-блокаторы:
- Циметидин;
- Ранитидин;
- Фамотидин;
- Роксатидин.
Это другая группа антигистаминных препаратов, используемых для лечения гастрита, язвенной болезни желудка, рефлюкс-эзофагита. Аллергики ими не пользуются. Поэтому нарушить пищеварение в попытке борьбы с крапивницей или конъюнктивитом риска нет.