Острый диссеминированный энцефаломиелит
Острый диссеминированный энцефаломиелит (ОДЭМ) — воспалительное демиелинизирующее заболевание ЦНС, развивающееся остро или подостро в тесной временной связи с инфекционным заболеванием или вакцинацией. Неврологическая картина ОДЭМ обычно отражает многоочаговое, но монофазное поражение нервной системы с полным или выраженным клиническим выздоровлением в большинстве случаев (4, 6, 11, 12, 14, 15).
История изучения ОДЭМ. Впервые клиническую картину заболевания описал J. Lucas в XVIII столетии. В то время ОДЭМ был ассоциирован с корью, натуральной и ветряной оспой и сопровождался высокой смертностью. В 1920–1930 гг. были проведены первые эксперименты по созданию модели воспалительной демиелинизации на животных. Обезъяны иннокулировались экстрактом мозга, и у них развивались слабость и атаксия, при этом гистологически отмечались периваскулярное воспаление и демиелинизация. Сходство экспериментального и поствакцинального ОДЭМ было очевидным.
В 1931 г. D. McAlpine выделил три варианта ОДЭМ: постинфекционный, поствакцинальный и спонтанный (спорадический).
Постинфекционный ОДЭМ, как правило, связан с предшествующей или сопутствующей инфекцией, обычно вирусной и неспецифической инфекцией верхнего дыхательного тракта. Полный список признанных причин ОДЭМ представлен в табл. 1.
Пациенты могут заболевать в любом возрасте, но наиболее подвержены ОДЭМ дети и подростки. Истинная частота ОДЭМ не известна. Частота посткоревой и постветряночной ОДЭМ оценивается как 1:1000 случаев [7].
Поствакцинальный ОДЭМ. Поствакцинальный ОДЭМ составляет 5% всех случаев ОДЭМ. После широкого введения в 1853 г. противооспенной вакцины E. Jenner и в 1885 г. антирабической вакцины L. Paster у вакцинированных индивидуумов были о. «Инокулум» Пастера вызывал «нейропаралитический случай» ОДЭМ примерно у 1 на 1000 человек. Первоначально считали, что неврологические симптомы обусловлены вирусным компонентом вакцины, хотя впоследствии было признано, что это результат присутствия ткани ЦНС, «загрязняющей» вакцину. Эта гипотеза подтверждена снижением встречаемости поствакцинального ОДЭМ в настоящее время, когда большинство вакцин больше не готовятся из инфицированной in vivo ткани ЦНС [9, 10].
Частота ОДЭМ составляет 1–2 случая на 1 млн человек при вакцинации живой коревой вакциной. Наиболее часто ассоциированными с поствакцинальным ОДЭМ являются противокоревая, паротитная и краснушная вакцины.
Патогенез ОДЭМ. По патогенезу и клинической картине ОДЭМ близок к рассеянному склерозу (РС). Наиболее признанные теории основываются на концепции, что патологоанатомические данные при ОДЭМ аналогичны тем, что получены при экспериментальном аллергическом энцефаломиелите (ЭАЭ): агент поражает миелин, активируя сегрегированные антигены, в ответ на это запускается иммунная реакция [2, 8, 13, 16].
Для развития ОДЭМ достаточно воздействия любой системной инфекции. Инициирование постинфекционного ОДЭМ обусловлено скорее всего молекулярной мимикрией между вирусом и миелиновыми антигенами. В случае поствакцинального ОДЭМ основной причиной развития заболевания является направленная иммунная реактивность к основному белку миелина (ОБМ).
В настоящее время допускается, что первичная системная активация Т-клеток монофазна и уменьшается при исчезновении провоцирующих факторов, например, инфекции.
Гистологические изменения при ОДЭМ имеют форму периваскулярной демиелинизации и отека, в то время как аксоны относительно не поражены. Поражение миелина выражается в его набухании, распаде и исчезновении из-за поглощения продуктов распада миелина фагоцитами. Осевые цилиндры страдают меньше. Как правило, в них отмечаются набухание, реже фрагментация. В более поздней стадии заболевания поражение заменяется глиозом.
Патоморфологические данные коррелируют с длительностью заболевания и показывают эволюцию от диффузного вовлечения сосудов к распространенной демиелинизации.
Клиническая картина. Факт перенесенного вирусного заболевания или вакцинации чаще находится в пределах 1-го месяца, предшествующего появлению неврологических симптомов. При изучении ОДЭМ у детей документированное подтверждение продромального вирусного заболевания или вакцинации встречалось в 75% случаев. Время появления первых симптомов варьируется в зависимости от этиологии. Обычно заболевание возникает от 1 до 14 дней после вакцинации, неделю или меньше после появления сыпи при экзантемных заболеваниях и 1–3 недели (или более) после инокуляции антирабической вакцины.
Отмечена зависимость клинического фенотипа ОДЭМ от предшествующего заболевания. Описано несколько вариантов фенотипа ОДЭМ: посткоревой ОДЭМ чаще имеет тяжелое клиническое течение, в то время как ОДЭМ, обусловленный ветряной оспой, имеет благоприятный прогноз. Своеобразный фенотип ОДЭМ у детей был представлен при гемолитической стрептококковой инфекции группы Аb [3]. У 10 детей в возрасте от 3 до 14 лет развились типичные клинические проявления ОДЭМ, но с выраженными симптомами экстрапирамидного синдрома (70%), нарушением поведения и речи (50%). При этом «синдром ОДЭМ», как правило, следовал за острым фарингитом, клинически отличался от ревматической хореи, и в сыворотке крови больных отмечался высокий уровень антител к базальным ядрам. Начало ОДЭМ может быть острым (90–95%): «взрывное» начало и прогрессирование неврологических симптомов в течение нескольких часов до пика в днях и подострым (5–10%): с незаметным началом, медленным прогрессированием и максимальным неврологическим дефицитом до 30 дня с момента заболевания.
Независимо от остроты начала заболевания и этиологической причины ОДЭМ клинически проявляется полисимптомно. При остром начале заболевания характерными являются одновременные появления инфекционных, общемозговых симптомов в сочетании с очаговыми: симптомы поражения ствола головного мозга, мозжечка, спинного мозга.
Дебютные симптомы ОДЭМ часто включают лихорадку, головную боль, рвоту. Судороги и менингеальные симптомы не характерны, но если наблюдаются, то при постинфекционных ОДЭМ чаще, чем после поствакцинальных.
Неврологические симптомы в основном многоочаговые, гетерогенные (зависят от места и выраженности воспалительного демиелинизирующего процесса в ЦНС) и включают изменение уровня сознания, пирамидные нарушения (монопарез, гемипарез), атаксию и симптомы поражения ствола головного мозга, черепных нервов (ЧН), в том числе и двусторонний оптический неврит.
В клинической картине ОДЭМ существенное место занимают симптомы поражения корешков и периферических нервов: боли, расстройства чувствительности в стопах и кистях, снижение сухожильных и надкостничных рефлексов, мышечная гипотрофия.
Изолированный поперечный миелит обычно рассматривается как самостоятельная нозологическая единица, но в четверти всех случаев может представлять клиническое проявление ОДЭМ.
В наших исследованиях (обследовано 50 детей в возрасте 8 мес –14 лет, средний возраст больных — 6,43 ± 0,59 года) инфекционный продром встречался в 50% случаев ОДЭМ и включал симптомы интоксикации (сонливость, общую слабость, анорексию), изменение температуры тела, респираторный синдром (кашель, фарингит, ринит). Температура тела была повышена до высоких цифр в 23 случаях (47%), в 2 (3%) — до субфебрильных цифр. В 1/2 всех случаев ОДЭМ (25 пациентов — 50%) температура тела не изменялась.
Из общемозговых симптомов отмечались: головная боль у 15 детей (30%), рвота — у 11 (22%), нарушение сознания — у 5 (10%), генерализованные судороги — у 3 (12%). Дыхательная недостаточность, потребовавшая проведения искусственной вентитяции легких (ИВЛ), вследствие угнетения сознания и цервикального миелита появилась у 2 пациентов (4%). Симптомы раздражения мозговых оболочек — у 7 пациентов (14%).
В 71% случаев наблюдались спастические парезы и параличи, при этом в виде асимметричного тетрапареза — у 24 детей (48%), нижнего парапареза — у 8 (16%), гемипареза — у 4 пациентов (8%) и у 2 пациентов (4%) — монопареза. В 20 случаях (40%) отмечалось сочетанное поражение центрального и периферического двигательного нейрона (смешанные парезы и параличи). Полиневритический синдром отмечен в 20 (40%) случаях.
Черепные нейропатии проявлялись в виде симметричного двустороннего оптического неврита (ОН) у 15 пациентов (30%), симптомов поражения III ЧН (расходящееся косоглазие, птоз) — у 12 (24%), V ЧН (нарушение чувствительности на лице) — у 5 (10%), VI ЧН (сходящееся косоглазие) — у 3 (6%), VII ЧН (периферический парез мимических мышц) — у 24 (48%), VIII ЧН (системное головокружение, рвота, вестибулярный нистагм) — у 4 (8%), IX, X, XII ЧН (бульбарный синдром) — у 23 (46%).
Снижение зрения отмечалось у 16 пациентов (32%), все они отвечали критериям двустороннего ОН. У детей с ОН ухудшение остроты зрения часто было тяжелым вплоть до стойкого амавроза.
Мозжечковые симптомы в виде атаксии, диффузной мышечной гипотонии, координаторной дисметрии отмечались у 38 пациентов (76%).
Редкими клиническими симптомами явились мышечная ригидность — «симптом зубчатого колеса» — у 1 пациента (2%), гиперкинезы: тремор покоя — у 1 (2%), атетоз — у 1 (2%) и миоклонии — у 3 (6%)).
Нарушения чувствительности в начале заболевания характеризовались болями, парестезиями у 10 пациентов (20%), снижением или потерей чувствительности у 22 детей (44%), из них у 4 (8%) — по проводниковому типу, у 12 (24%) — по полиневритическому типу, у 6 (12%) — по сегментарно- корешковому типу и ни в одном случае не выявлена моноанестезия.
У 12 больных (24%) при ОДЭМ наблюдалось нарушение функции тазовых органов, из них у 8 (16%) — по центральному типу (задержка мочи или императивные позывы на мочеиспускание и дефекацию), у 4 (8%) — по периферическому типу (недержание мочи и кала).
Нарушения высших психических функций (ВПФ) в остром периоде ОДЭМ проявлялись нарушениями в эмоционально-волевой сфере (12–24%) и когнитивными расстройствами (8–16%). Парциальные эпилептические приступы в острой фазе заболевания отмечены у 3 больных (6%), в последующем пациенты имели симптоматическую парциальную эпилепсию.
Таким образом, клиническая картина при ОДЭМ в связи с выраженной диссеминацией патологического процесса полиморфна. Могут поражаться все отделы ЦНС и ПНС (периферической нервной системы), при этом в одних случаях преобладают полушарные, а в других — симптомы поражения ствола мозга или спинного мозга.
Мультифазный диссеминированный энцефаломиелит (МДЭМ). Хотя ОДЭМ обычно имеет монофазное течение без клинических рецидивов или новых субклинических повреждений в дальнейшем, однако в медицинской литературе имеются сообщения о повторных случаях заболевания и рецидивирующем ОДЭМ. Рецидивирующие эпизоды, как предполагается, происходят в период нескольких месяцев и обычно с аналогичными клинико-лабораторно-рентгенологическими характеристиками. Терминология в настоящее время уточняется. Ранее применяли термин «рецидивирующий ОДЭМ». Недавно был предложен термин «двухфазный диссеминированный ЭМ».
Клиническое течение ОДЭМ: для ОДЭМ характерно отсутствие новых обострений, за исключением редких рецидивирующих форм. После острой стадии заболевания почти всегда наступает быстрое улучшение без последующих рецидивов, иногда со стойким неврологическим дефектом.
В наших исследованиях в подавляющем большинстве случаев ОДЭМ был монофазным (90%), в относительно редких случаях ОДЭМ рецидивировал. За период наблюдения рецидив имели 5 пациентов (10%). Количество рецидивов (относительно всей группы) в среднем составило 0,16 ± 0,08. Период до второго рецидива составил в среднем 29,29 ± 15,24 дня. Рецидивы происходили на фоне повторного заболевания ОРВИ (3 случая), перенесенной черепно-мозговой травмы (ЧМТ) (сотрясение головного мозга) и на фоне резкого снижения гормональной терапии (1 больной). В одном случае обострение было моносимптомным (резкое снижение остроты зрения до амавроза) и в 4 случаях полисимптомным (атаксия, нистагм, интенционный тремор, гемипарез) и по длительности были относительно короткими (10,5 ± 2,02 дня). В последующем за время наблюдения (в среднем в течение 450,0 ± 270,0 дней) рецидивов больше не отмечалось ни у одного ребенка.
Длительность наблюдения за детьми, перенесшими ОДЭМ, составила в среднем 26,81 ± 3,94 мес. 33 пациента (66%) выздоровели полностью; у 5 детей (10%) были легкие двигательные нарушения, которые можно было выявить только при детальном неврологическом обследовании; у 2 (4%) были нарушения в поведении и расходящееся косоглазие; у 3 детей (6%) отмечалась умеренно выраженная слабость и атаксия; у 5 (10%) — тетрапарез и атаксия, ходьба была возможна только при поддержке; 2 ребенка (4%) имели грубые двигательные нарушения (тетраплегию).
Диагностика. Диагноз ОДЭМ и МДЭМ часто ставится по типичной клинической картине, к сожалению, нет патогномоничных маркеров.
Анализ спинномозговой жидкости (ЦСЖ) в 25% случаев выявляет повышение внутричерепного давления и плеоцитарный цитоз с лимфоцитами, нейтрофилами, значительным числом эритроцитов, отражающих микрогеморрагический процесс, но в 75% случаев может быть без изменений. Олигоклональный IgG в ЦСЖ у детей с ОДЭМ встречается реже, чем при РС. Частота обнаружения олигоклональных IgG при ОДЭМ составляет от 3% до 29% случаев.
Нейровизуализация. Многоочаговое поражение на МРТ головного мозга аналогично тому, что наблюдается при РС. Но имеются некоторые различия, помогающие отличить РС от ОДЭМ:
- поражения при ОДЭМ имеют тенденцию занимать большую площадь и располагаться асимметрично в церебральном и церебеллярном белом веществе и в базальных ганглиях. По результатам наших исследований у пациентов с ОДЭМ достоверно чаще поражалось подкорковое белое вещество с относительно сохранным перивентрикулярным белым веществом (93%, 36%, p < 0,001); при РС поражения локализуются как перивентрикулярно (93%), так и субкортикально (92%); при ОДЭМ часто поражаются кора мозга (28%–0%, p < 0,001), таламус (23%–2%, p < 0,05), в то время как при РС достоверно часто — мозолистое тело (38%–2%, p < 0,001), внутренняя капсула (21%–4%, p < 0,01);
- МРТ с контрастированием выявляет гомогенное поражение в противоположность к гетерогенной временной диссеминации при РС. Присутствие на МРТ в режиме Т1 гипоинтенсивностей или «черных дыр» свидетельствует в пользу предыдущего деструктивного воспалительного демиелинизирующего процесса, следовательно, РС;
- масс-эффект и усиление контрастом, являющиеся результатом отека и нарушения функции гемато-энцефалического барьера (ГЭБ), чаще наблюдаются в острой фазе ОДЭМ, реже встречаются при РС;
- поражения при ОДЭМ имеют плохо очерченные края (маргинации), при РС — более четкие.
Поскольку поражения при ОДЭМ имеют масс-эффект, иногда, чтобы исключить злокачественное заболевание ЦНС, с диагностической целью предлагают проводить биопсию. Необходимым условием при диагностике ОДЭМ является исключение инфекций, васкулитов или других аутоиммунных заболеваний.
Лечение. Для ОДЭМ нет стандартного лечения. Терапия заболевания основывается на стратегии, которая оказывает соответствующий эффект на вероятные патогенетические механизмы заболевания. Лечение ОДЭМ не отличается от купирования обострений РС. Основной терапевтический выбор при ОДЭМ — это кортикостероиды, внутривенные иммуноглобулины (ВВИГ), плазмаферез [1, 3].
Кортикостероиды. Эмпирические данные об их высокой эффективности достаточно убедительны, несмотря на отсутствие исследований по типу случай-контроль. Основанием для применения кортикостероидов является их способность снизить воспаление, уменьшить отек, стабилизировать ГЭБ, что снижает дальнейший приток активных иммунных клеток и гуморальных факторов, способствующих демиелинизации.
Современные данные медицинской литературы предлагают применение Метипреда внутривенно с последующим переходом на преднизолон per os, но при условии исключения бактериального менингоэнцефалита.
ВВИГ. Основными направлениями действия ВВИГ являются: связывание с активированными Тh1-лимфоцитами и замедление их пролиферации, что приводит к снижению уровня провоспалительных цитокинов; регуляция апоптоза Т-клеток; восстановление супрессорных Т-клеток; подавление комплемент обусловленного повреждения миелина.
Нами проведен анализ эффективности лечения 10 детей с ОДЭМ, получавших пульс-терапию метилпреднизолоном (Солу-Медрол, Pharmacia, Бельгия) из расчета 20 мг/кг массы тела в сутки внутривенно, от 3 до 5 инфузий с последующим переходом на преднизолон из расчета 1 мг/кг массы тела в сутки per os в течение 6–8 нед с постепенным снижением дозы до полной отмены, в комбинации с ВВИГ: Октагам (Oktapharma), Интраглобин (Biotest Pharma), Пентаглобин (Biotest Pharma) из расчета 2 г/кг веса на курс, в/в капельно. Применение комбинированной терапии ОДЭМ: кортикостероидная терапия и внутривенное введение иммуноглобулина имело выраженный и стойкий клинический эффект.
При ретроспективном анализе анамнестических данных пациентов с МДЭМ выявлено, что они получали лечение преднизолоном per os при первом обострении в течение короткого периода времени и в дозе 1 мг/кг веса. Возможно, что рецидивы ОДЭМ при снижении стероидов происходили из-за их преждевременной отмены — в условиях, когда воспалительный процесс был еще не завершен.
Таким образом, кортикостероидная терапия имеет несомненный высокий эффект, но ее преждевременная отмена (в активный период заболевания) может привести к возврату первоначальных симптомов или к развитию новых.
Учитывая данный факт, детям с ОДЭМ, по нашему мнению, показан более длительный режим снятия со стероидов — в течение 6–8 недель. Другим альтернативным моментов при ранней отмене кортикостероидов является комбинирование с иммуномодулирующей терапией (высокие дозы ВВИГ).
На основании нашего опыта лечения ОДЭМ можем предложить следующую тактику лечения больных с ОДЭМ (рис.).
Плазмаферез рекомендуется у пациентов, которые плохо реагируют на внутривенное введение кортикостероидов.
Циклофосфамид применяли в прошлом, он не получил широкого распространения. Хотя в некоторых работах и сейчас рекомендуют назначение цитостатиков при отсутствии эффекта от проводимой терапии (41).
По вопросам литературы обращайтесь в редакцию.
Бембеева Р. Ц., доктор медицинских наук, профессор РГМУ, Москва
Диагностика ОРЭМ
Диагноз ОРЭМ ставится на основе выявления характерных симптомов, подробной истории болезни, тщательной клинической оценки и различных специализированных тестов, включая методы визуализации, такие как магнитно-резонансная томография (МРТ). МРТ использует магнитное поле и радиоволны для получения поперечных срезов отдельных органов и тканей организма и может продемонстрировать характерные поражения головного мозга у людей с этим заболеванием. Дополнительные исследования для исключения других состояний также могут быть выполнены. Такие исследования могут включать инфекционные, иммунологические и метаболические исследования.
Прогноз при ОРЭМ
Кортикостероидная терапия обычно помогает ускорить выздоровление от большинства симптомов острого рассеянного энцефаломиелита. Долгосрочный прогноз для людей с ОРЭМ, как правило, благоприятный. У большинства людей выздоровление начинается в течение нескольких дней, и в течение шести месяцев у большинства пациентов с ОРЭМ будет наблюдаться полное или почти полное выздоровление. Другие могут иметь легкие или умеренные нарушения в течение всей жизни, начиная от когнитивных проблем, слабости, потери зрения или онемения.
Тяжелые случаи острого рассеянного энцефаломиелита могут быть смертельными, но это очень редкий случай. ОРЭМ может рецидивировать, как правило, в течение нескольких месяцев после первоначального диагноза и лечится путем перезапуска терапии кортикостероидами. Небольшая часть людей, которым был диагностирован ОРЭМ, могут впоследствии развить рассеянный склероз, но в настоящее время нет метода или известных факторов риска, чтобы предсказать, каких именно больных она затронет.
Лечение
Неврологи Юсуповской больницы проводят комплексную терапию острого рассеянного менингомиелита. Для подавления аномального иммунного ответа в течение 3-5 дней вводят внутривенно глюкокортикоидные гормоны. При отсутствии результата от пульс-терапии кортикостероидами врачи отделения реанимации и интенсивной терапии проводят 4-5 сеансов плазмафереза.
Если воспалительный процесс вызвали бактерии, пациентам назначают антибиотики. При установленной вирусной природе используют препараты a-интерферона или интерфероногены. Высокую температуру снижают антипиретиками. Для улучшения обменных процессов в коре головного мозга пациентам назначают ноотропные препараты. Также используют лекарственные средства, снижающие внутричерепное давление и нормализующие кровоснабжение мозга. Неврологи проводят поддерживающую терапию витаминно-минеральными комплексами, аминокислотными смесями.
Специалисты клиники реабилитации проводят курс немедикаментозной терапии для восстановления когнитивных и социальных функций. Реабилитологи используют современные эффективные методики лечебной физкультуры, различные виды массажа, физиотерапевтические процедуры, иглорефлексотерапию. При наличии показаний пациент может получить консультацию психиатра.
Причины
Причины могут быть самыми разнообразными. Вторичный энцефаломиелит инфекционного генеза развивается на фоне бактериальных и вирусных заболевания:
- герпес;
- болезнь Лайма;
- сифилис;
- токсоплазмоз;
- ВИЧ-инфекция;
- тропический парапарез.
Также энцефаломиелит может возникать на фоне кори, краснухи, ветряной оспы, опоясывающего лишая, эпидемического паротита и других инфекций, вызванных энтеровирусами.
Вторичный рассеянный энцефаломиелит аутоиммунного генеза:
- поствакцинальный РЭМ (после прививок от бешенства и др.);
- РЭМ у пациентов с диффузной патологией соединительной ткани (ревматизм, системная красная волчанка, недифференцированное заболевание соединительной ткани);
- поражения ЦНС у пациентов с онкологической патологией;
- антифосфолипидный синдром и иные васкулопатии;
- васкулиты с поражением ЦНС;
- иные аутоиммунные процессы.
Гораздо реже энцефаломиелит развивается при саркоидозе, после укусов насекомых, а также при COVID-19.
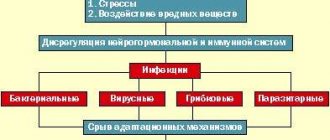
Патогенез
Патогенез считается недостаточно изученным. Основные патогенетические механизмы развития заболевания кроются в аутоиммунном ответе активированных гуморальных аутоантител и Т-лимфоцитов к миелину в центральной нервной системе. В некоторых случаях поражается и периферический миелин. Сегодня рассматривают 2 концепции развития заболевания.
Согласно первой теории, нервная система выступает барьером по отношению к иммунитету. В период эмбрионального развития у плода на третьем месяце происходит формирование гематоэнцефалического барьера в головном мозге. Именно с его помощью осуществляется разделение между общим кровотоком и нервной системой, что обеспечивает оптимальную по химическому составу и постоянную среду для полноценного функционирования.
Гематоэнцефалический барьер позволяет снизить проницаемость, которая характерна для кровеносных сосудов в нервной системе. Одновременно идет формирование иммунного ответа. По мере развития и созревания вышеописанные две системы не соприкасаются между собой. Именно поэтому при повреждении нервной системы (например, при нейроинфекции либо при травме) и нарушении проницаемости гематоэнцефалического барьера, происходит формирование иммунного ответа на антигены собственной нервной ткани.
При попадании патогенной микрофлоры или вируса в нервную систему происходит выработка мозгоспецифических белков и их выброс в кровь, активируется иммунная защита. Именно данные аутоантигены при контакте с иммунокомпетентными клетками (лимфоцитами и макрофагами) провоцируют формирование мозгоспецифических антител и активированный Т-лимфоцитов. Антитела и Т-лимфоциты после проникновения через гематоэнцефалический барьер попадают в нервную систему и способствуют поддержанию там аутоиммунного воспалительного процесса.
При вторичных энцефаломиелитах, возбудителями которых являются нейротропные вирусы (штаммы гриппа, энтеровирусы, полиомиелит) происходит поражение клеток глии и нейронов самими инфекционными агентами, что также приводит к запуску аутоиммунного ответа.
Вторая концепция опирается на теорию молекулярной мимикрии, которая заключается в схожести белка миелина и аминокислотных последовательной генетического материала бактерии или вирусов. Каскад иммунных реакций запускается за счёт перекрёстной реактивности, которая означает, что первоначально иммунная система реагирует на патогенный агент, а затем уже на собственные ткани.
Для острого реактивного энцефаломиелита характерно возникновение очагов демиелинизации совместно с очагами сосудистой реакции и вовлечением глии. Вокруг желудочков в веществе головного мозга выявляются макрофаги и лимфоциты. Демиелинизация поражает в основном вены среднего и мелкого калибра.
Патологический процесс затрагивает в основном белое вещество больших полушарий, мозгового створа, мозжечка и спинного мозга. Одновременно поражения выявляются в миелиновых оболочках вокруг аксонов периферических нервов. В некоторых случаях поражаются периферические нервы и спинно-мозговые корешки.