Делать или не делать, пить или не пить лекарство, сдавать или не сдавать анализ. Мы всегда стоим перед выбором и часто боимся ошибиться. Железно можно сказать, что с железом ошибаться нельзя.
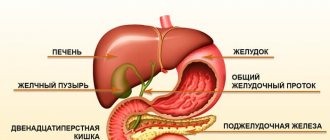
В организме взрослого человека содержится около 3–4,5 г железа. Больше половины железа представлено гемом в составе гемоглобина, треть запасается в депо в виде ферритина и гемосидерина. При этом дефицит железа – наиболее распространенное дефицитное состояние во всем мире, скрытно приводящее к анемии.
Основные причины дефицита железа:
Снижение поступления железа в организм в связи с нарушением его всасывания при заболеваниях желудочно-кишечного тракта, голодании, отказе или уменьшение потребления продуктов питания, содержащих железо.
Увеличение потерь железа при хронических, повторных кровопотерях (маточных, желудочных, кишечных, и др.), а также при остром объемном кровотечении.
Повышенное расходование железа организмом у детей в периоды роста, у женщин во время беременности и последующего грудного вскармливания ребёнка.
Клиническая фармакология современных препаратов железа и их место в терапии железодефицитных анемий
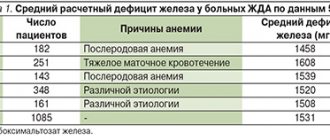
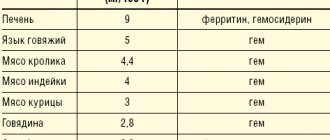
Латентный дефицит железа у населения Европы и России составляет 30–40%, а в некоторых регионах (Север, Северный Кавказ, Восточная Сибирь) – 50–60% [2,3]. Железодефицитная анемия – это гипохромная микроцитарная анемия, возникающая вследствие снижения содержания железа в организме и представляющая собой самостоятельную нозологическую форму (код D–50 по МКБ–10). Латентный дефицит железа рассматривается как функциональное расстройство, не имеет самостоятельного кода и обычно кодируется в разделе «Недостаточность других элементов питания» (Е61). Хроническая ЖДА – следствие длительного отрицательного баланса железа в организме. Причинами ее развития могут быть хроническая потеря крови вследствие желудочно–кишечного кровотечения (эрозивный гастрит, язвенная болезнь, геморрой, прием ацетилсалициловой кислоты, индометацина), маточного кровотечения при обильных менструациях, а также опухоли (рак прямой и толстой кишки, рак мочевого пузыря), донорство, повышенная потребность в железе при беременности и лактации, в подростковом возрасте (ювенильный хлороз), при паразитарных болезнях (дифиллоботриоз), недостаточное поступление железа (гастродуоденит, колит, гастрэктомия), алиментарная недостаточность железа у вегетарианцев [2,4]. Патогенез. Общее количество железа в организме составляет 4–4,5 г. Железо участвует в функционировании всех биологических систем, являясь обязательным и незаменимым компонентом различных белков и ферментов, обеспечивающих необходимый уровень системного и клеточного аэробного метаболизма, а также окислительно–восстановительного гомеостаза в организме в целом. Железо играет важную роль в поддержании высокого уровня иммунной резистентности, адекватное его содержание в организме способствует полноценному функционированию факторов неспецифической защиты, клеточного и местного иммунитета. Нормальное содержание железа необходимо для полноценного фагоцитоза, синтеза лизоцима, интерферона, обеспечивает высокую активность естественных киллеров и бактерицидной способности сыворотки [5,6]. Суточная потребность в железе составляет для мужчин 10 мг, для женщин – 18 мг (в период беременности – 38 мг, лактации – 33 мг) [6]. Потребность в железе повышена также у активных доноров. У детей и подростков из–за повышенной потребности растущего организма и недостаточного поступления железа с пищей баланс железа нередко нарушается [7]. Основным источником железа для человека являются пищевые продукты животного происхождения, которые содержат железо в наиболее усвояемой форме (в составе гема). Усвоение железа из продуктов снижается после их тепловой обработки, при замораживании, длительном хранении. Железо, попадая в организм с пищей, всасывается в кишечнике (наиболее интенсивно – в двенадцатиперстной кишке и начальном отделе тощей кишки). Всасывание железа зависит от характера пищи, калорийности рациона и всасывающей способности тонкой кишки. Железо в составе гема всасывается намного лучше. Люди, употребляющие в пищу мясо, получают больше железа гема (в составе миоглобина), чем вегетарианцы. У строгих вегетарианцев со временем может развиться дефицит железа, поскольку овощи и злаки содержат вещества, препятствующие всасыванию железа, в частности фосфаты [7,8]. Фруктоза, соляная, аскорбиновая, янтарная, пировиноградная кислоты, цистеин, сорбит и алкоголь усиливают резорбцию железа. Закисное неорганическое железо всасывается значительно лучше окисного, содержащегося в мясных продуктах [9]. Из желудочно–кишечного тракта (ЖКТ) железо абсорбируется только в двухвалентном состоянии, перевод в которое обеспечивается органическими кислотами, в частности аскорбиновой. Основная доля абсорбированного железа в составе транспортного белка – трансферрина переносится к костному мозгу, где используется для синтеза гемосодержащих соединений (гемоглобина, миоглобина, ферментов), негемовых ферментов (например, НАДН–дегидрогеназы), металлопротеидов. В тканях железо депонируется в форме ферритина и гемосидерина, с преимущественным отложением в печени, селезенке и мышцах. Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. [9]. Однако не всякий дефицит железа сопровождается анемией – выделяют также прелатентный и латентный дефициты железа [2,5]. Прелатентный дефицит развивается, когда поступление железа с пищей не соответствует физиологическим потребностям (рост организма, менструации, беременность), но недостаточное поступление железа покрывается за счет его запасов. При этом запасы железа истощаются. Латентный дефицит – это следующая стадия, на которой снижается поступление железа к клеткам эритроидного ростка и ограничивается продукция эритроцитов. ЖДА с гипохромией и микроцитозом развивается в исходе длительного отрицательного баланса железа, когда снижается синтез гемоглобина. Наиболее часто анемический синдром, связанный с развитием ЖДА, встречается в практике врача–терапевта, врача общей практики (семейного врача), врача–гематолога, врача–акушера–гинеколога. Согласно принятым в настоящее время стандартам высшего профессионального и послевузовского профессионального образования, в компетенции данных специалистов – заподозрить синдром ЖДА на основании данных клинической картины и картины периферической крови, разработать программу диагностических и лечебных мероприятий, обосновать программу профилактических мероприятий у больных с ЖДА с учетом наличия факторов риска ее рецидива. Клиническая картина при ЖДА зависит от стадии дефицита железа. Стадии железодефицита (ЖД): • предлатентный ЖД – характеризуется снижением запасов железа, но без уменьшения его количества, расходующегося на эритропоэз (дефицит резервного железа); • латентный ЖД – характеризуется полным истощением запасов железа в депо, снижением уровня ферритина в сыворотке крови, повышением общей железосвязывающей способности сыворотки (ОЖСС) и уровня трансферрина, однако еще без признаков развития анемии (дефицит транспортного железа); • ЖДА – заключительный этап ЖД, который возникает при снижении гемоглобинового фонда железа и проявляется симптомами анемии и гипосидероза (явный дефицит железа). Существует классическая клиническая симптоматика ЖДА в организме, складывающаяся из общих симптомов анемии, обусловленных гемической гипоксией, а также признаков тканевого дефицита железа (сидеропенический синдром) (табл. 1). Неблагоприятное влияние анемия, развивающаяся в период беременности, оказывает на внутриутробное состояние плода, способствуя возникновению синдрома задержки развития плода и осложнений течения раннего неонатального периода. У детей в период новорожденности наблюдаются большая потеря массы тела и более медленное ее восстановление, запоздалое отпадение пуповинного остатка и отсроченная эпителизация пуповинной ранки, длительное течение физиологической желтухи [10,11]. Диагностика. Для диагностики дефицита железа в организме проводится определение показателей, характеризующих различные фонды метаболизма железа: транспортного, функционального, запасного и железорегуляторного (табл. 2). Лабораторными признаками, позволяющими заподозрить и верифицировать ЖДА, являются низкий цветовой показатель, снижение показателя МСН (ниже 27 pg, в норме – 27–35 pg), гипохромия и микроцитоз эритроцитов, снижение показателей сывороточного железа, повышение показателя ОЖСС, снижение содержания ферритина в сыворотке. Дифференциальный диагноз при ЖДА проводится также с анемиями при хронических заболеваниях, мегалобластными анемиями, связанными с дефицитом витамина В12 или фолиевой кислоты, гемолитическими и апластическими анемиями (возможны в том числе при токсическом воздействии различных классов лекарственных средств, профессиональных вредностей, например свинца, бензола) [12]. Дифференциальный диагноз ЖДА и анемии при хронических заболеваниях представлен в таблице 3. Наиболее частыми причинами анемии при хронических заболеваниях являются хронические инфекции (заболевания дыхательной системы, мочевыводящих путей, остеомиелит), хронические неинфекционные заболевания (диффузные болезни соединительной ткани, ревматическая лихорадка), злокачественные опухоли (рак, лимфогранулематоз, неходжкинские лимфомы, лейкозы). Гипохромный характер анемии делает весьма вероятным ее железодефицитный характер (все ЖДА являются гипохромными). Однако гипохромный характер анемии не исключает другие патогенетические варианты анемий (не все гипохромные анемии являются железодефицитными). В связи с этим необходима дифференциальная диагностика ЖДА с другими, реже встречающимися гипохромными анемиями (сидероахрестические анемии, талассемия). Определение уровня сывороточного железа позволяет разграничить эти состояния на этапе диагностического поиска. На показатели сывороточного железа может влиять целый ряд факторов: прием лекарственных препаратов железа (витаминных препаратов, содержащих небольшое количество железа, некоторых лекарственных средств (оральные контрацептивы, аллопуринол)), трансфузии эритроцитов, время исследования сывороточного железа, маскирующих тем самым истинное содержание железа в сыворотке, что следует учитывать при трактовке полученных результатов. Лечение. В соответствии с этиологическими и патогенетическими факторами ЖДА лечение должно быть комплексным, направленным на устранение причины, вызвавшей заболевание, и включать адекватное поступление в организм микроэлементов, витаминов, белков и коррекцию дефицита железа. Наиболее эффективно железо усваивается из продуктов, в которых оно содержится в виде гема, когда оно активно захватывается и всасывается клетками слизистой оболочки кишечника в неизмененном виде (язык говяжий, мясо кролика, индейки, курицы, говядина). Процессы абсорбции гема в кишечнике не зависят от кислотности среды и ингибирующих пищевых веществ. Как уже упоминалось, в злаках, фруктах и овощах железо находится в негемовой форме, и всасывание из них происходит значительно хуже. Снижению всасывания также способствует присутствие в них оксалатов, фосфатов, танина и других ингибиторов ферроабсорбции (табл. 4). Следует учитывать, что полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит, и должна рассматриваться как один из вспомогательных компонентов терапии. В настоящее время сужены показания для парентерального использования препаратов железа: они используются при наличии патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания, резекция тонкой кишки, резекция желудка по Бильрот II с формированием «слепой петли»). Препараты железа для парентерального введения могут быть средством выбора при плохой переносимости пероральных препаратов железа. В настоящее время при терапии ЖДА перспективным представляется пероральное применение комбинированных препаратов (содержащих как соли железа, так и другие компоненты), ведущим из которых является Ферро–Фольгамма. Ферро–Фольгамма (Вёрваг Фарма, Германия) – мультифакторный гемопоэтик, включающий все необходимые компоненты (1 капсула содержит 112,6 мг железа сульфата (эквивалентно 37 мг иона железа), 5 мг фолиевой кислоты, 0,010 мг цианокобаламина), обеспечивающие стимуляцию структурного синтеза Hb и повышающие репродукцию эритроцитов красным ростком костного мозга. Также в состав препарата входит аскорбиновая кислота. Универсальность препарата связана с его избирательно–стимулирующим действием на синтез железосодержащей и белковой частей гемоглобина. Сульфат железа обладает высоким коэффициентом всасывания в ЖКТ и практически не образует в нем малодоступных сложных соединений. Абсорбционный коэффициент в значительной степени усилен присутствием в препарате аскорбиновой кислоты [12]. Сульфат восполняет дефицит железа в организме. Железо входит в состав гемоглобина, миоглобина и ряда ферментов. Являясь структурным компонентом гема, принимает участие в эритропоэзе. Аскорбиновая кислота способствует улучшению абсорбции железа в кишечнике. Цианокобаламин (витамин B12) и фолиевая кислота участвуют в образовании и созревании эритроцитов. Активные компоненты препарата Ферро–Фольгамма находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание, главным образом из верхнего отдела тонкой кишки. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата со стороны ЖКТ. Ферро–Фольгамма назначается по 1 капсуле 3 раза/сут. Наилучший эффект дает применение препарата после еды. При анемии легкой формы рекомендован прием 1 капсулы 3 раза/сут. в течение 3–4 нед.; при среднетяжелой форме – по 1 капсуле 3 раза/сут. в течение 8–12 нед.; при тяжелой форме – по 1 капсуле 3 раза/сут. в течение 16 нед. и более. Хороший клинический эффект препарата подтвержден данными многочисленных клинических исследований. Так, в исследованиях А.Л. Вёрткина и соавт. [14] доказана высокая эффективность препарата Ферро–Фольгамма (по сравнению с другими ферропрепаратами) при лечении ЖДА. Под наблюдением авторов находилось 83 человека (22 мужчины и 61 женщина) в возрасте от 17 до 92 лет (средний возраст – 57,7±1,4 года). В группе в среднем уровень гемоглобина был снижен до 87,8±0,4 г/л, средняя длительность анемии составила 1,5±0,1 года. Причинами анемии послужили: острая или хроническая кровопотеря – в 54,3% случаев, нарушение всасывания – в 28,3%, другие или комбинированные причины – в 17,3% случаев. При применении препарата Ферро–Фольгамма наблюдалась более выраженная положительная динамика как клинических, так и лабораторных показателей по сравнению с другими ферросодержащими препаратами [14] (табл. 5 и 6). Также доказана высокая эффективность использования Ферро–Фольгаммы в коррекции ЖДА при хронической сердечной недостаточности (ХСН) [15]. Авторами для обследования и лечения было отобрано 42 больных с ХСН, сочетающейся с ЖДА (в целом по группе Hb = 97,1±3,7 g/l; Fe сыворотки = 5,84±0,51 ммоль/л): при II ФК СН – Hb = 102,3±3,6 g/l, при III ФК СН – Hb = 97,6±3,3 g/l, при IV ФК СН – Hb = 84,4±3,5 g/l. На фоне лечения ХСН (ингибиторы АПФ, сердечные гликозиды, диуретики) купирование анемического синдрома осуществлялось назначением Ферро–Фольгаммы (комплекс 100 мг сульфата безводного Fe c 5 мг фолиевой кислотой, 10 мкг цианокобаламина и 100 мг аскорбиновой кислоты) в суммарной дозе в целом по группе –137,75±7,5 мг Fe. К концу лечения (23,7±3 дня) уровень гемоглобина в целом в группе больных с ХСН повысился на 9,8%, сывороточное Fe возросло на 95,5%, толерантность к физической нагрузке поднялась на 47,6%, фракция выброса (ФВ) увеличилась на 32,2%, ударный объем (УО) возрос на 51,7%; до лечения у 31 пациента с ХСН с ЖДА (73,8%) был III–IV ФК СН, после лечения 23 пациента (54,8%) перешли в I ФК СН, у 19 больных (45,2%) был выявлен II ФК СН. Таким образом, все вышеизложенное позволяет считать, что коррекция даже слабой степени анемии у больных с ХСН может привести к значительному улучшению насосной функции сердца и снижению функционального класса СН (NYHA). Также доказана высокая эффективность применения Ферро–Фольгаммы в терапии анемии беременных. Так, под руководством профессора В.А. Бурлева и академика РАМН, профессора В.Н. Серова в ФГУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» проведен ряд исследований по проблеме железодефицитных состояний у беременных, родильниц и гинекологических больных [16–19]. Наиболее полно была изучена клиническая эффективность препарата Ферро–Фольгамма, который с успехом использовался для лечения латентного дефицита железа (ЛДЖ) и манифестного дефицита железа (МДЖ) у пациенток акушерского и гинекологического профиля, как самостоятельно, так и в сочетании с препаратами рекомбинантного эритропоэтина. Полученные результаты показали, что уникальное соотношение между оптимальным содержанием двухвалентного железа, фолиевой кислоты и цианокобаламина в одной капсуле Ферро–Фольгаммы позволяет добиться отличных результатов в лечении беременных, родильниц и гинекологических больных с МДЖ не только легкой, но и средней и тяжелой степени тяжести. Наличие в препарате Ферро–Фольгамма фолиевой кислоты и цианокобаламина является его дополнительным преимуществом, так как при МДЖ у беременных часто имеет место недостаток многих витаминов, и прежде всего участвующих в кроветворении. Согласно полученным данным, при наличии показаний для применения рекомбинантного эритропоэтина оптимальным пероральным препаратом железа для сочетанного лечения МДЖ у женщин вне и при беременности, а также после родов в настоящее время является Ферро–Фольгамма. Применение Ферро–Фольгаммы у беременных с анемией и при ее сочетании с гестозом приводит к улучшению клинического состояния, достоверному повышению гематологических (гемоглобина – на 15%, эритроцитов – на 10%, гематокрита – на 9%) и феррокинетических показателей (сывороточного железа – на 32%, ферритина – на 53%), уровня фолиевой кислоты – на 24% и витамина В12 – на 21,7% [18,19]. Эффективность применения Ферро–Фольгаммы в терапии анемии беременных доказана также в исследовании В.А. Петрухина и В.Л. Гришина [19]. По данным исследователей, использование Ферро–Фольгаммы по 1 капсуле 2 раза/сут. в течение 6 нед. привело к нормализации клинических и лабораторных показателей у всех наблюдаемых пациенток с синдромом ЖДА, развившимся в период беременности [20]. Таким образом, в лечении ЖДА и латентного дефицита железа оптимальным является применение препарата Ферро–Фольгамма, позволяющее добиться хороших и быстрых результатов. Наличие в препарате фолиевой кислоты и витамина В12 является его дополнительным преимуществом, так как при железодефицитных состояниях часто имеется дефицит этих витаминов. Наличие аскорбиновой кислоты улучшает всасывание и усвоение железа. Микрокапсулированная форма препарата исключает местное раздражение желудка и кишечника. Научный и практический опыт убеждает нас в целесообразности и высокой эффективности применения в терапевтической, гематологической, акушерской и гинекологической практике при лечении железодефицитных состояний Ферро–Фольгаммы как препарата с доказанной эффективностью и безопаcностью, обладающего оптимальным соотношением стоимости и эффективности.
Литература 1. ВОЗ. Официальный ежегодный отчет. Женева, 2002. 2. Захарова Н.О., Никитин О.Л. Железодефицитные анемии у пациентов пожилого и старческого возраста: научно–практическое пособие для врачей. Самара, 2008. 60 с. 3. Городецкий В.В., Годулян О.В. Железодефицитные состояния и железодефицитная анемия: лечение и диагностика. М.: Медпрактика–М, 2004. С. 1–28. 4. Дворецкий Л.И. Лечение железодефицитной анемии // Русский медицинский журнал. 2006. Т. 6. № 20. С. 1312–1316. 5. Крюков Н.Н., Качковский М.А., Вербовой А.Ф., Бабанов С.А. Настольная книга терапевта. Диагностический справочник. М.: Астрель, 2012. 672 с. 6. Хиллман Р. Железодефицитная и другие гипорегенераторные анемии. Внутренние болезни по Тинсли Р. Харриссону // Трудный пациент. 2005. № 2. С. 770. 7. Шехтман М.М. Железодефицитная анемия и беременность // Гинекол. 2000. Т. 2. № 6. С. 164–171. 8. Серов В.Н., Шаповаленко С.А., Флакс Г.А. Диагностика и лечение железодефицитных состояний у женщин в различные периоды жизни // Атмосфера. Кардиология. 2008. № 2. С. 17–20. 9. Косарев В.В., Бабанов С.А., Вербовой А.Ф. Справочник клинического фармаколога. Ростов–на–Дону: Феникс, 2011. 476 с. 10.Подзолкова Н.М., Нестерова А.А., Назарова С.В., Шевелева Т.В. Железодефицитная анемия беременных // Русский медицинский журнал. 2003. № 11 (5). С. 326–32. 11. Смирнова О.В., Чеснокова Н.П., Михайлов А.В. Железодефицитная анемия у беременных. Этиология и патогенез метаболических и функциональных расстройств. Саратов, 1994. 12. Косарев В.В., Бабанов С.А. Клиническая фармакология и рациональная фармакотерапия. М.: Инфра–М, 2012. 236 с. 13. Дворецкий Л.И., Заспа Е.А., Литвицкий П.Ф., Болевич С.Б., Меньшова Н.И. Свободнорадикальные процессы у больных железодефицитной анемией на фоне лечения препаратами железа // Терапевтический архив. 2006. № 78 (1). С. 52–57. 14. Верткин А.Л., Годулян О.В., Городецкий В.В., Скотников А.С. Железодефицитная анемия и выбор препарата для ее коррекции // Русский медицинский журнал. 2010. № 5. 15. Шилов А.М., Мельник М.В., Ретивых О.Н., Ким И.Р. Коррекция железодефицитной анемии при хронической сердечной недостаточности // Русский медицинский журнал. 2005. № 19. С. 1254–1257. 16. Бурлев, В.А., Коноводова Е.Н., Орджоникидзе Н.В., Серов В.Н., Елохина Т.Б., Ильясова Н.А. Лечение латентного дефицита железа и железодефицитной анемии у беременных // Российский вестник акушера–гинеколога. 2006. № 1. C. 64–68. 17. Коноводова Е.Н., Бурлев В.А. Ферро–Фольгамма + Эритропоэтин – новые возможности лечения анемии у больных с миомой матки // Фарматека. 2004. № 15 (92). C. 70–73. 18. Коноводова Е.Н., Бурлев В.А., Кравченко Н.Ф., Карибджанов О.К., Мурашко Л.Е., Сопоева Ж.А. Коэффициент насыщения трансферрина железом у беременных // Проблемы репродукции. 2002. № 6. С. 45–47. 19. Мурашко Л.Е., Коноводова Е.Н., Бурлев В.А., Сопоева Ж.А. Объемный транспорт кислорода у беременных с анемией и гестозом при лечении Ферро–Фольгаммой // Русский медицинский журнал. 2002. Т. 10. № 7. С. 364–367. 20. Петрухин В.А., Гришин В.Л. Лечение анемии беременных с использованием препарата ферро–фольгамма // Проблемы репродукции. 2002. № 6.
Какие анализы показывают железодефицит
- Обязательно смотрят общий анализ крови с лейкоцитарной формулой, поскольку дефицит железа в итоге приводит к развитию анемии. О железодефицитной анемии говорят при снижении уровня гемоглобина, показателя MCV (гипохромии эритроцитов). Нередко обследование начинают, когда есть симптомы анемии (бледность, слабость, головокружение, упадок сил, снижение работоспособности и внимания, ломкость ногтей и волос и т.д.).
- Снижение концентрации сывороточного железа
- Повышение общей железосвязывающей способности сыворотки
- Снижение коэффициента насыщения трансферрина железом
- Снижение концентрации сывороточного ферритина
Анализы рекомендовано сдавать в утренние часы, с 8 до 11 утра, так как уровень железа в сыворотке в утренние часы выше. Также их стоит сдавать при отсутствии воспаления, которое способствует понижению уровня трансферрина и повышению уровня ферритина.
Содержание железа в сыворотке смотрят через 5-7 дней после приема витаминно-минеральных комплексов и БАДов, содержащих железо, или недолгого приема препаратов железа.
Публикации в СМИ
Острое отравление препаратами железа наблюдают достаточно редко; в связи с повышением популярности препаратов, содержащих железо (например, поливитамины с микроэлементами и др.), частота отравления возросла. Частота. В 1988 году в США было зарегистрировано свыше 16 000 случаев интоксикации железосодержащими препаратами. Преобладающий возраст — детский (в 1984 году 1 337 случаев отравления препаратами железа из 1 738 было зарегистрировано среди детей моложе 6 лет). Этиопатогенез • Интоксикация развивается при пероральном приёме чистого железа в дозе более 60 мг/кг • Смертельная для человека доза — 200–250 мг/кг чистого железа (для 2-летних детей смертельная доза чистого железа — 3 г). Фактор риска — свободный доступ детей к препаратам железа и железосодержащим витаминам.
Клиническая картина • Тошнота, рвота, диарея, сонливость, боли в верхних отделах живота, бледность, потливость. В тяжёлых случаях — цианоз, рвота с кровью, коагулопатия, ацидоз, нарушение микроциркуляции до развития шока и комы. За первыми острыми симптомами часто следует светлый промежуток (кажущееся выздоровление) • Через 12–48 ч симптомы могут рецидивировать, в тяжёлых случаях развивается глубокий шок, тяжёлый ацидоз, цианоз, гипертермия, судорожный синдром, анурия; возможны отёк лёгких, летальный исход • В отдалённом периоде (2–6 нед) развивается стеноз в пилорическом или антральном отделе желудка, возможны цирроз печени и необратимые нарушения ЦНС. Лабораторные исследования • ОАК • Определение содержания электролитов и глюкозы в крови • Определение концентрации железа в сыворотке крови, а также ОЖСС • Определение соотношения ПВ/МСС (ПВ/международное стандартизованное соотношение) и ЧТВ • При тяжёлом отравлении — функциональные пробы печени. Специальные исследования — рентгенография органов брюшной полости и грудной клетки. Дифференциальная диагностика — если в анамнезе нет указаний на приём препаратов железа, дифференциальную диагностику следует проводить с гастритом, алкогольной интоксикацией, вирусной инфекцией, диабетическим кетоацидозом, отравлениями другими ЛС.
ЛЕЧЕНИЕ Тактика ведения • При тяжёлом отравлении — госпитализация • Рвотные средства, промывание желудка через зонд проводят, если количество принятого больным чистого железа превышает 20 мг/кг, при наличии характерных симптомов • Специфическая (антидотная) терапия • При приёме смертельной дозы препаратов железа — гемодиализ, перитонеальный диализ, обменные переливания крови • Симптоматическая терапия. Специфическая (антидотная) терапия. При содержании железа в плазме более 300 мг% — дефероксамин 1 г в/в капельно (со скоростью до 15 мг/кг/ч) на срок не более 24 ч или 1–2 г в/м каждые 3–12 ч (под контролем цвета мочи: в течение 2 ч моча приобретает красный цвет; если изменения цвета не происходит, инъекции прекращают). Концентрация железа в сыворотке крови больного на фоне указанной терапии обычно снижается в течение 12–48 ч. Течение и прогноз зависят от количества принятого препарата и длительности его воздействия на организм.
МКБ-10 • T45.4 Отравление железом и его соединениями
Как лечат железодефицит
Необходимо выявить и устранить причину железодефицита, скорректировать питание. Если эти меры не помогают, а потери железа значительные, врач может назначить лекарственные препараты на основе железа.
Длительность курса лечения препаратами железа с целью восстановления и пополнение запасов железа в депо:
- при скрытом железодефиците 1-2 месяца,
- при анемии легкой степени 3 мес,
- при анемии средней степени 4,5 мес,
- при тяжелой анемии 6 мес.
Конечно, в первую очередь, используют препараты железа в виде таблеток, капель, капсул, сиропов. Если врач назначил вам препараты железа, необходимо настроиться на длительное и комфортное лечение. Этому поможет соблюдение простых правил.
Дозировку препарата также определяют по наличию анемии (это полная лечебная доза) и вида иона железа, который входит в лекарственный препарат.
Какие препараты железа бывают
Железо в препаратах может быть представлено двух- или трехвалентным ионом, обозначаемым Fe2+ или Fe3+, входящим в состав солей или сложных комплексов (например, гидроксид полимальтозного комплекса).
При использовании солей железа можно столкнуться с проблемой его всасывания. К сожалению, не все железо из препарата всасывается в желудочно-кишечном тракте. Более того, этот процесс плохо контролируется, поскольку зависит от состояния желудочно-кишечного тракта, принимаемой пищи, других лекарственных препаратов. Поэтому возможна как нехватка поступающего железа, так и его передозировка. К тому же, не все формы выпуска лекарств удобны к применению, некоторые таблетки если разжевать, то часто окрашивается эмаль зубов и надолго остается металлический привкус во рту. Трехвалентные препараты железа обычно лишены этих побочных свойств.
Новое поколение препаратов железа – бисглицинат (хелат) железа
Распространенность анемии
Значимость анемии как проблемы современного мира не вызывает сомнений. Несмотря на все достижения цивилизации, дефицит железа является основным и наиболее распространенным нарушением питания в мире. Дефицит железа, от которого страдают многие дети и женщины в развивающихся странах, является единственным видом недостаточности питательных веществ, который также в значительных масштабах распространен в экономически развитых странах. Уровни его распространенности поражают: 2 миллиарда человек, то есть более 30% населения мира, страдают от анемии.1
По данным Всемирной организации здравоохранения наиболее уязвимыми группами по развитию анемии являются беременные женщины, женщины репродуктивного возраста, дети и пожилые люди. При чем, самый высокий процент встречаемости — это среди женщин репродуктивного возраста — 30%.
Среди анемий ведущими являются железодефицитные, составляя в структуре у женщин до 90% и среди мужчин — до 80%. Важным является высокая распространенность среди населения латентного дефицита железа, которая колеблется от 19,5% до 30%, кроме того, от 50% до 86% женщин имеют факторы риска развития анемии.
Железодефицитная анемия (ЖДА) — заболевание системы крови, обусловленное дефицитом железа в организме, сопровождаетcя изменениями параметров его метаболизма, уменьшением концентрации гемоглобина в эритроцитах, количественными и качественными их изменениями и клинически выражается анемической гипоксией и сидеропенией.
Сидеропения и развивающаяся в последующем тканевая и гемическая гипоксия приводят к расстройствам сердечно-сосудистой (миокардиодистрофия и нарушение кровообращения различной степени), нервной системы (вегетативно-сосудистые, вестибулярные нарушения, астенический синдром), снижению детородной функции женщин, а также развитие осложнений во время беременности и родов, изменению интеллекта и поведенческих настроений, хронизацию различных заболеваний и как следствие снижение работоспособности и ухудшение качества жизни.4
Эволюция синтетических лекарственных средств терапии железодефицитной анемии
Фармакотерапия ЖДА базируется на введение в организм железа из состава железосодержащих лекарственных средств. Выбору препарата для коррекции сидеропении придается особое значение, так как важна не только эффективность, но и отсутствие побочных реакций и осложнений при их применении.
Существует условное деление препаратов железа на двух- и трёхвалентные. Однако, сама по себе валентность железа не представляет какой-либо ценности.
Известно, что всасывание железа в кишечнике возможно лишь тогда, когда микроэлемент находится в двухвалентной форме, которая способна проходить через клеточную мембрану слизистой оболочки кишечника. Низкое значение рН желудочного содержимого способствует растворению алиментарного железа и переходу трехвалентного железа (окисное) в двухвалентную форму (закисное).17
При поступлении желудочного содержимого в кишечник рН пищевого комка повышается и в отличие от ферро-иона (Fe2+), ферри-ион (Fe3+) образует нерастворимые соли. В этих условиях только муцин, хелатируя железо, способен поддержать ферри-ион в растворимом состоянии.4
Таким образом, соединения железа в составе препаратов должны обладать хорошей растворимостью, высокой биодоступностью, достаточным содержанием элементарного железа и малой токсичностью. Рассмотрим особенности абсорбции каждой из трёх известных групп препаратов железа.
Первое поколение препаратов железа
Одной из первых групп препаратов железа стали применять ионные соли двухвалентного железа. Эта группа характеризуется довольно быстрым наступлением эффекта в плане повышения гемоглобина и улучшения гемодинамических показателей в периферической крови.
Тем не менее, лечение ионными препаратами железа, в частности сульфатом железа, вызывает побочные реакции у 44,7% пациентов. Чаще всего страдает желудочно-кишечный тракт (ЖКТ). Симптомы дисфункции его верхних отделов обычно проявляются в течение часа после приема лекарства и могут протекать как в легкой (тошнота, дискомфорт в эпигастрии), так и в тяжелой форме — с болью в животе и/ или рвотой. Кроме того, ферротерапия солевыми препаратами железа нередко сопровождается появлением металлического привкуса в течение первых дней лечения, потемнением зубной эмали и десен, возможны также диарея или запор. хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию в том числе и железа. В связи с этим, их рекомендуют назначать за 1 час до приема пищи, однако это усиливает повреждающее действие соединений Fe2+ на слизистую кишечника, вплоть до развития ее некроза.5
Причиной возникновения данных побочных явлений является гидролиз солей железа в желудке. Под действием желудочного сока ионные соли железа подвергаются гидролизу(диссоциации) в желудке, в результате чего свободные молекулы железа негативно воздействуют на слизистую оболочку ЖКТ и провоцируют возникновение побочных эффектов: тошнота, боль в животе, металлический привкус во рту, диарея/запор.
Второе поколение препаратов железа
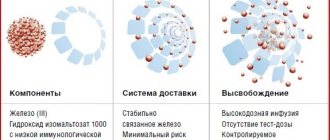
Абсорбция железа в виде гидроксид-полимальтозного комплекса (ГПК) железа-III
имеет принципиально иную схему по сравнению с его ионными соединениями и осуществляется путем активного всасывания при конкурентном обмене лигандами, уровень которых определяет скорость абсорбции железа Fe3+. Неионная структура, обеспечивающая стабильность комплекса и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, то есть прооксидантные реакции.
Однако биодоступность полимальтозного комплекса железа-III самая низкая
среди всех препаратов железа, всего 10–15%.
В связи с большим размером молекулы (55 kDa), ее пассивная диффузия примерно в 40 раз медленнее
, чем у ионов железа.6 Такую низкую биодоступность приходится компенсировать большими суточными дозами ГПК.
Новое поколение препаратов железа — новое решение проблемы анемии
С конца 90-х начала 2000-х годов начали активно внедрять применение хелатных комплексов железа для терапии дефицита железа и анемии у людей. Хотя данная группа препаратов появилась гораздо раньше, и использовалась изначально в качестве пищевых добавок и в ветеринарии.
В 1893 году Альфред Вернер выдвинул постулат о новой молекулярной структуре, характеризующей эти стабильные молекулы. Спустя несколько лет, в 1920 году Морган и Дрю применили термин «хелат» к молекулярной структуре, постулированной Вернером. 7
Небольшие белковые молекулы легче усваиваются, поэтому организм объединяет неорганические минералы с аминокислотами, чтобы воспользоваться сродством кишечника к всасыванию белка. Этот процесс связывания называется хелатированием (key-lay-shun).10
Хелаты металлов представляют собой комплексные соединения металла с аминокислотой.
В отличие от солей металлов, лиганд в хелатном комплексе отдает электроны катиону, делая тем самым молекулу ионно-нейтральной, устойчивой
к разным факторам, действующим в желудочно-кишечном тракте (рН, пища), а низкая молекулярная масса
способствует максимальному усвоению железа
при пероральном приеме.8
Хелатные комплексы легче проникают
через стенку кишечника и
лучше усваиваются
, не нарушая ионный и минеральный баланс клетки.10
Бисглицинат железа состоит из одной молекулы железа, которая соединена с карбоксильными группами двух молекул глицина при помощи ковалентных связей.
Соотношение железа к лиганду 1:2 нейтрализует валентность железа, что обеспечивает его стойкость к разным факторам, действующим в желудочно-кишечном тракте (рН, пища). Поэтому соединение хелата не поддается гидролизации в желудке, полностью абсорбируется в тонком кишечнике и в неизмененном виде попадает внутрь энтероцитов, где и происходит высвобождение молекулы железа.8
Бисглицинат железа
— это источник негемированного железа. После перорального применения соединение в неизмененном виде попадает в энтероциты, где гидролизируется на железо и глицин. Стабильность соединения бисглицината железа объясняется тем, что оно не гидролизируется при разных значениях рН, а низкая молекулярная масса (204 г/моль) способствует максимальному усвоению железа при пероральном приеме.8
- Таким образом, в желудочно-кишечном тракте не образуются свободные молекулы железа.
- Отсутствие контакта неионизированного железа со слизистой̆ оболочкой̆ желудка минимизирует возможные побочные явления.
- Бисглицинат железа может связываться с двумя видами рецепторов: DMT-1 (находятся на дуоденальных ворсинках) и PEPT-1 (локализуются на протяжении всего гастроинтестинального тракта).9
- Такая особенность хелата существенно повышает уровень абсорбции железа в желудочно-кишечном тракте, которая в 3,4 раза выше, чем у сульфата железа, взаимодействующего только с DMT1-рецепторами.9
- Ионно-нейтральная молекула не вступает в реакцию с другими питательными веществами и не нарушает их всасывание.10
- Целиакия провоцирует возникновение железодефицитного состояния. Бисглицинат железа — это единственное средство, которое эффективно устраняет дефицит железа у пациентов с целиакией за счет двойного механизма абсорбции: связывание с рецепторами DMT-1 и PEPT-1.11
- Биодоступность бисглицината железа приближается к 90–100%. 9
В составе Multizan® Феррум бисглицинат железа представлен запатентованным комплексом Ferrochel® компании Albion Minerals — мировым лидером и новатором в области минерального аминокислотного хелатного питания.
Уникальная гамма хелатных минералов Albion®:
- Максимально всасываются и легко усваиваются.
- Не взаимодействует с другими питательными веществами.
- Устойчивы к кислой среде желудка (рН).
- Подходит для вегетарианцев.
- Кошерный, сертифицированный продукт.
- Без глютена и ГМО.
- Безопасность применения бисглицината железа признана EFSA (Европейским агентством по безопасности продуктов питания) и FDA (Управление по санитарному обзору за качеством пищевых продуктов и медикаментов, США).12
Даже с повышенной биодоступностью бисглицинат железа безопасен. Всасывание контролируется запасами железа
в организме, при этом большие количества обычно усваиваются людьми с более низким статусом железа. Организм, страдающий железодефицитной анемией, может потреблять 90% железа, в то время как организм, не страдающий железодефицитной анемией, может потреблять всего 10%, или ровно столько, сколько необходимо организму для компенсации потерь в метаболизме. Было обнаружено, что бисглицинат железа Ferrochel®
в 2,6 раза безопаснее
, чем сульфат железа, и безопаснее, чем обычное неорганическое железо, содержащееся в пищевых продуктах и пищевых добавках.13
Сравнительная таблица доз LD50 (cредняя доза вещества, вызывающая гибель половины членов испытуемой группы) различных препаратов железа при пероральном введении белым мышам.14, 15, 16
- Бисглицинат железа обладает наибольшим профилем безопасности
- Острая пероральная LD50 бисглицината железа Ferrochel 2800 мг / кг веса тела — самая высокая доза среди всех препаратов железа
- Уровень отсутствия наблюдаемых побочных эффектов(NOAEL) составляет не менее 500 мг на кг веса
Multizan® Феррум — высокоэффективное и легкоусваиваемое железо с отличной переносимостью
Литература:
- https://www. who. int/nutrition/topics/ida/ru/
- WHO global database of anemia, 1993-2005
- WHO meeting report. Preconception care to reduce maternal and childhood mortality and morbidity, 2012
- «Лекарственные средства, применяемые для профилактики и лечения железодефицитных состояний» Круглов Д. С. Новосибирский Государственный медицинский университет. «Научное обозрение. Медицинские науки» № 4/2017
- Грибакин С. Г. Значение продуктов детского питания, обагащенных железом, в профилактике железодефицитной анемии / С. Г. Грибакин // Вопросы современной педиатрии. — 2002. — т. 1, No 5. — С. 52–56.
- https://medi. ru/info/3878/ Мальтофер
- Stephen D. Ashmead The chemistry of ferrous bis-glycinate chelate Archivos Latinoamericanos de Nutrición ALAN v.51 n.1 supl.1 Caracas mar. 2001
- DeWayne H. A. Arch. Latino Am. De Nutr., 2001, 51 (1), 7-12
- Oscar Pineda, H. DeWayne Ashmead Effectiveness of Treatment of Iron-Deficiency Anemia in Infants and Young Children With Ferrous Bis-glycinate Chelate Nutrition 17:381–384, 2001
- https://www. albionferrochel. com/index. php/iron-importance/ferrochel
- М. Бертини, О. Г. Шадрин «Коррекция дефицита железа у детей: мнение экспертов» 2018; https://health-ua.com/article/40109-korrektciya-defitcita-zheleza-u-detej-mnenie-ekspertov
- https://www.albionminerals. com/human-nutrition/products-trade/mineral-applications/dietary-supplements
- https://www.albionferrochel. com/index. php/effectiveness
- Geisser с соавторами, 1992; Forster с соавторами, 1993.
- Borzelleca, J, and Jeppsen, R., Food and Chemical Toxicology 37 (1999) 723-731 Safety evaluation of ferrous bisglycinate chelate
- Toxicology and safety of Ferrochel and other iron amino acid chelates Latinoarm. Nutr. 2001 Mar;51(1 Suppl 1):26-34.
- А. Г. Румянцева, И. Н. Захаровой «ДИАГНОСТИКА И ЛЕЧЕНИЕ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ДЕТЕЙ И ПОДРОСТКОВ» МЗ РФ, уч. пособие, Москва, 2015
вернуться к списку новостей
Как повысить эффективность лечения
Для снижения вероятности побочных эффектов препараты солей железа принимают до еды.
Всасываемость железа выше при одновременном приеме с аскорбиновой и янтарной кислотами, фруктозой, цистеином. Это свойство используется в некоторых комбинированных препаратах.
Всасывание железа уменьшается под влиянием некоторых веществ из пищи или лекарств. Так, его уменьшают танин (крепкозаваренный чай), соли кальция (в молоке или препаратах), магний и марганец (в минеральных комплексах или антацидных препаратах, типа фосфалюгеля), тетрациклиновые антибиотики, фосфорная и фитиновые кислоты (семена злаковых, бобовые). Это влияние сглаживается при использовании препаратов на основе трехвалентного железа.
Всасывание железа повышается при тяжелом железодефиците. Поэтому стоит внимательнее относится к назначенной дозировке. Врачи часто отталкиваются от лечебной дозы в 200 мг иона железа/сутки. Если вы понимаете, что препарат железа вам не подходит из-за развития побочных реакций, трудностей приема, отсутствия улучшения самочувствия, скажите об этом врачу. Ни в коем случае не меняйте дозировку препарата самостоятельно. Превышение дозы может привести к передозировке и отравлению, снижение дозы — к бесполезному приему и отсутствию эффекта.
Как оценивают эффективность лечения
В первые дни лечения препаратами железа оцениваются физические ощущения.
При лечении анемии, на 5-8-й день лечения определяют ретикулоцитарный криз (увеличение числа ретикулоцитов по сравнению с исходным значением, обычно на 2–3% или 20–30‰).
Через 4 недели лечения оценивают прирост гемоглобина. Повышение концентрации гемоглобина к концу первого месяца лечения препаратами железа на 10 г/л говорит о правильно подобранной дозе и эффективности терапии. После восстановления гемоглобина терапию продолжают для насыщения депо железа, при этом доза препарата снижается в 2 раза.
При скрытом дефиците железа применяют половинные дозы препаратов на протяжении 4-8 недель. Насыщение депо определяется с помощью комплексного биохимического исследования (ферритин, трансферрин, ОЖСС).
В Lab4U вы можете сдать анализы для выявления железодефицита и контролировать эффективность терапии со скидкой до 50%.
Введение
Железодефицитная анемия (ЖДА) – одно из самых распространенных заболеваний в мире [1, 2], а среди женщин фертильного возраста она находится на первом месте по частоте встречаемости, нередко являясь осложнением беременности и родов, а также ряда гинекологических заболеваний [3–7]. Еще одна группа пациентов, особенно часто страдающая ЖДА, – это дети раннего возраста [8, 9], при этом у них ЖДА составляет около 90% от всех анемий. Тем не менее любой человек вне зависимости от пола и возрастной группы имеет довольно высокий риск встретиться с этой проблемой на том или ином этапе своей жизни. Среди населения земного шара заболеваемость ЖДА распределяется неравномерно. По данным экспертов Всемирной организации здравоохранения (ВОЗ), в развивающихся странах она в несколько раз выше, чем в развитых. Размах колебаний распространенности ЖДА в популяции составляет от 5 до 40% и более [10].
ЖДА – заболевание полиэтиологическое, оно может иметь множество различных причин и предрасполагающих факторов [11]. В их число входят социально-экономические условия, доступность медицинской помощи, особенности питания, уровень санитарной культуры, распространенность паразитарных инвазий и многие другие.
Этиология и патогенез ЖДА
Развитие ЖДА связано с дефицитом железа в организме, который в свою очередь может оказаться следствием нарушения поступления, усвоения или повышенных потерь данного микроэлемента. В различных половозрастных группах преобладающие причины ЖДА распределяются следующим образом:
- у женщин фертильного возраста [3–7]: обильные менструальные кровотечения и меноррагии (в т.ч. вследствие патологии репродуктивной системы, такие как эндометриоз и фибромиома),
- беременность (в зоне особого риска многоплодная беременность, сопровождающаяся ранними гестозами),
- роды (в особенности повторные с небольшими интервалами между ними, а также осложненные кровотечениями),
- выкидыши, частые аборты,
- лактация;
- кровопотери вследствие патологии желудочно-кишечного тракта – ЖКТ (пищеводные кровотечения, язвенная болезнь желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона, полипоз, трещины прямой кишки, геморрой, опухоли и др.),
- дефицит железа при рождении,
Железо играет важную роль в функционировании всех органов и систем. Оно является ключевым элементом молекулы гемоглобина, выступая в качестве компонента протопорфириновой простетической группы, отвечает за связывание и транспорт кислорода. Также железо принимает участие в процессе окислительного фосфорилирования в митохондриях клеток, в синтезе коллагена, метаболизме порфирина, в значительных количествах присутствует в миоглобине мышц, а также необходимо для полноценного функционирования иммунной системы [1]. И все же участие железа в процессах тканевого дыхания определяет основную биологическую значимость данного микроэлемента. Закономерно, что при развитии ЖДА одной из наиболее существенных проблем становится именно тканевая гипоксия и патология, которую она провоцирует [23–25].
В качестве натурального источника железа выступает пища, с которой при нормальном полноценном рационе ежедневно поступает около 10–20 мг этого микроэлемента. Из этого количества усваивается не более 10% (около 2 мг), что обеспечивает ежесуточную потребность в железе. В то же время большинство здоровых менструирующих женщин ежемесячно теряют до 20–30 мг железа. Аналогичная или еще более критическая ситуация может складываться и при некоторых хронических заболеваниях. Утраченное бывает сложно восполнить поступлением железа из пищи, даже если его содержание в рационе довольно велико. Проблема усугубляется при наличии нарушений всасывания и усвоения железа. Постепенно развивающийся дисбаланс между поступлением и потерей железа истощает его запасы в организме, приводя к железодефицитному состоянию, в частности к ЖДА с прогрессирующей гемической гипоксией и сопровождающими ее метаболическими расстройствами.
В зависимости от преобладающего механизма развития железодефицита анемии подразделяют на следующие группы [25]:
- связанные с кровопотерей;
- связанные с нарушением всасывания железа;
- связанные с повышенной потребностью в железе;
- алиментарно-зависимые.
В отдельных случаях могут иметь место признаки из нескольких групп с различной степенью выраженности.
Клинические проявления и диагностика ЖДА
Из основных клинических проявлений для ЖДА характерны гипоксический и сидеропенический синдромы [1, 2, 27, 28].
Признаки, составляющие гипоксический синдром:
- бледность кожи и видимых слизистых оболочек;
- учащенное сердцебиение;
- шум в ушах;
- головная боль, головокружение;
- общая слабость;
- потеря аппетита;
- снижение работоспособности, концентрации внимания, ухудшение памяти.
Составляющие сидеропенического синдрома:
- извращение вкуса и обоняния;
- сухость кожных покровов, пигментации («кофе с молоком»);
- деформации и изменения структуры ногтей (поперечная исчерченность, вогнутость, истончение, ломкость);
- ухудшение состояния волос (ломкость, тусклость, расщепление кончиков, выпадение вплоть до алопеции);
- проявления ангулярного стоматита («заеды»);
- жжение в языке.
Помимо перечисленных симптомов возможны также развитие неврозоподобных расстройств, проявление неврастении, нарушения периферического кровообращения и микроциркуляции, снижение толерантности к физической нагрузке, изменения метаболизма в миокарде, приводящие при длительном течении ЖДА к нарастающим явлениям миокардиодистрофии, а также к сдвигам вегетативной регуляции сердечной деятельности в сторону симпатикотонии.
Отмечаются негативные изменения в работе ЖКТ. Пациенты с ЖДА нередко страдают хроническими гастритами и патологией кишечника. Синдромы нарушения всасывания железа в кишечнике нередко носят вторичный характер, при этом еще более усугубляя железодефицит [17]. В качестве причин снижения секреции и кислотообразования при ЖДА в настоящее время рассматриваются регенеративные нарушения в слизистой оболочке желудка.
ЖДА негативно сказывается на состоянии иммунной системы [29]. Так, железодефицит опосредованно нарушает работу клеточного звена противоинфекционного иммунитета: замедляется пролиферация лимфоцитов, снижается микробицидная активность гранулоцитов. Это может приводить к некоторому повышению риска развития инфекций и их неблагоприятного течения.
Перечисленное многообразие клинических проявлений ЖДА, резко снижающих качество жизни пациентов, еще раз подчеркивает особую важность своевременной диагностики и полноценной коррекции данного состояния. Отдельной проблемой является низкая специфичность большинства клинических симптомов [28], что затрудняет уверенную диагностику ЖДА исключительно на их основе.
В связи с этим решающее значение в постановке диагноза этого заболевания имеют лабораторные данные, в т.ч. общий анализ крови:
- оценка гематокрита (диагностический признак – его снижение);
- исследование числа эритроцитов и ретикулоцитов в крови (число эритроцитов может быть в пределах нормы или снижено, ретикулоцитоз не характерен, но может наблюдаться при кровотечениях);
- определение средней концентрации и среднего содержания гемоглобина в эритроцитах (эти показатели снижены, что отражает гипохромию эритроцитов); определение формы и размеров эритроцитов (характерен анизоцитоз со склонностью к микроцитозу).
При подозрении на ЖДА рекомендуется также исследовать такие показатели обмена железа, как уровень ферритина (снижается), трансферрин сыворотки и железосвязывающая способность сыворотки (повышаются), сывороточное железо и коэффициент насыщения трансферрина железом (снижаются).
Для успешного лечения важно также определить причину развития ЖДА, возможные источники кровопотери, сопутствующие заболевания. С этой целью используются рентгеновское исследование органов грудной клетки, ультразвуковое исследование органов брюшной полости, малого таза, забрюшинного пространства; электрокардиография, эзофагогастродуоденоскопия, колоноскопия, а также биохимический анализ крови, общий анализ мочи и др. Результаты базовых исследований помогают выбирать направление дальнейшего диагностического поиска.
Лечение ЖДА
Цель лечения – введение в организм железа в количестве, достаточном для нормализации уровня гемоглобина и восполнения тканевых депо железа [30–32]. При этом нормальные значения уровня гемоглобина для женщин составляют 120–140 г/л, для мужчин – 130–160 г/л, а уровень ферритина сыворотки выше 40–60 мкг/л свидетельствует об удовлетворительном накоплении железа в депо. В данном обзоре рассматривается коррекция ЖДА исключительно фармакологическими средствами. Вместе с тем в ряде случаев (тяжелая степень ЖДА, сопутствующая сердечно-сосудистая патология с угрозой декомпенсации на фоне железодефицита и т.п.) в индивидуальном порядке может назначаться сопутствующая терапия препаратами эритропоэтина, а также гемотрансфузионная терапия.
Приступая к лечению ЖДА, необходимо помнить, что анемию невозможно скорректировать витаминно-минеральными комплексами, содержащими железо. Подавляющему большинству пациентов с ЖДА необходимы специальные железосодержащие препараты [32]. Приоритетен пероральный прием как более удобный и безопасный способ применения таких лекарственных средств [33–35]. Парентеральные препараты железа применяются лишь при наличии противопоказаний к назначению пероральных, их плохой переносимости или неэффективности. При этом рекомендован только внутривенный путь введения. Внутримышечные инъекции железосодержащих лекарственных средств малоэффективны и опасны, т.к. могут вызывать инфильтраты и даже развитие миосарком.
В настоящее время отдается предпочтение терапевтическим схемам, предполагающим прием 100–200 мг элементарного железа в сутки для взрослых (оптимальная доза, рекомендованная ВОЗ, – 120 мг/сут). Применение более 300 мг железа в сутки нецелесообразно, т.к. это обычно не увеличивает объема всасывания, в то же время повышая риск развития нежелательных побочных эффектов (расстройства стула, признаки раздражения желудка и др.) [36]. Рассчитывая суточную и курсовую дозы, принимают во внимание степень тяжести анемического синдрома, висцеральные поражения, а также уровень сывороточного железа.
Современная фарминдустрия предлагает довольно широкий спектр препаратов железа, которые различаются по своему количественному (высоко- и низкодозированые) и качественному составам (односоставные, комбинированные). Пероральные препараты железа также условно разделяют на ионные (солевые) двухвалентные (из солей железа чаще всего используется сульфат) и неионные (несолевые) препараты трехвалентного железа на основе гидроксида полимальтозного комплекса (ГПК) и протеина сукцинилата [37, 38]. В рандомизированных исследованиях последних лет доказана равнозначная эффективность обеих групп. Для более успешного результата параллельно с препаратами железа целесообразно назначать витамины. Например, аскорбиновая кислота позволяет обеспечивать лучшее всасывание и усвоение железа [39] и полноценное протекание пластических процессов в организме.
Следует помнить, что лечебный эффект препаратов железа, как правило, развивается довольно медленно, поэтому ферротерапия – процесс длительный. В зависимости от выраженности железодефицита лечение может продолжаться от 1 до 3 месяцев и более. Вместе с тем накапливаются данные об успешном применении низкодозированных препаратов прерывистыми курсами (2 недели в месяц), а также о преимуществах лечения в альтернирующем режиме – через день в течение месяца [40]. Перечисленные схемы дают гораздо меньшую частоту побочных эффектов без потери эффективности. Во избежание побочных эффектов и в целях повышения приверженности пациентов терапии имеет смысл воздерживаться от неоправданного назначения высокодозированных препаратов и многократных приемов в течение дня.
Экспертами ВОЗ рекомендуется применение препаратов с замедленным высвобождением железа [41]. Это позволяет уменьшать кратность приема лекарственного средства, одновременно улучшать его абсорбцию и переносимость. Продолжительность их приема определяется индивидуально с учетом лабораторных показателей. Основной курс лечения продолжается до достижения оптимального уровня гемоглобина и восстановления показателей обмена железа в сыворотке крови. Далее с целью пополнения тканевых депо может потребоваться продление приема препарата на срок до 2 месяцев. При значительной выраженности железодефицита общая длительность лечения пероральными препаратами с замедленным высвобождением железа обычно составляет от 3 до 6 месяцев [37, 41, 42].
Контроль эффективности лечения ЖДА
Контроль эффективности лечения препаратами железа осуществляется путем мониторинга следующих лабораторных показателей [42]:
- гемограмма;
- ферритин;
- железосвязывающая способность сыворотки;
- трансферрин.
При адекватной терапии самочувствие пациентов улучшается уже на 5–6-й день приема препарата. На 7–12-й день следует ожидать ретикулоцитарного криза – увеличения ретикулоцитов в 2 и более раз от исходных значений. Концентрация гемоглобина начинает расти примерно через 2,5–3 недели лечения. К концу 4-й недели она должна повыситься на 10 г/л. Полная нормализация данного показателя обычно отмечается не ранее чем через месяц от начала лечения. Показатели гемограммы при нетяжелой анемии обычно возвращаются к норме через 5–8 недель ферротерапии. Важно проводить динамический контроль уровня гемоглобина в процессе лечения и после окончания курса. Данный показатель должен контролироваться ежемесячно в течение года, что позволяет решать вопрос о необходимости поддерживающего лечения.
В случае когда целевого уровня гемоглобина и нормального уровня ферритина сыворотки достичь не удается, следует исключить состояния, препятствующие всасыванию железа, а также вероятность неблагоприятного лекарственного взаимодействия (например, с антацидами).
Профилактика ЖДА
Первичная профилактика ЖДА и латентного железодефицита представляет собой в первую очередь полноценное сбалансированное питание человека в любом возрасте. Вторичной профилактике ЖДА способствуют регулярные профилактические обследования населения с целью своевременной диагностики и лечения заболеваний, способных приводить к недостатку железа в организме. При этом центральное место занимает проведение скрининговых исследований для выявления железодефицитных состояний [43]. Следует помнить о группах риска по развитию латентного железодефицита и ЖДА. К ним относятся люди с неустранимыми причинами развития железодефицита (хроническая кровопотеря, синдром мальабсорбции, целиакия, программный гемодиализ, неоперабельные опухоли и др.), веганы и вегетарианцы, регулярные доноры крови, беременные женщины. Им рекомендуется дополнительный профилактический прием препаратов железа.
Заключение
ЖДА представляет собой очень серьезную и довольно распространенную проблему, и в настоящее время медицинское сообщество занимается активным поиском оптимальных путей ее решения. Уже достигнуты определенные успехи путем разработки эффективных и безопасных препаратов для лечения и профилактики железодефицитных состояний. Грамотная фармакологическая коррекция ЖДА позволяет улучшать качество жизни и повышать работоспособность у абсолютного большинства пациентов с подобным диагнозом. При этом желательно использовать современные препараты, технологии производства которых обеспечивают максимально возможную биодоступность железа, а также сводят к минимуму риск развития самых распространенных побочных эффектов от ферротерапии.