Згідно з критеріями ВООЗ, критерієм анемії є зниження рівня гемоглобіну менш як 130 г/л у чоловіків та менш як 120 г/л у жінок. Частота анемії коливається від 8% у 70-річних осіб до більш як 40% в осіб віком більше 85 років. Нещодавніми дослідженнями встановлено, що похилий вік безпосередньо не зумовлює анемії, проте збільшує схильність до її розвитку. Клінічна класифікація анемій (таблиця 1) базується на морфологічному принципі — визначенні середнього еритроцитарного об’єму1 (СЕО). Проте в багатьох хворих похилого віку анемія може не супроводжуватися зміною розміру еритроцитів. Найчастіші етіологічні чинники анемії подано в таблиці 3.
1 Визначається за допомогою автоматичних лабораторних аналізаторів або за такою формулою: СЕО = (гематокрит х 10) / кількість еритроцитів (у млн/л). (Прим, перекл.)
Таблиця 1. Класифікація анемій
Макроцитна анемія (СЕО>100 фл)
|
Мікроцитна анемія (СЕО<80 фл)
|
| Нормоцитна анемія (СЕО 80–100 фл) Підвищена втрата або руйнування еритроцитів (ІСР2 > 2)
Зниження синтезу еритроцитів (ІСР < 2)
|
2Індекс синтезу ретикулоцитів (ІСР) = кількість ретикулоцитів (%)х гематокрит/45 х 1/2. ІСР більш достовірний, ніж абсолютна кількість ретикулоцитів, оскільки враховує ступінь анемії та подвоює тривалість життя ретикулоцитів. У нормі ІСР становить 1. (Прим, перекл.)
Таблиця 2. Етіологія зміни форми еритроцитів (за М. Е. Conrad, 2004)
| Форма еритроцита | Морфологія | Характерні захворювання |
| Сфероцит | Втрата просвітлення у центрі клітини, інтенсивніше зафарбування, часто мікроцитного розміру | Спадковий сфероцитоз, деякі види набутої гемолітичної анемії |
| Клітина-мішень | Гіпохромна клітина з центральним накопиченням гемоглобіну у формі «мішені» | Захворювання печінки, таласемія, гемоглобін D, стан після спленектомії |
| Лептоцит | Гіпохромна клітина нормального діаметру із зниженим СЕО | Таласемія |
| Овалоцит | Овальної або сигароподібної форми | Вроджений овалоцитоз, деякі види анемій (особливо в разі дефіциту вітаміну В12 та фолієвої кислоти) |
| Шистоцит | Фрагментовані еритроцити трикутної форми або у вигляді шолому | Мікроангіопатична анемія, штучний клапан серця, уремія, злоякісна гіпертензія |
| Стоматоцит | Еритроцит з щілиновидним центральним просвітленням | Захворювання печінки, гострий алкоголізм, злоякісні захворювання, вроджений стоматоцитоз, артефакт |
| Краплеподібна | Краплеподібний, часто мікроцитний еритроцит | Мієлофіброз, інфільтрація кісткового мозку пухлиною, таласемія |
| Акантоцит | Наявність 5–10 відростків різної довжини на поверхні еритроцита, розміщених нерівномірно | Абеталіпопротеїнемія, недостатнє харчування, хвороби печінки. |
| Ехіноцит | Рівномірно розташовані відростки на поверхні еритроцита (як звичайно, 10–30) | Уремія, виразкова хвороба шлунка, рак шлунка, дефіцит піруваткінази, артефакт |
| Серповидна | Серповидна клітина | Гемоглобін S, деякі види гемоглобіну С та І |
Таблиця 3. Найчастіша етіологія анемії
|
Діагностика анемії3
В осіб похилого віку типова симптоматика (загальна слабість, задишка, нездужання) часто виникає при менш вираженій анемії, ніж у пацієнтів молодшого віку. Анемія також спричинює погіршення перебігу інших захворювань, зменшення рухливості, запаморочення, когнітивні порушення і навіть депресію. Тому в пацієнтів з погіршенням перебігу серцевих або легеневих захворювань слід виключити наявність анемії.
Ниркова недостатність є важливим етіологічним чинником анемії в пацієнтів будь-якого віку. Хоча функція нирок стабільно знижується з віком, при відсутності захворювання нирок ця зміна є незначною. Оскільки анемія внаслідок ниркових причин виникає тільки при виражених порушеннях функції нирок, ці вікові зміни, очевидно, не пов’язані з випадками значної анемії в осіб похилого віку.
Таблиця 4. Показання для обстеження з приводу анемії
|
Таблиця 5. Тести для первинного обстеження з приводу анемії
Додаткові тести
|
3Див. також статтю
«Діагностичний алгоритм при анеміях». —
Медицина світу. — 1996. ч. 1. с. 3–9.
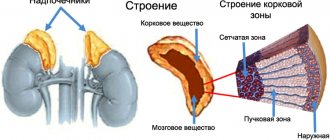
Нормоцитарная анемия при эндокринных заболеваниях
Нормоцитарная нормохромная анемия чаще всего сопутствует следующим патологиям:
- Болезнь Кушинга.
- Гиперпаратиреоз.
- Тиреотоксикоз.
- Болезнь Аддисона.
- Гипоандрогения.
- Пангипопитуитаризм.
Эндокринные железы продуцируют гормоны, которые принимают непосредственное участие в выработке эритропоэтина. Поэтому поражение желез внутренней секреции приводит к сбою в системе кроветворения.
Что касается лабораторных данных картины крови, то они имеют схожесть с лабораторными данными, полученными при почечной недостаточности.
Залізодефіцитна анемія
Дефіцит заліза спричинює анемію у 10–15% пацієнтів похилого віку. Етіологічним фактором, як звичайно, є хронічна крововтрата через ШКК (див. таблицю 6) і рідко — недостатнє споживання заліза з їжею. Така крововтрата часто буває безсимптомною, її не можна виключити лише на підставі негативного тесту на приховану кров у калі. Тому після виявлення ЗДА у такої категорії хворих слід провести обстеження ШКК, особливо для виключення малігнізації. Найчастіше трапляється патологія верхніх відділів ШКК, спричинюючи 40–50% випадків ЗДА в літніх людей. Важливо обстежити верхні та нижні відділи ШКК, оскільки в 10–15% пацієнтів одночасно співіснують дві патології. Під час езофагогастродуоденоскопії (ЕГДС) слід взяти біопсію слизової шлунка та дванадцятипалої кишки для виключення інфекції Helicobacter pylori
та целіакії. Якщо пацієнтові неможливо виконати ЕГДС, треба зробити рентгеноскопію верхніх відділів ШКК з контрастуванням барієм, серологічні тести для виявлення
Н. pylori,
визначити рівень антитіл проти трансглютамінази та імуноглобулінів (для виключення целіакії). При наявності протипоказань до колоноскопії можна провести іригоскопію з барієм. У 40% хворих із ЗДА не вдається встановити етіологію кровотрати, незважаючи на ретельне обстеження. На щастя, ці пацієнти одужують після залізозамісної терапії і часто немає потреби в повторному обстеженні.
Найспецифічнішим тестом для діагностики ЗДА є визначення рівня феритину
всироватці крові, який вказує на величину запасів заліза. Рівень феритину часто знижується ще перед зниженням середнього еритроцитарного об’єму, особливо на ранніх стадіях ЗДА. При прогресуванні дефіциту заліза величина СЕО знижується разом з гемоглобіном. Рівень феритину <15 мкг/л свідчить про дефіцит заліза, а при його величині більш як 100 мкг/л діагноз ЗДА можна виключити. Оскільки феритин — білок гострої фази запалення, його рівень може бути хибно підвищеним унаслідок виділення цитокінів при запаленні, інфекції або злоякісному захворюванні, а хибно зниженим — при вагітності, особливо під час другого та третього триместру.
Якщо рівень феритину сумнівний (у межах 15–100 мкг/л), слід визначити рівень рецепторів до трансферину
(у нормі він становить 2–9 мг/л). Рецептор до трансферину — трансмембранний глікопротеїн, який зв’язується з циркулюючим трансферином, що переносить один або два атоми заліза. Завдяки цьому рецепторові трансферин із залізом транспортується в цитоплазму, де залізо звільняється, а білок знову повертається на поверхню клітини та виділяється у кров. Прогресуюче зниження запасів заліза проявляється зниженням рівня феритину в сироватці крові, а зниження вмісту функціонального заліза у тканинах — підвищенням рівня рецепторів до трансферину. Рецептор до трансферину не є білком гострої фази запалення, тому на його рівень не впливає запалення, інфекція, злоякісне захворювання чи вагітність. При ЗДА рівень рецепторів до трансфертну підвищується, навіть ще до появи змін у СЕО.
Рівень заліза в сироватці крові4,
як звичайно, знижений, а
загальна залізозв’язуюча здатність сироватки крові5
— підвищена.
4У нормі становить 8,1–31,3 мкмоль/л у чоловіків і 5,4–31,3 мкмоль/л у жінок. (Прим. перекл.)
5У нормі становить 39,4–75,2 мкмоль/л. (Прим. перекл.)
Таблиця 6. Етіологія кровотечі з ШКК
|
Лікування ЗДА полягає в ліквідації джерела крововтрати (у міру можливості) та замісному лікуванні препаратами заліза.
Анемія, спричинена хронічними захворюваннями
Анемія, спричинена хронічними захворюваннями (АХЗ), є найчастішою причиною анемії у хворих похилого віку та другим за частотою етіологічним чинником анемії у світі (після залізодефіцитної анемії). Ця анемія виникає внаслідок дії цитокінів, які виділяються у відповідь на багато гострих та хронічних захворювань (див. таблицю 8). АХЗ у типових випадках проявляється нормохромною нормоцитною анемією з СЕО у межах норми (80–100 фл), хоча також може бути дещо мікроцитною (СЕО <80 фл). Якщо рівень гемоглобіну нижчий ніж 100 г/л, слід виключити поєднання АХЗ з іншим етіологічним чинником анемії. Реакція кісткового мозку на АХЗ є неадекватною, тому індекс синтезу ретикулоцитів значно нижчий від 2. Кількість ретикулоцитів, рівень заліза сироватки крові, загальна залізозв’язуюча здатність та насиченість трансферину6
є зниженими, а рівень
феритину
як білка гострої фази запалення— підвищений (але може бути нормальним). Іноді для підтвердження діагнозу необхідно провести біопсію кісткового мозку.
6У нормі становить 20–50%. (Прим. перекл.)
Найспецифічнішим тестом для диференціальної діагностики залізодефіцитної анемії (ЗДА) та анемії, спричиненої хронічними захворюваннями (АХЗ), є визначення рівня феритину: його рівень більш як 100 мкг/л практично дає підставу виключити ЗДА, а величина менш як 15 мкг/л підтверджує діагноз ЗДА. У хворих з хронічними запальними захворюваннями співвідношення рівня рецепторів до трансферину в сироватці крові до рівня феритину звичайно менше як 50, а при переважанні дефіциту заліза — зростає понад 50.
Лікування АХЗ полягає в терапії первинного захворювання. Хоча специфічного лікування немає, результати застосування еритропоетину в деяких хворих з раком або ВІЛ-інфекцією з рівнем цього гормону у плазмі крові менш як 500 МО/мл є обнадійливими. Якщо на підставі середнього рівня феритину підозрюється наявність дефіциту заліза, для диференціальної діагностики між ЗДА та АЗХ може бути корисним лікування ex juvantibus препаратами заліза.
Таблиця 7. Диференціальна діагностика залізодефіцитної анемії (ЗДА) та анемії, спричиненої хронічними захворюваннями (АХЗ)
| Лабораторний тест | ЗДА | АХЗ |
| Рівень заліза в сироватці крові | ↓ | ↓ |
| Загальна залізозв’язуюча здатність | ↑ | ↓ |
| Насиченість трансферину | ↓ | ↓ |
| Рівень феритину в сироватці крові | ↓ | N або ↑ |
Таблиця 8. Захворювання, які можуть супроводжуватися АЗХ
| Група захворювань | Приклади |
| Гострі інфекції | Бактеріальні, грибкові, вірусні |
| Хронічні інфекції | Туберкульоз, ендокардит, інфекція сечових шляхів, кокцидіомікоз та інші хронічні грибкові інфекції |
| Неінфекційні хронічні запальні захворювання | Артроз, ревматоїдний поліартрит, ревматична поліміальгія, гострий та хронічний гепатит |
| Злоякісні захворювання | Метастатична карцинома, гематологічна онкологія |
| Гострі стани | Операції, значна травма |
| Інші захворювання | Цукровий діабет, застійна серцева недостатність, недоїдання, пролежні |
Таблиця 9. Етіологія недостатності функції кісткового мозку
Первинна недостатність функції кісткового мозку
|
7Див. також статтю Рекомендації щодо скринінгу та лікування хворих із хронічними захворюваннями нирок. —
Медицина світу. — 2003. — Т. 13, ч. 5. — С. 231-235.
Предпосылки к возникновению
Существует несколько причин развития патологии.
- Ревматоидный артрит и анемия. Что нужно знать
- Зрелый возраст. Заболеванию в большей степени подвержены женщины старше 85 лет.
- Хронические воспаления, инфекции и злокачественные опухоли.
- Недостаток железа из-за постоянной потери крови, обусловленной такими патологиями, как рак кишки или язва желудка.
- Наследственность.
- Патологическое состояние почек.
Дефіцит вітаміну В12 та фолієвої кислоти
Дефіцит вітаміну В12 та фолієвої кислоти буває у 5–15% геронтологічних пацієнтів, спричинюючи, як звичайно, макроцитну анемію. Іноді СЕО може бути нормальним, тому при нормоцитарній анемії невідомої етіології слід виключити дефіцит цих вітамінів. У таблиці 10 подано основні етіологічні чинники дефіциту вітаміну В12 у хворих похилого віку. Гематологічні, неврологічні та психіатричні прояви можуть виникати одночасно, послідовно або незалежно один від одного. Якщо вміст В12 у крові8 не перевищує третини від норми, для підтвердження діагнозу слід визначити рівень метилмалонової кислоти та гомоцистеїну в сироватці крові (якщо їх концентрація нормальна, це виключає дефіцит В12). Підвищений рівень метилмалонової кислоти підтверджує наявність дефіциту вітаміну В12, а підвищення вмісту гомоцистеїну потребує дообстеження для виключення інших причин його зростання.
8У нормі становить 162–835 пмоль/л. (Прим, перекп.)
Таблиця 10. Основні етіологічні чинники дефіциту вітаміну В12 у хворих похилого віку
| Патофізіологічний механізм | Етіологічні чинники |
| Недостатнє надходження з їжею | Хронічний алкоголізм Хронічне недоїдання Сувора вегетаріанська дієта |
| Порушення абсорбції | Атрофічний гастрит Стан після гастректомії Надмірне розмноження бактеріальної флори в тонкому кишечнику Мальабсорбція Хвороба Крона Хронічний панкреатит Гастрит, зумовлений Helicobacter pylori |
| Порушення метаболізму | Медикаменти Дефіцит транскобаламіну II Аналоги антивітаміну B12 |
| Зниження запасів вітаміну B12 в організмі | Важкі захворювання печінки |
| Взаємодія з медикаментами | |
| Мальабсорбція | Метформін, антибіотики, дифенін, колхіцин, парааміносаліцилова кислота, холестирамін |
| Мальабсорбція харчових продуктів, які містять вітамін B12, інактивація метаболізму | Вітамін С, оксид азоту, інгібітори протонної помпи, антагоністи Н2-рецепторів |
Найчастіша причина дефіциту фолатів — недостатнє харчування. Гематологічні прояви подібні до дефіциту вітаміну В12, неврологічної симптоматики немає. У багатьох літніх пацієнтів буває нормоцитарна анемія. Вміст фолієвої кислоти в сироватці крові9 може бути хибно нормальним після їди, тому концентрація фолатів в еритроцитах10 більш специфічно відображає запаси цього вітаміну у тканинах. Якщо результат досягає нижнього значення норми, слід визначити рівень гомоцистеїну — у 90% випадків дефіциту фолатів його рівень підвищується. Рівень метилмалонової кислоти, як звичайно, нормальний.
9У нормі становить 7–28,1 имоль/л. (Прим, перекл.)
10 У нормі становить 422–1464 нмоль/л, (Прим, перекл.)
Лікування дефіциту вітаміну В12 полягає у внутрішньом’язовому його введенні в дозі 500–1000 мкг на день протягом 7–10 днів, потім дозу зменшують вдвічі і продовжують лікування ще 7–10 днів, з 14–20 дня переходять на введення препарату через день в дозі 500 мкг протягом 4–6 тижнів, після цього протягом 2 місяців триває підтримуюча терапія по 500 мкг 1 раз на тиждень, потім хворий повинен пожиттєво отримувати по 500 мкг вітаміну В12 двічі на місяць. У разі дефіциту фолієвої кислоти її призначають у дозі 1 мг на день per os
.
Почему возникает гипохромия
В медицине выделяют три основных причины развития гипохромии, зависящие от вида анемии:
- Обильные потери железа в результате кровотечений или чересчур интенсивный расход полезного элемента ведет к развитию железодефицитной анемии.
- Нарушение процесса всасывания железа в кишечнике, вследствие чего железо, попадающее с пищей, выводится из организма. В этом случае развивается сидероахрестический или смешанный типы. Часто такая гипохромия развивается на фоне медикаментозного лечения некоторыми препаратами.
- Малое попадание железа через продукты питания является источником анемии смешанного типа.
Чаще всего гипохромию провоцируют следующие факторы:
- несбалансированное питание, потребление пищи, практически не содержащей витаминов, железа, дефицит животного белка в рационе, авитаминоз;
- постоянные или периодически возникающие кровотечения (носовые, кишечные, желудочные), маточные кровотечения, длительные обильные менструации, кровоточивость десен;
- острая массивная кровопотеря;
- желудочно-кишечные патологии, препятствующие усвоению железа (энтериты, гельминтозы, острые/хронические инфекции, гастриты, дисбактериозы, болезнь Крона, нарушение абсорбции кишечника);
- отравление вредными токсическими веществами;
- оперативные вмешательства;
- вынашивание ребенка и грудное вскармливание;
- злокачественные заболевания крови и другие раковые новообразования;
- частые стрессовые ситуации, имеющие затяжной характер;
- хронические инфекционные болезни (туберкулез, воспаление легких, патологии печени/почек).
Кроме этого диагностируют гипохромную анемию по причине наличия у пациента аутоиммунных заболеваний (волчанка, васкулит, гломерулонефрит, ревматоидный артрит и др.), формирующих иммунные комплексы, содержащие эритроциты и в то же время вырабатывающие антитела против собственных красных кровяных телец.
Мієлодиспластичний синдром
Мієлодиспластичні сидроми (МДС) — патологія стовбурових клітин кісткового мозку, яка призводить до неефективного гемопоезу і, як наслідок, до різноманітних комбінацій анемії, нейтропенії та тромбоцитопенії. Ці синдроми іноді називають передлейкозними через їх здатність іноді трансформуватися в гострий лейкоз. МДС у хворих віком менше 50 років буває рідко, а у віці більш як 65 років його частота сягає 5%. Для підтвердження діагнозу необхідна біопсія кісткового мозку. Для цього захворювання характерна наявність хронічної цитопенії, гіперплазії кісткового мозку та морфологічної патології клітин-попередників у кістковому мозку.
Відповідь на лікування хіміотерапією, імуносупресорами, факторами росту (гранулоцито-стимулюючим гормоном та еритропоетином) є обмеженою, а виживання хворих не збільшується. Тому в найстарших пацієнтів лікування обмежується гемотрансфузіями та іншою симптоматичною терапією.
Підготував Богдан Борис
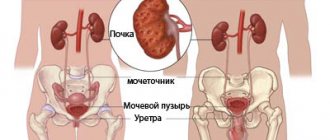
Нормоцитарная анемия при почечной недостаточности
Когда почки не в состоянии справляться со своими функциями, в организме снижается выработка эритропоэтина. Хроническая почечная недостаточность также способствует накоплению в организме уремических токсинов, которые препятствуют продукции эритропоэтина. Негативным образом на состоянии крови отражаются хронические кровопотери и прочие факторы. Это, в свою очередь, ведет к тому, что эритроциты быстро погибают, их уровень в крови снижается.
Также развитию анемии способствует проведение гемодиализа. Эту процедуру часто назначают для лечения хронической почечной недостаточности.
Показатели крови при нормоцитарной анемии на фоне патологий почек:
- Нормоцитарно-нормохромная анемия.
- Ретикулоцитоз с незначительным повышением.
- Тромбоцитопения.
- Снижение уровня эритропоэтина.
- Снижение уровня лейкоцитов.
В целом, патогенез нормоцитарной нормохромной анемии при хронической почечной недостаточности достаточно сложный, но ведущее значение принадлежит дефициту эндогенного эритропоэтина, что вызывает ускоренный апоптоз эритроидных клеток в костном мозге.