Зима. Пора каникул и новогодних посиделок. Семейные застолья, рестораны, встречи с друзьями, поездки в гости… Как не попробовать этот салатик с майонезом и те свиные ребрышки под острым соусом? Однако не всегда это заканчивается благополучно для нашего самочувствия. Новые продукты, новые способы приготовления… Новые токсины и старые бактерии. В вашей походной, да и в домашней аптечке непременно должно присутствовать средство «скорой помощи»: эффективный, быстродействующий и безопасный порошок от отравления Энтеродез.
Описание лекарства
Энтеродез – это медикамент из группы адсорбентов и детоксицирующих препаратов. Представляет собой гигроскопичный порошок белого или с желтым оттенком цвета. Присутствует незначительный лекарственный запах. Фасуется в специальные саше по 5 г. Пакетики продаются поштучно или в пачке по 3 штуки.
Основной компонент – медицинский поливинилпирролидон низкомолекулярный в количестве 5 г.
В лечении используют раствор, приготовленный на основе порошка. Он может не иметь цвета или иметь небольшой желтый оттенок, субстанция может быть прозрачной или немного мутноватой. На вкус слегка горьковатый.
В каких случаях поможет
Согласно инструкции Энтеродез принимают в целях разрушения и обезвреживания действия токсических элементов при:
- инфекционных болезнях органов желудочно-кишечного тракта в острой форме (сальмонеллезе, дизентерии, отравлениях продуктами, содержащими патогенные микроорганизмы и ядовитые вещества);
- печеночной недостаточности;
- почечной недостаточности.
Прием раствора показан при ОРВИ для снятия симптомов интоксикации, при аллергиях, злоупотреблении алкоголем, отравлении грибами.
Можно ли беременным и кормящим грудью женщинам
Применение Энтеродеза во время беременности и лактации серьезно не изучалось. Прием допускается с разрешения врача и в случае, если вероятная польза для здоровья женщины больше, чем возможность развития патологий у плода или ребенка.
Если женщина беременна, планирует забеременеть, предполагает, что может находиться в ожидании ребенка или кормит младенца грудью, то перед приемом медикамента нужно посетить врача для консультации.
Некоторые гинекологи назначают медикамент при токсикозе беременных и при сильной диарее.
Энтеросгель при беременности и в период лактации
В аннотации к препарату указано, что прием Энтеросгеля при беременности и во время грудного вскармливания не противопоказан. Так, лекарственное средство назначают для уменьшения выраженности проявлений токсикоза, при фетоплацентарной недостаточности (дисфункции плаценты), для лечения острых и хронических бактериальных, вирусных или грибковых влагалищных инфекций.
Энтеросгель при беременности не противопоказан
Как применять Энтеродез
По общему правилу лекарство принимают внутрь, через один-два часа после еды или приема другого лекарственного средства.
Порошок необходимо растворять в пропорции 2,5 г порошка на 50 мл прохладной прокипяченной воды/сока. Раствор можно подсластить сахаром для улучшения вкуса.
Взрослым необходимо принимать 100 мл раствора один-три раза в день. Продолжительность от двух дней до одной недели (пока не исчезнет симптоматика отравления).
Схема применения у детей в зависимости от возраста:
- 1-3 года – по 50 мл дважды в день;
- 4-6 лет – по 50 мл трижды в день;
- 7-10 лет – по 100 мл дважды в день;
- 11-14 лет – по 100 мл трижды в день.
При отсутствии тенденции к улучшению или усугублении состояния показано посещение врача. Нельзя изменять способ применения и рекомендуемые дозы самостоятельно.
Применение Энтеродеза в общеврачебной практике
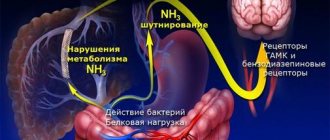
Хроническая экзогенная интоксикация в настоящее время развивается у пациентов в крупных промышленных городах при ежедневном вдыхании загрязненного воздуха, в том числе и при табакокурении, использовании некачественной воды, потреблении продуктов питания с красителями, консервантами и различными добавками, а также при использовании синтетических моющих средств. Стресс, гиподинамия, вредные привычки усугубляют развитие хронической экзогенной интоксикации. Хроническая эндогенная интоксикация развивается при различных заболеваниях и нарушениях обмена веществ: нарушениях функции почек, кишечника, печени, заболеваниях ЛОР–органов (тонзиллиты, фарингиты, риниты, синуситы), пародонтитах, пародонтозах, гингивитах, хронических заболеваниях мочеполовой сферы, аллергических состояниях и т.д. Синдром эндогенной интоксикации – комплекс клинических симптомов патологических состояний организма, возникших вследствие накопления в тканях и жидкостях эндотоксинов – продуктов естественного обмена в аномально высоких концентрациях. В желудочно–кишечном тракте (ЖКТ) эндотоксины вызывают деструкцию белков и липидов клеток организма, блокируют синтетические и окислительные процессы. Интоксикация является ведущим клиническим синдромом, определяющим тяжесть течения и исход инфекционных заболеваний. Эндогенная интоксикация при различных этиологических факторах, вызывающих патологический процесс, имеет общие черты и клинические проявления эндотоксикоза в виде основных синдромов: психоневрологического, коагуляционного, нарушения функции сердечно–сосудистой системы и функции печени и почек. Степень выраженности каждого из них определяется прежде всего функциональным состоянием выделительных и детоксикационных систем организма. В плане развития интоксикации особую роль играют органы, специализирующиеся на выведении из организма шлаков и потенциально токсических соединений. Естественно, что в первую очередь рассматриваются детоксицирующая функция печени, регуляция водно–электролитного обмена и выведения азотистых шлаков почками. Признаками печеночной дисфункции считаются двукратное повышение концентрации билирубина и двукратное повышение активности аланинаминотрасферазы (АЛТ). Лимитирующей составляющей в плане исхода заболевания является не столько детоксицирующая функция печени, сколько синтетическая из–за резкого возрастания потребности в продукции белков (например, системы свертывания, альбумина). Острая почечная недостаточность (ОПН) резко ограничивает возможности контроля водно–электролитных нарушений, инфузионно–дезинтоксикационной терапии и проведения инотропной поддержки. Появление ОПН как компонента синдрома полиорганной недостаточности критично снижает эффективность лечения и ухудшает исход заболевания [10]. Интоксикационный синдром при заболеваниях печени в большинстве случаев ассоциируется с клиническими признаками печеночной энцефалопатии. Тяжесть интоксикационного синдрома определяет течение и исход вирусных гепатитов, а купирование его в остром периоде заболевания определяет скорость завершения инфекционного процесса. Исследования последних лет показали, что в патогенезе синдрома интоксикации и возникновения тяжелых осложнений со стороны различных систем организма при морфофункциональных нарушениях печени ведущая роль принадлежит эндотоксинам грамотрицательных бактерий, представляющим собой липополисахариды (ЛПС), расположенные в наружной мембране бактериальной клетки и в избытке поступающие в общий кровоток по воротным венам, что обеспечивает системную эндотоксинемию. Под воздействием ЛПС развивается единый стереотипный адаптационный комплекс реакций, выражающийся в активации клеточного и гуморального звена иммунного ответа. Степень этих изменений прямо соответствует клиническому течению заболевания (степени тяжести) и обеспечивает приспособление организма к новым условиям существования [1,4,12]. В исследовании, проведенном Е.В. Волчковой и соавт. (2004 г.), выявлена различная динамика белков острой фазы в зависимости от этиологии хронического гепатита. У всех больных авторы установили снижение преальбумина, гаптоглобина и трансферрина во все периоды заболевания, в то время как у больных хроническим вирусным гепатитом В на фоне снижения преальбумина и трансферрина дополнительно установлен высокий уровень гаптоглобина в сопоставлении с особенностями клинической картины в этой группе больных (выраженные анемия, тромбоцитопения). Анализируя полученные данные, авторы подтвердили, что в развитии синдрома интоксикации в результате гибели гепатоцитов при острых и хронических вирусных поражениях печени ведущая роль принадлежит состоянию гуморальных и клеточных антиэндотоксических факторов вне зависимости от этиологии заболевания. Гуморальные и клеточные антиэндотоксические факторы, находясь в субкомпенсированном состоянии на высоте интоксикации при желтушных формах вирусных гепатитов вне зависимости от этиологии заболевания, не обеспечивают элиминации избытка ЛПС грамотрицательных бактерий из общего кровотока и не предупреждают их повреждающего действия на локальном и системном уровнях. Избыток ЛПС грамотрицательных бактерий в общем кровотоке у больных вирусными гепатитами активирует прежде всего факторы неспецифической резистентности, что приводит к преобладанию клеточно–опосредованной цитотоксичности и углублению процессов интоксикации. Наиболее информативным показателем оценки функционального состояния печени является коэффициент альбумин/преальбумин в комплексе с изучением уровня гаптоглобина и трансферрина [4]. Известна важная роль форменных элементов крови в развитии эндогенной интоксикации, которая заключается в том, что система крови является универсальным транспортером как физиологических веществ, так и компонентов эндотоксикоза, что сопровождается изменением ее функционального и морфологического состояния [5]. Эритроидное звено системы крови играет важную роль в патогенезе практически всех заболеваний, снабжая кислородом и, соответственно, энергией клетки, осуществляющие защитные реакции [9]. Хорошо известно, что недостаток кислорода приводит к гипоксии, ишемии, тканевому ацидозу, нарушению энергетического обмена, что ослабляет резистентность тканей и организма в целом к действию повреждающих факторов. Установлено, что эритроидное звено чувствительно к действию эндо– и экзотоксинов [5,9]. Интоксикационный синдром , вызванный эндоинтоксикацией, наблюдают в клинике при различных формах соматической патологии, а также при чрезмерном или длительном воздействии стрессорных факторов, когда обнаруживаются нарушения на уровне соматических функций, и в сосудистом русле накапливаются токсичные продукты. Кроме того, в организм постоянно извне поступают вещества, обладающие избирательной токсичностью. Среди них по механизму действия можно выделить по меньшей мере две группы экзотоксикантов. К первой группе относятся токсины, действующие как в неизменном виде, так и после их биотрансформации (например, этиленгликоль) и вызывающие нарушение энергетических, метаболических, синтетических процессов в клетках. Другую группу составляют токсины, действующие опосредованно, образуя в результате взаимодействия с молекулой–мишенью высокоактивные реагенты. К ним можно отнести некоторые лекарства (фенацетин, нитроглицерин, викасол, некоторые сульфаниламиды, противомалярийные средства, анестетики) и химические вещества (фенилгидразин), образующиеся в результате химических взаимодействий, сильные окислители, провоцирующие гиперактивацию процессов липопероксидации [3,10,13,14]. Накопление в крови и тканях избыточного количества токсических продуктов – эндоинтоксикация, неизбежно происходит при всех патологических состояниях, связанных с деструкцией тканей, повышенным катаболизмом или блокадой детоксицирующих систем организма [14]. Кожа как полифункциональная система особенно затрагивается при эндотоксическом воздействии. При этом нарушаются ее барьерная, иммунологическая и регуляторная функции. Исследованиями Л.Н. Химкиной и соавт. (2000 г.) было установлено, что эндоинтоксикация наблюдается у 60–80% больных распространенными формами псориаза, атопического дерматита, токсидермий. Клинические проявления эндоинтоксикации при дерматозах нечетко выраженны (окраска кожи, сухость кожных покровов и др.), маскируются симптомами дерматозов. Кроме того, установлено, что эндоинтоксикация способствует фармакологической резистентности при дерматозах [13–15]. По нашим наблюдениям, в амбулаторной практике – на приеме у врача–терапевта, врача общей практики, эндотоксикация наиболее часто встречается при острых и хронических инфекционных заболеваниях (ОРВИ, хронический тонзиллит, хронический синусит, кишечные инфекции, хеликобактериоз, нарушение микробного пейзажа кишечника с преобладанием патогенной микрофлоры), а также таких заболеваниях, как желчекаменная болезнь, острый и обострение хронического холецистита, в том числе и билиарный сладж, острый реактивный и обострение хронического панкреатита, воспалительные заболевания кишечника, атопический дерматит, псориаз. Данные анализа 1910 амбулаторных карт за 2009–2011 гг. представлены в таблице 1. Таким образом, коррекция интоксикационного синдрома важна не только для эффективного лечения заболевания, улучшения качества жизни пациента, но и для снижения дней нетрудоспособности, что имеет важное экономическое значение как для самого пациента, так и системы здравоохранения в целом. Современная терапия эндотоксикоза должна быть комплексной (активные и консервативные методы), включающей детоксикацию различных сред организма (кровь, лимфа, моча, желудочно–кишечное содержимое), коррекцию гомеостаза, профилактику и лечение осложнений [2,11]. Выбор вида терапии основывается на клинико–лабораторных и инструментальных данных. Одним из эффективных и доступных, особенно в амбулаторной практике, методов терапии интоксикационного синдрома и профилактики его прогрессирования, а также в некоторой степени этиологическим методом при острых инфекционных заболеваниях является энтеросорбция [1–3,11,16]. Энтеросорбция – метод, основанный на связывании и выведении из ЖКТ с лечебной и профилактической целью эндогенных и экзогенных веществ, надмолекулярных структур и клеток, относится к наиболее древним методам эфферентной терапии. К прямым механизмам энтеросорбции при инфекционных заболеваниях относится детоксицирующее действие в отношении токсичных метаболитов и токсинов бактерий. Энтеросорбенты, связывая токсины в просвете кишечника, прерывают процессы их резорбции, рециркуляции в организме [2,3,11]. Опосредованный эффект энтеросорбции обусловлен способностью энтеросорбентов поддерживать микробный пейзаж кишечника, что ведет к улучшению пищеварения в тонком кишечнике, повышению метаболической активности энтероцитов, которые по мощности систем детоксикации и биотрансформации субстратов в совокупности не уступают печени. Кроме того, энтеросорбция положительно влияет на функциональное состояние иммунной системы [2,3,10,16]. Таким образом, энтеросорбция уменьшает токсическую нагрузку на органы выделения, в первую очередь на печень и почки. Кроме этого, энтеросорбенты, оставаясь в пределах ЖКТ и не имея собственной фармакодинамики, оказывают мощное системное (дистантное) воздействие на организм – устраняют нарушения липидного обмена, подавляют элементы системной воспалительной реакции, способствуют компенсации и улучшению функции внутренних органов [2,3,10,16]. Немаловажную роль для практического здравоохранения также играют удобная пероральная форма выпуска и приемлемая стоимость лекарственного средства. Энтеросорбция применяется отдельно или в комбинации с плазмаферезом не только при острых кишечных инфекциях, вызванных такими бактериями, как Salmonella, Shigella, ротавирусы, энтерогеморрагические кишечные палочки, но и при других инфекционных заболеваниях (ОРВИ, вирусный гепатит, туберкулез). Также процедура используется при панкреатите, нарушениях липидного обмена, ишемической болезни сердца, билиарном сладже, токсикозе и холестатическом гепатозе у беременных. Предпочтительным является пероральный путь введения энтеросорбентов как наиболее эффективный ввиду того, что процесс сорбции проходит по всей пищеварительной трубке. При невозможности больных самостоятельно принимать препарат энтеросорбент вводят через зонд. По ограниченным показаниям энтеросорбенты могут вводиться с помощью клизм в толстую кишку. Современные требования к энтеросорбентам предусматривают отсутствие у них токсических свойств, травмирующего действия на слизистые оболочки, способности нарушать микробный пейзаж кишечника. Важна и удобная фармацевтическая форма энтеросорбента для пациентов различных возрастов, а также вкусовая характеристика. Виды энтеросорбентов: • природные пищевые волокна: отруби злаковых, целлюлоза, альгинаты; • на основе активированного угля (карболен, карбоктин и др.); • ионообменные материалы или смолы (кайексилит, холестирамин); • на основе лигнина (полифепан, лигносорб); • производные поливинилпирролидона (энтеродез); • также энтеросорбентами выступают белая глина, гидроокись алюминия, алмагель, сукральфат и другие менее эффективные вещества и препараты. В основу классификации современных энтеросорбентов положено несколько принципов: форма, структура, природа материала (помимо синтетических материалов для энтеросорбции могут использоваться природные полимеры на основе лигнина, хитина, целлюлозы, глин (алюмосиликаты, цеолиты) и др.), а также вид взаимодействия между сорбирующим материалом (сорбентом) и связанным веществом (сорбатом). Процессы сорбции осуществляются 4 основными путями: адсорбцией, абсорбцией, ионообменом и комплексообразованием. Адсорбция – процесс взаимодействия между сорбентом, имеющим пористую структуру и сорбатом за счет физических или химических процессов. При адсорбции происходит накопление и фиксация в порах адсорбента сорбируемых веществ, растворенных в жидкостях, что ведет к снижению их концентрации. Связывание адсорбата на адсорбенте является динамически равновесным процессом и лимитировано удельной сорбционной емкостью используемого сорбента. Абсорбция – процесс поглощения сорбата (абсорбата) всем объемом сорбента (абсорбента). В качестве сорбента выступает жидкость, и процесс взаимодействия является по сути растворением вещества. Интенсивность абсорбции лимитируется растворимостью вещества. Клинический эффект процесса абсорбции при гастроинтестинальной детоксикации и метаболической коррекции прослеживается, если растворитель не всасывается или после введения через короткий период времени жидкость выводится через зонд. Ионообмен – процесс замещения ионов на поверхности сорбента ионами сорбата. Проявлением ионообмена при энтеросорбции можно назвать регулирование уровня в крови желчных кислот, фосфатов, калия, кальция и других ионов. При комплексообразовании за счет образования комплексов осуществляются нейтрализация, транспорт и выведение из организма многих веществ (антигенов, билирубина, многих ксенобиотиков и др.) Комплексообразующий реагент – это молекула или ион, образующие устойчивые связи с лигандом. Образующийся комплекс может быть как растворимым, так и нерастворимым в жидкости [2,11,16]. Среди существующих медикаментозных средств важное место занимают комплексообразующие реагенты, взаимодействующие с ядами. Из класса энтеросорбентов к веществам этой группы взаимодействия можно отнести поливинилпирролидон (Энтеродез). Энтеродез является хорошо изученным препаратом, в основе его фармакологических свойств лежит дезинтоксикационное действие, опосредованное способностью к комплексообразованию. Механизм лечебного действия Энтеродеза заключается в способности активно связывать токсины и выводить их из организма через кишечник. Многолетней клинической практикой доказано, что Энтеродез не токсичен, не повреждает слизистую оболочку желудка и кишечника, не накапливается в организме, практически не имеет противопоказаний и побочных эффектов, то есть является вполне безопасным препаратом [3,8,17]. В кровеносное русло препарат не поступает. Лечебный эффект проявляется через 15–30 мин. после приема. И.И. Шиманко и соавт. (1984 г.) была изучена возможность использования Энтеродеза с целью детоксикации у 104 больных с различной инфекционной патологией. У наблюдаемых авторами пациентов имел место выраженный эндотоксикоз, подтвержденный показателями формулы крови и ее токсичности, мочи и лимфы (по данным парамецийного теста). У 83 больных Энтеродез применяли в комплексе с другими методами детоксикации (гемосорбция, гемодиализ, лимфодренажирование грудного протока). У 21 больного при состоянии средней тяжести Энтеродез применяли изолированно, без использования других методов детоксикации. Препарат назначали по 5 г (растворяли в 100 мл воды с добавлением сахара) 3–4 раза в сутки. Во всех наблюдениях при приеме препарата в течение 5–8 дней в дозе от 75 до 120 г на курс лечения у больных клинически отмечалась положительная динамика. Постепенно улучшался аппетит и сон, быстрее, чем при обычной терапии, нормализовалась функция кишечника (усиливалась перистальтика, отходили газы, нормализовалась дефекация), уменьшалась головная боль. При исследовании крови на токсичность в процессе лечения отмечали удлинение срока жизни парамеций, т.е. снижение токсичности исследуемой среды (в крови жизнь парамеций увеличивалась за сутки с 50 с до 3 мин. 40 с, в среднем на 1 мин. 45 с, в моче – в среднем на 1 мин 30 с). Больные охотно принимали Энтеродез, осложнений отмечено не было. Авторами также было изучено влияние Энтеродеза на состояние центральной гемодинамики. Через 30–60 мин. после приема Энтеродеза у всех больных при практически неизмененных частоте сердечных сокращений и артериальном давлении на 10–35% увеличился по сравнению с исходным ударный объем сердца. Минутный объем сердца во всех случаях нормализовался, а по сравнению с исходным увеличился на 10–45% (в 1 наблюдении на 78%). Циркулирующий объем крови при низких исходных показателях увеличился на 10–35%, при высоких – снизился. ОПСС во всех случаях снизилось на 5–35% по сравнению с исходным. Улучшение показателей центральной гемодинамики после применения Энтеродеза сопровождалось улучшением состояния больных и более быстрым их выздоровлением, что доказывало четко выраженный лечебный эффект Энтеродеза [17]. Р.В. Генераловой и соавт. (1990 г.) Энтеродез был применен у больных с туберкулезом мочевой системы, сопровождающимся хронической почечной недостаточностью (ХПН). Препарат вводили по 5 г (1 чайная ложка) в 100 мл кипяченой воды 2–3 раза в сутки в течение 7 дней для снятия эндогенной интоксикации в пред– и послеоперационном периоде. Обследовано 40 больных в возрасте от 16 до 50 лет (22 мужчины и 18 женщин). Клинические проявления ХПН у этих больных выражались не только в нарушениях функции почек, но и в изменениях со стороны сердечно–сосудистой, дыхательной, нервной системы, сдвигах протеинограммы и гемограммы, нарушениях водно–электролитного равновесия. По степени выраженности ХПН больные были распределены на 2 группы. 1–ю группу составили 18 больных с ХПН I–II стадии, 2–ю – 22 больных с ХПН III–IV стадии. Исследования проводили до и после лечения Энтеродезом. На время приема Энтеродеза все другие лекарственные препараты отменялись. По данным авторов, 7–дневный курс энтерального приема Энтеродеза не отразился достоверно на фильтрационной функции почек. Выявлено улучшение концентрационной функции у больных с интермиттирующей и терминальной стадиями ХПН (2–я группа). Общее состояние больных за период приема Энтеродеза заметно изменилось: улучшились самочувствие и аппетит, уменьшилось количество жалоб на бессонницу. Показатели гемодинамики оставались стабильными. Подводя итог исследований, авторы отметили, что применение у больных туберкулезом и поражениями почек Энтеродеза оказывает дезинтоксикационный эффект и приводит к улучшению общего состояния пациентов [6]. Энтеродез более 20 лет широко использовался для лечения желудочно–кишечных интоксикаций – дизентерии, сальмонеллеза и др. Выявлено, что препарат снимает рвоту, тошноту, нормализует стул, температуру, пульс, позволяет исключить или уменьшить применение другой дезинтоксикационной терапии [3,4,7,8]. Препарат оказался эффективным и при других видах интоксикации – ожоговой болезни, травматических поражениях, печеночно–почечной недостаточности и др. [17]. При таком частом осложнении тяжелой инфекционной интоксикации, как почечно–печеночная недостаточность, Энтеродез способствует снижению в 2–3 раза лейкоцитарного индекса интоксикации, нормализации числа лейкоцитов, снижению в 2–3 раза содержания билирубина, уменьшению в 2–4 раза токсичности крови по парамецийному тесту, повышению ударного и минутного объема сердца, нормализации функции печени. При данном патологическом состоянии введение Энтеродеза позволяет уменьшить объем вводимой в организм жидкости, что очень важно для ряда больных, особенно пожилого возраста. К.М. Лобан и соавт. (1983 г.) исследовали клиническую эффективность Энтеродеза у 85 больных в возрасте от 19 до 69 лет с острыми кишечными инфекционными болезнями (65 пациентов с пищевыми токсикоинфекциями и 20 – с острой дизентерией) [8]. Все больные поступали в остром периоде болезни, и препарат назначался при наличии интоксикации различной интенсивности. Выраженная интоксикация была определена у 42 больных с картиной быстро развивающейся слабости, заторможенности, потери аппетита, тошноты и рвоты от 1 до 4 раз в сутки. У больных пищевой токсикоинфекцией стул был обычно жидкий, водянистый, от 5 до 10 раз в сутки, в единичных случаях – до 20 раз, а при острой дизентерии – в среднем 5–6 раз в сутки с примесью слизи и крови. У всех этих больных были выраженные боли в области живота, часто интенсивные, но непродолжительные, отмечалась высокая лихорадка. Препарат в дозе 5 г растворяли в 100 мл воды и назначали перорально больным 1–4 раза в течение 1–3 дней в зависимости от степени интоксикации. Больные хорошо переносили препарат. Для улучшения вкусовых качеств к раствору добавляли 1 столовую ложку сладкого сиропа Все больные с пищевыми токсикоинфекциями (85) были разделены на 2 группы. Первую группу составили 43 пациента, которые получали Энтеродез на фоне комплексного лечения: гидратационной терапии (внутривенного введения квартасоли, физиологического раствора) и симптоматических средств (спазмолитиков, витаминов, антигистаминных препаратов). Вторую группу (контрольную) составили 22 больных с пищевыми токсикоинфекциями, которые получали гидратационную терапию и другие симптоматические средства без применения Энтеродеза; еще 20 больных острой дизентерией получали Энтеродез на фоне этиотропной терапии без приема симптоматических средств. Основным критерием эффективности Энтеродеза было улучшение общего самочувствия больных, что связано прежде всего с уменьшением интоксикации. Положительный эффект имел место у всех леченных Энтеродезом больных. Достоверно раньше, чем в контрольной группе, при использовании Энтеродеза исчезали тошнота и рвота, уменьшались головная боль и слабость, снижалась повышенная температура, особенно у больных с пищевыми токсикоинфекциями; в 80% случаев стул нормализовался уже к концу 1–х и началу 2–х суток после начала лечения. Измененные у некоторых больных функциональные пробы печени также быстро возвращались к норме (обычно на 2–е сутки). Средний срок пребывания больных в стационаре с пищевой токсикоинфекцией, леченных Энтеродезом, был достоверно ниже, чем в контрольной группе. Авторы отметили, что лечение Энтеродезом больных с острой дизентерией почти полностью позволило исключить применение гидратационной терапии. Уже после 1–2 приемов этого препарата значительно уменьшались признаки интоксикации, исчезали болевой синдром и вздутие кишечника, появлялась тенденция к нормализации стула. У всех больных до и после лечения Энтеродезом существенных изменений в микрофлоре кишечника выявлено не было. Побочные явления также не отмечались. В ходе данного исследования было выявлено, что эффективность Энтеродеза зависит от срока начала его применения. Чем быстрее от начала болезни начато лечение, тем лучше эффект. Лечение Энтеродезом эффективно как на фоне другой комплексной (в том числе гидратационной) терапии, так и без нее. Применение Энтеродеза в ряде случаев позволяет исключить внутривенные капельные вливания жидкости даже при среднетяжелом и тяжелом течении болезни, особенно у больных с острой дизентерией [8]. Таким образом, доказанная длительным использованием в клинической практике (более 20 лет) высокая детоксикационная эффективность Энтеродеза, удобство использования, возможность его комбинирования с другими лекарственными средствами, а также практически полное отсутствие побочных явлений позволяют рекомендовать применение Энтеродеза для ликвидации интоксикационного синдрома уже на догоспитальном этапе лечения, т. е. в амбулаторно–поликлинических условиях.
Литература 1. Беляева О.А., Семенов В.Г. Применение энтеросорбции в комплексной терапии заболеваний печени // Аптека. – 2003. – № 30. – С.7. 2. Беляков Н.А. Энтеросорбция. ¬– Ленинград: Центр сорбционных технологий, 1991.– 325 с. 3. Волкова Н.Н. Кишечные инфекции: этиология, клиника, лечение // РМЖ..– 2010.– № 6.–С.376. 4. Волчкова Е.В., Пак С.Г., Умбетова К.Т. Гуморальные и клеточные адаптационные механизмы при развитии интоксикационного синдрома у больных острыми вирусными гепатитами // Тер. архив. – 2004. – №11.– С. 61–65. 5. Гаврилова О.В. Патогенетическое обоснование коррекции нарушений в эритроидном звене системы крови при экзоинтоксикациях и стрессе с помощью арабиногалактана: экспериментальное исследование: дисс. канд. биол. наук, 2007. 6. Генералова Р.В., Невенгловский И.Е., Стрельникова В.А. Дезинтоксикационная терапия с использованием Энтеродеза у пациентов с туберкулезом мочевыделительной системы // Проблемы туберкулеза . –1990.– №5.– С. 68–70. 7. Кожевникова Г.М., Ющук Н.Д., Бахтина Ю.А. Патогенетическая терапия острых кишечных инфекций // Медицина критических состояний. Инфекции. – 2004. – № 6. – С.3–6. 8. Лобан К. М., Митерев Ю. Г., Жеребцов Л. А. и др. Эффективность препарата Энтеродез при острых кишечных инфекциях // Гематология и транфузиология.–1983.– №7.– С 33–39. 9. Логинова О.В. Патогенетический подход к коррекции эндогенной интоксикации перитонеального генеза с использованием препаратов антиоксидантного и антигипоксантного типа действия: автореф. дисс. д.м.н., 2011. 10. Малахова М.Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме // Эфф. терапия.– 2000.– № 4.–С.3–14. 11. Николаев В.Г., Михаловский С.В., Николаева В.В. и др. Энтеросорбция: состояние вопроса и перспективы на будущее // Вісник проблем біології і медицини. – 2007. – Вип. 4. – С. 7–17. 12. Палий И.Г. Роль энтеросорбции в лечении заболеваний печени (обзор литературы). Винницкий национальный медицинский университет им. Н.И. Пирогова. 13. Сидельникова, В.И., Лифшиц В.М. Эндогенная интоксикация как одна из причин фармакорезистентности. Новые подходы лабораторной диагностики // Клин. лаб. диагн.– 1998.– № 8.– С. 37. 14. Химкина Л.Н., Пантелеева Г.А., Копытова Т.В. Эндоинтоксикационный синдром в клинике, патогенезе хронических дерматозов, методы коррекции.– Н.Новгород: Пособие для врачей, 2000.– С. 11. 15. Химкина Л.Н., Пантелеева Г.А., Копытова Т.В. Коррекция эндоинтоксикационного синдрома при дерматозах // Эксп. и клиническая дерматокосметология.– 2005.– № 6.– С.61–64. 16. Хотимченко Ю.С., Кропотов А.В. Применение энтеросорбентов в медицине // Тихоокеанский медицинский журнал.– 1999.– № 2.– С. 84–89. 17. Шиманко И.И., Суздалева В.В., Галкина Г.С. и др. Применение энтеродеза и энтеросорба у больных с различной патологией, сопровождающейся тяжелым эндотоксикозом // Гематология и трансфузиология. – 1984. – № 11.– С. 31–35.
Отзывы
Мнения врачей о препарате в интернете исключительно положительные. Энтеродез помогает быстро справиться с алкогольной интоксикацией, пищевыми отравлениями, ротавирусной инфекцией, хорошо переносится и не дает побочных эффектов. Из минусов – высокая цена, неприятный вкус, которые перекрываются эффективностью медикамента.
Некоторые покупатели, кроме быстрого избавления от проявлений отравления, отмечают появление запора. В качестве плюсов указывается возможность покупать поштучно и наличие инструкции на пакетике. Порошок можно применять у взрослых и детей, положительные изменения отмечаются уже через 15 минут после приема. Удобно брать с собой в дорогу, в отпуск, на корпоратив или на природу. Подходит в качестве средства профилактики острых кишечных инфекций и отравлений.
Белковая пища и наше здоровье
Иногда желание есть тяжелую белковую пищу отсутствует напрочь. Но белки задействованы практически во всех процессах жизнедеятельности организма и при их дефиците возникают необратимые изменения в печени, нарушается работа желез внутренней секреции, происходит гормональный сбой, сердечная мышца не справляется со своими функциями, ухудшаются память, внимание и выносливость. Белки незаменимы в процессе пищеварения – все ферменты состоят из них. Запасы белка в организме человека очень скудны, а недостаток поступления его извне ослабляет стенки ЖКТ, вялые мышцы кишечника плохо перемешивают пищу, она хуже переваривается и мириады гнилостных бактерий начинают активно размножаться. Результат – дискомфорт и различные заболевания, включая острые кишечные инфекции (ОКИ).