Статья проверена врачом-акушером-гинекологом, к.м.н. Сазоновой Ю.М., носит общий информационный характер, не заменяет консультацию специалиста. Для рекомендаций по диагностике и лечению необходима консультация врача.
Зуд и жжение в интимной зоне, которые возникают на фоне покраснения и воспаления — самая частая причина обращения к гинекологу и дерматовенерологу. Специалисты Клинического госпиталя на Яузе перед началом лечения устанавливают причину, в связи с которой возник данный дискомфорт, проводя все необходимые лабораторные исследования. Этиотропное лечение (направленное на устранение причины), как правило быстро приводит к устранению симптома.
Чаще всего подобные жалобы возникают при развитии вульвовагинитов, контактного дерматита. Зуд и жжение в аногенитальной зоне не только нарушает ведение активной жизни, но и способствует возникновению болей во время секса, а появление этих симптомов в постменопаузе является серьезной проблемой для женщины, иногда способной привести к онкологии.
Записаться к гинекологу
Возбудитель заболевания — вирус папилломы человека (ВПЧ) относится к роду папилломавирусов (Papillomavirus), который, в свою очередь, принадлежит к семейству папававирусов (Papavaviridae). Вирусы папилломы человека высокотканеспецифичны и поражают клетки эпителия кожи и слизистых оболочек. К настоящему времени идентифицировано и описано более 190 типов ВПЧ, которые классифицируются на группы высокого и низкого онкогенного риска в соответствии с их потенциалом индуцировать рак.
Международное агентство по изучению рака выделяет 12 типов ВПЧ высокого риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59), которые могут потенцировать развитие рака и предраковых поражений различной локализации: шейки матки, вульвы, влагалища, анального канала, пениса, шеи,гортани, ротовой полости.
Аногенитальные бородавки являются наиболее распространенным клиническим проявлением папилломавирусной инфекции, при этом до 90% всех случаев заболевания у мужчин и женщин вызывается 6 и 11 типами ВПЧ.Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет 11-12 месяцев у мужчин и 5-6 месяцев у женщин.
Папилломавирусная инфекция наиболее часто регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.Выявляемость ВПЧ значительно варьирует в различных этнико-географических регионах и определяется поведенческими, социально-экономическими, медицинскими, гигиеническими факторами. Географическая вариабельность характерна не только для частоты выявляемости вируса, но и для распределения генотипов ВПЧ. Согласно систематизированному анализумировых данных заболеваемость аногенитальными бородавками мужчин и женщин (включая новые случаи и рецидивы заболевания) варьирует от 160 до 289 случаев на 100 000 населения со средним значением 194,5 случаяна 100 000 населения, а средний ежегодный уровень выявляемости новых случаев аногенитальных бородавок составляет 137 случаев на 100 000 населения среди мужчин и 120,5 случая на 100 000 населения среди женщин.
В Российской Федерации показатель заболеваемости аногенитальными бородавками в 2014 году составил 21,8 случая на 100 000 населения: у лицв возрасте от 0 до 14 лет — 0,6 случая на 100 000 населения, у лиц в возрасте 15-17 лет — 28,3 случая на 100 000 населения, у лиц в возрасте старше18 лет — 25,9 случая на 100 000 населения. Однако данные показатели не отражают истинного уровня заболеваемости и являются следствием неполнойрегистрации новых случаев аногенитальных бородавок.
пути инфицирования
У взрослых лиц:половой контакт.
У детей:
- трансплацентарный (редко);
- перинатальный;
- половой контакт;
- контактно-бытовой, однако возможность аутоинокуляции и передачи ВПЧ через бытовые предметы остается недостаточно изученной.
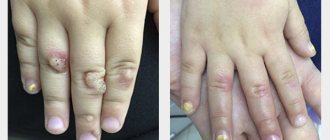
Аногенитальные (венерические) бородавки (остроконечные кондиломы)
Аногенитальные (вирусные) бородавки – вирусное заболевание, обусловленное вирусом папилломы человека и характеризуется появлением разрастаний на коже и слизистых оболочках наружных половых органов, уретры, влагалища, шейки матки, перианальной области.
Возбудитель заболевания – вирус папилломы человека (ВПЧ) относится к роду папилломавирусов ,который, в свою очередь, принадлежит к семейству папававирусов. В настоящее время насчитывается более 190 типов ВПЧ, из них с заболеваниями урогенитальной области ассоциированы определенные типы, из которых выделены разновидности низкого – ВПЧ 6 и 11, среднего – ВПЧ 31, 33, 35 и высокого онкогенного риска – ВПЧ 16 и 18. У людей, ведущих беспорядочную половую жизнь, нередко встречается носительство сразу нескольких типов вирусов. Характерной особенностью данной патологии является поражение больных в молодом возрасте. ВПЧ рассматривается в качестве возможного этиологического фактора плоскоклеточной карциномы шейки матки, рака вульвы и влагалища.
Заболевание передается преимущественно половым путем.
Факторами, способствующими появлению или рецидивированию ВПЧ, являются: снижение иммунологической реактивности, переохлаждение, инреткуррентные заболевания ( в основном вирусной этиологии), гормональные нарушения. Наблюдается появление или рецидивирование аногенитальных бородавок во время беременности ( что обусловлено характерной для нее иммуносупрессией) и спонтанный регресс после родов.
Патологический процесс у мужчин локализуется на внутреннем и наружном листках крайней плоти, головке полового члена, у наружного отверстия мочеиспускательного канала, коже паховых складок, мошонки, перианальной области. У женщин аногенитальные бородавки чаще поражают большие и малые половые губы, клитор, кожу наружного отверстия мочеиспускательного канала, паховые складки, перианальную область.
Сначала появляются единичные узелки величиной с булавочную головку, розового или серовато-красного цвета, однако со временем число их увеличивается. Они растут в виде сосочков, нередко сливаются между собой, образуя опухолевидные разрастания, напоминающие цветную капусту или малину. Аногенитальные бородавки имеют мягкую консистенцию. Окружающая аногенитальные бородавки кожа, как правило, не изменена. Однако при постоянном механическом раздражении кожа становится ярко-красной, появляются ощущения зуда и жжения.
Клиническая диагностика аногенитальных бородавок обычно не представляет затруднений. Проблемы возникают при диагностике на ранних стадиях заболевания, когда аногенитальные бородавки очень малы и похожи на шероховатость поверхности. В этом случае, основным методом диагностики является цитологическое исследование биоптантов. Метод полимеразной цепной реакции может применяться при малосимптомных или бессимптомных формах заболевания, а также для определения типа вируса. В связи с применением в терапии аногенитальных бородавок деструктивных методов дополнительно проводят серологическое исследование на сифилис, ВИЧ, гепатиты В и С.
Консультации других специалистов рекомендованы по показаниям в следующих случаях: — акушера-гинеколога с целью диагностики фоновых и диспластических процессов шейки матки, вульвы и влагалища; — уролога при внутриуретральной локализации аногенитальных бородавок; — проктолога при наличии процесса в анальной области; — иммунолога при наличии иммунодефицитных состояний и рецидивировании заболевания.
Инкубационный период составляет от 3 недель до 8 месяцев, чаще – 2-3 месяца. Вирус может сохраняться в латентном состоянии в течении всей жизни человека. Даже при правильном лечении и нормальном иммунитете аногенитальные бородавки часто рецидивируют. Это связано с сохранением вируса во внешне здоровой коже вокруг высыпаний. Рецидив связан не с повторным заражением от полового партнера, а с реактивацией вируса. При отсутствии терапии аногенитальные бородавки могут разрешаться самостоятельно, оставаться без изменения или прогрессировать.
Показанием к лечению аногенитальных бородавой является наличие клинических проявлений заболевания Поскольку полного излечения от ВПЧ-инфекций достичь невозможно, цель терапии заключается в удалении аногенитальных бородавок, а не в элиминации возбудителя. Методы лечения аногенитальных бородавок подразделяются на следующие основные группы:
- Цитотоксический метод
- Химический метод
- Иммуномодуляторы для местного применения.
- Физические методы – электрокоагуляция
- лазерная деструкция
- криодиструкция
- Хирургическое иссечение
Использование презервативов снижает риск заражения половых партнеров.
Бровкина И.В.
Генитальные бородавки: эффективные методы лечения
М.А.ГОМБЕРГ, д.м.н., профессор, А.М.СОЛОВЬЕВ, к.м.н., доцент, Н.И.ЧЕРНОВА, к. м. н., доцент, С.Г.ИСАЕВА, МГМСУ, Москва Инфекции, вызванные вирусом папилломы человека (ВПЧ), очень широко распространены. Только в США по оценкам Центра по контролю заболеваемости (CDC), до 5,5 млн человек в год инфицируются ВПЧ (Armstrong G.L., et al., 2001).
В России аногенитальные бородавки, этиология которых связана с ВПЧ, регистрируются как инфекции, передаваемые половым путем (ИППП). Уровень официальной регистрации аногенитальных бородавок в России (около 35 на 100 000 населения в последние годы) существенно отличается от истинной распространенности ВПЧ-инфекции.
Между тем с широким внедрением в практику методов молекулярной диагностики врачи разных специальностей диагностируют ВПЧ-инфекцию при разнообразных клинических проявлениях папилломатоза за пределами области гениталий. Зачастую ВПЧ обнаруживают и без наличия ассоциированных с этой инфекцией проявлений. Это особый случай, и тактику ведения таких пациентов мы обсуждали ранее (Гомберг М.А, Соловьев А.М. // Медицинский совет. – 2009. — № 3. – С. 12-18).
Проблема ВПЧ-инфекции стала особенно актуальной после присуждения Нобелевской премии по медицине в 2008 г. Harald zur Hausen (Германия) за доказательство связи рака шейки матки именно с этим вирусом. В настоящее время об этом осведомлены не только врачи, но и пациенты.
Цель настоящей статьи – дать врачам, работающим на амбулаторном приеме, представление о современных подходах к ведению больных с ВПЧ-инфекцией, чтобы при обнаружении у пациентов аногенитальных бородавок они могли решать эту проблему самостоятельно, не направляя больного в специализированные центры.
Принципы лечения клинических проявлений ВПЧ
Согласно существующим принципам по ведению больных с генитальными клиническими проявлениями, связанными с ВПЧ, лечение направлено либо на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов. Наиболее оптимальной является следующая классификация методов лечения аногенитальных бородавок: I. Деструктивные методы: 1. Физические — хирургическое иссечение; — электрохирургические методы; — криотерапия; — лазеротерапия. 2. Химические: — азотная кислота; — трихлоруксусная кислота; — солкодерм. II. Цитотоксические препараты: — подофиллин (ПФ); — подофиллотоксин (ПФТ); — 5-фторурацил. III. Иммунные методы: — интерфероны; — индукторы интерферонов; — иммунотропные препараты. IV. Комбинированные методы: — сочетанное применение различных методов, как правило, иммунных с деструктивными. При выборе наиболее оптимального метода в каждом конкретном случае врачу необходимо руководствоваться следующими основными характеристиками: — эффективностью при данной патологии; — частотой рецидивов после лечения; — переносимостью (минимумом побочных эффектов); — простотой выполнения процедур.
Лечение генитальных клинических проявлений, связанных с ВПЧ, направлено либо на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов
Основным отличием физических деструктивных методов является то, что при их использовании происходит быстрое, часто — одномоментное разрушение поражений. При использовании других методов поражения ликвидируются через несколько часов или недель. Как правило, это время сопоставимо со временем заживления очагов после воздействия физических методов. Частота рецидивов, по данным литературы, не зависит от выбора метода лечения.
Таким образом, очевидные преимущества физических методов нивелируются. Для применения физических деструктивных методов необходимы специальные помещения, дорогостоящее оборудование, обученный персонал, имеющий сертификаты на данный вид медицинской деятельности. Все это ограничивает применение данных методов в широкой практике, особенно в условиях небольших медицинских центров или в районах, где в поликлинике имеются лишь дерматовенерологический, гинекологический или урологический кабинеты. В связи с этим особый интерес представляют консервативные методы лечения, которые может применить любой практикующий врач.
Химические деструктивные методы
Применяют концентрированные растворы кислот, щелочей, солей и др., например ферезол, перекись водорода, растворы акрихина и хингамина, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоту, соки туи и чистотела. Все эти методы обладают невысокой, плохо прогнозируемой эффективностью, многочисленными побочными эффектами. Упорядоченных данных об эффективности этих препаратов немного.
Ферезол
Ферезол – раствор, содержащий 60% фенола и 40% трикрезола. Его применяют 1-2 раза с интервалом 3-4 мин 1 раз в неделю. Можно повторять 3-4 раза. Среди химических препаратов, обладающих деструктивным действием, о которых есть достаточно данных в литературе, следует отметить комбинированный кислотный препарат – солкодерм.
Солкодерм
Солкодерм – это водный раствор, активной составляющей которого являются продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной кислотой, имеющей концентрацию 6,6 Н. Раствор содержит нитриты в количестве 0,02 мг/мл. При местном применении на пораженных участках солкодерм ведет к прижизненной фиксации (сохраняется структура новообразования) с последующей мумификацией патологически измененной ткани, с которой препарат вступает в соприкосновение. Заживление происходит под струпом, что исключает образование открытой раневой поверхности. Осложнения лечения, такие как вторичная инфекция или образование рубцов, по данным литературы, наблюдаются крайне редко. Простота в использовании, эффективность в удалении пораженных тканей с минимальным негативным влиянием на окружающие ткани и способность контролировать масштаб обработки делает препарат солкодерм полезным для лечения широкого диапазона доброкачественных изменений кожи.
Уникальность солкодерма в том, что входящие в его состав кислоты, обладая невысокой концентрацией и, следовательно, небольшой вероятностью побочных эффектов, оказывают выраженный клинический эффект за счет окислительно-восстановительных реакций. Продукты окисления азота, которые образуются в результате этих реакций, имеют некоторые дополнительные клинические преимущества, характеризующиеся более полным разрушением пораженного участка и уменьшением повреждающего воздействия на окружающие здоровые ткани (Weiner M., et al., 1983).
Под нашим наблюдением находилось 24 больных (14 мужчин и 10 женщин) в возрасте от 17 до 41 года (средний возраст 25,8 лет): 16 больных с остроконечными кондиломами на половых органах, 3 больных с вульгарными бородавками на кистях рук, 2 больных с подошвенными бородавками и 3 – с невусами гладкой кожи. Солкодерм наносили специальным пластиковым шпателем или с помощью стеклянного капилляра на предварительно обезжиренную спиртом поверхность очага. Наиболее быстрый способ насыщения очага достигался при нанесении раствора с помощью капиллярных трубочек с последующим механическим воздействием пластиковым шпателем для более глубокой пенетрации раствора.
Обработку бородавок проводили до появления желтого окрашивания очагов, расположенных на коже, или белого окрашивания очагов, расположенных на слизистых оболочках. Появление равномерной желтой или белой окраски свидетельствует о достаточности обработки и является гарантией последующей мумификации образования. Контрольный осмотр больных проводили через 3-5 дней после первичной обработки. В случае необходимости проводили повторную обработку очагов солкодермом.
У больных остроконечными кондиломами и невусами в большинстве случаев было достаточно однократной обработки солкодермом. Полное отторжение струпа происходило в период от 5 (обычно при кондиломах) до 14 (в случае невусов) дней в зависимости от локализации и размера поражений. Для лечения вульгарных бородавок требовалось проведение 2-3 сеансов терапии, для лечения подошвенных бородавок – 3-4 сеанса. Во всех случаях удалось добиться полного исчезновения поражений. Лечение переносилось хорошо, серьезных побочных эффектов не отмечалось. При контрольном наблюдении в течение 6 месяцев у 3 больных с остроконечными кондиломами отметили рецидив заболевания.
Полученные нами данные о высокой эффективности и хорошей переносимости терапии солкодермом полностью совпадают с данными крупных зарубежных исследований. При лечении обыкновенных и подошвенных бородавок препарат оказался эффективен у 85-94% больных (уровень рецидивирования составил 6–10%) (Hettich R., Burri P., Binet O., 1984). При лечении остроконечных кондилом у мужчин и женщин эти показатели составили 80,1 и 7,0% соответственно, причем у 64,7% больных эффект был достигнут после однократной обработки (Brokalakis J., et al., 1984).
Кратковременность лечения, амбулаторный характер лечения и точность, с которой проводится нанесение препарата на патологические ткани, делают солкодерм удачным препаратом для лечения остроконечных кондилом, а также обыкновенных и подошвенных бородавок.
Цитотоксические препараты. Подофиллин
Подофиллин представляет собой смолу, полученную из растений P. pelatum и P. emodi, растущих в Северной Америке и Гималаях. Для лечения бородавок аногенитальной области применяют 10-25% раствор подофиллина в этаноле или настойке бензоина. Подофиллин является препаратом выбора в клиниках Великобритании (Reynolds M., et al., 1993). Он связывается с аппаратом микротрубочек клетки и ингибирует митозы, а также подавляет транспорт нуклеиновых кислот, в результате чего происходит ингибирование синтеза ДНК и размножения клетки (Handley J.M., et al., 1994). В России подофиллин не зарегистрирован. Некоторые исследователи выступают против применения препарата, особенно самими пациентами. В частности, Petersen, et al. (1995) считают подофиллин плохо изученным, грубо очищенным растительным экстрактом. Методом жидкостной хроматографии эти авторы определили, что примерно 10% сухого вещества 20%-ного раствора подофиллина составляют 2 мутагенных флавоноида – кверцетин и кемферол. В связи с этим предлагается использовать только высокоочищенные подофиллотоксины, но их самостоятельное применение можно рекомендовать больным только после проведения подробного инструктажа.
Подофиллотоксин
Подофиллотоксин представляет из себя наиболее активную в терапевтическом отношении фракцию в составе подофиллина. Выпускается в виде 0,25, 0,3 и 0,5% растворов, а также в виде 0,15, 0,3 и 0,5% крема.
В России зарегистрированы раствор и крем подофиллотоксина: — кондилин – 0,5% раствор. Применяют 2 раза/сут в течение 3 дней, затем перерыв 4 дня. Длительность лечения не более 5 недель. — вартек – 0,15% крем.
Несомненное достоинство подофиллотоксина – возможность безопасного самостоятельного применения препарата пациентами. Подофиллотоксин применяют 2 раза в день в течение 3 последовательных дней в неделю в течение 4-5 недель.
Для подофиллотоксина показатель эффективности составляет 26-87% у мужчин и 50-77% у женщин (Lassus A., 1987; Von Krogh G., 1987; Edwards A., et al., 1988; Kirby P., et al., 1990; Baker D.A., et al., 1990; Handley J.M., et al., 1991; Greenberg M.D., et al., 1991). Большой разброс показателей эффективности обусловлен различным сроком наблюдения за больными, а также тем, что в некоторых работах авторы не учитывают рецидивы. Наиболее частыми побочными эффектами применения подофиллотоксина по данным Bonnez W., et al. (1994) являются местные воспалительные реакции (у 57% пациентов), эритема, жжение (у 48%), болезненность (у 47%), зуд (у 44%), незначительное мокнутие и эрозии в области аппликации (у 39%). Хотя системных побочных эффектов не было описано, рекомендуется применять подофиллотоксин в количестве не более 0,2 мл за одну процедуру (Von Krogh G., 1982).
Handley J.M., et al. (1994) считает подофиллотоксин препаратом выбора для самостоятельного применения больными с небольшим количеством неороговевающих кондилом, располагающихся на крайней плоти, головке полового члена, в венечной борозде и вульве. Препарат малоэффективен при лечении бородавок перианальной области, влагалища и уретры.
Недостатками подофиллотоксина являются его высокая стоимость, большая длительность лечения в сочетании с не самой высокой эффективностью.
5-Фторурацил
5-фторурацил является антагонистом пиримидина и способен нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде 5%-ного крема (Krebs H.B., 1987). По мнению Handley, et al. (1994), 5-фторурацил является эффективным методом лечения интравагинальных бородавок и кондилом терминальной части уретры. При лечении интравагинальных бородавок препарат назначают 1 раз на ночь в течение недели или 1 раз в неделю в течение 10 недель (Krebs H.B., 1987). Хотя препарат при такой схеме лечения обладает достаточно высокой эффективностью (85-90%), при его применении могут возникать мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита.
При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания, на ночь в течение 3-8 дней. Полное излечение внутриуретральных бородавок наблюдается у 90-95% мужчин (Dretler S.P., et al., 1975; Von Krogh G., 1976). Однако при лечении наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления (Krebs H.B., 1987).
Несмотря на достаточно высокую эффективность 5-фторурацила, доступность и невысокую стоимость, в широкой практике его применение ограничено из-за высокой частоты побочных эффектов. Препарат противопоказан при беременности.
Официнальных препаратов фторурацила для наружного применения в России нет, но крем необходимой концентрации может быть приготовлен по рецепту в аптечном производственном отделе из субстанции.
Иммунные методы. Интерферон
Так как ВПЧ сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение интерферонов как в качестве монотерапии, так и в комплексе с другими методами лечения.
Установлено, что при применении интерферона у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражений (Arany I., et al., 1995).
Интерферон в терапии аногенитальных бородавок можно применять местно, внутриочагово и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона (Keay S., et al. 1988). Gross G. (1996) считает, что важным показанием для наружного применения интерферона является наличие субклинических очагов ВПЧ-инфекции и ЦИН (особенно вызванных типами ВПЧ высокого онкогенного риска).
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн. МЕ внутримышечно или подкожно через день в течение 4 недель у 11-100% пациентов наблюдается полное исчезновение бородавок (Gross G., et al., 1986; Zwiorek L., et al., 1989).
При системном применении интерферона могут наблюдаться гриппоподобные явления, выраженность которых зависит от полученной дозы (Handley, et al., 1994). Эти побочные явления можно ослабить, назначив нестероидные противовоспалительные препараты.
Учитывая, что эффективность системной монотерапии интерфероном невысока и недостаточно предсказуема, а также принимая во внимание высокую стоимость лечения, этот метод не получил широкого распространения в клинической практике.
По данным различных авторов, наиболее эффективно внутриочаговое применение альфа- и бета-интерферона. Такой способ терапии приводит к исчезновению 35-62,5% бородавок, причем как леченных, так и не леченных (Corwin Vance J., et al., 1986; Reichman R.C., et al., 1988; Welander C.E., et al., 1990). На российском рынке представлен широкий выбор интерферонов различных производителей как отечественных, так и зарубежных – виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и др.
Предпочтительнее использовать рекомбинантные, а не человеческие интерфероны. К препаратам, зарегистрированным для лечения папилломавирусной инфекции, относятся:
Виферон – рекомбинантный интерферон альфа-2b. Выпускается в виде мази, геля и суппозиториев. При папилломавирусной инфекции суппозитории применяют по 500000 МЕ 2 раза/сут в течение 5-10 дней;
Интрон А – рекомбинантный интерферон альфа-2b. Применяется системно;
Роферон А – рекомбинантный интерферон альфа-2а. Применяют подкожно по 1-3 млн. МЕ 3 раза в неделю в течение 1-2 месяцев;
Альтевир – рекомбинантный интерферон альфа-2b. Применяется системно;
Вэллферон – очищенный интерферон альфа-n1. Применяют подкожно по 5 млн МЕ ежедневно в течение 14 дней, затем 3 раза в неделю в течение 6-8 недель.
Есть сообщения об эффективном применении индукторов интерферона в виде монотерапии. Представляет интерес местное применение низкомолекулярного производного имихидазохинолинамина – имихимода, который является индуктором цитокинов и, в частности альфа-интерферона (Baker D., et al., 1995; Trofatter K.E., 1997). Его применяют в виде 5% крема 3 раза в неделю либо ежедневно на ночь до полного исчезновения высыпаний (но не более 4 месяцев). Полное исчезновение кондилом наблюдается у 56% больных при первом режиме дозирования и у 71% при ежедневном применении (плацебо – 14%).
При контрольных обследованиях в течение 1 года рецидивы наблюдались лишь у 13-19% (Baker D., et al., 1995; Trofatter K.E., 1997). При ежедневном применении чаще развивались местные побочные эффекты: покраснение, отечность, эрозии. Крем особенно эффективен при лечении субклинической ВПЧ-инфекции (Gross G., 1996). Имихимод широко применяется в Европе, США, Японии и во многих других странах с конца 90-х годов XX века, однако в России этот препарат пока не зарегистрирован.
Профилактика рецидивов
Для предотвращения рецидивов ВПЧ-инфекции более предпочтительным является применение интерферона или его индукторов, а также других активаторов противовирусного иммунитета в качестве адьювантной терапии в комбинации с различными деструктивными методами. Иммунные препараты повышают эффективность лечения и позволяют снизить частоту рецидивов. Определенное значение комбинированная иммунотерапия имеет при лечении упорных, плохо поддающихся лечению бородавок.
Для лечения предложены различные методики, основанные на применении иммунных препаратов в сочетании с криотерапией, лазеротерапией, электрокоагуляцией, солкодермом и т.д. (Thin N., 1995). Так, например, выявлено, что сочетание интерферона с лазеротерапией более эффективно, чем только лазеротерапия: полное исчезновение бородавок наблюдается у 52 (81,5%) и 19 (61%) пациентов соответственно (Corwin Vance J., et al., 1990; Hohenleuter U., et al., 1990; Petersen C.S., et al, 1991).
Дополнение СО2-лазерного иссечения терапией низкими дозами альфа-интерферона (по 1-3 млн. МЕ в сутки в течение 5-7 дней, затем перерыв 3-4 недели, курс — 3-4 цикла) повышает эффективность лечения и позволяет снизить процент рецидивов, наблюдающихся после применения только лазеротерапии (Gross G., 1996). При небольших остроконечных кондиломах дополнение лазерной терапии или электрокоагуляции местным применением геля, содержащего бета-интерферон 0,1 млн МЕ/г, 5 раз в день в течение 4 недель эффективно предотвращает рецидивы (Gross G., 1996).
Однако, по данным The Condylomata International Collaborative Study Group (1993), применение альфа-интерферона (3 раза в неделю в течение 4 недель) после удаления всех видимых кондилом СО2-лазером не дает каких-либо положительных результатов в сравнении с плацебо (полное излечение наступило у 18%, рецидивы возникли у 35% больных). По данным Hopel M.R., et al. (1992), сочетание применения альфа-интерферона (3-6 пятидневных курсов с интервалом в 2 недели) с деструктивными и/или хирургическими методами, несмотря на повышение эффективности лечения упорных, неподдающихся терапии кондилом, не предотвращает развитие рецидивов, возникающих у 50% больных.
Для предотвращения рецидивов ВПЧ-инфекции более предпочтительным является применение интерферона или его индукторов, а также других активаторов противовирусного иммунитета в качестве адьювантной терапии в комбинации с различными деструктивными методами
Представляет интерес еще одна группа консервативных методов лечения ВПЧ-инфекции – это иммунные препараты, которые могут применяться самостоятельно или в комбинации с деструктивными методами.
Иммунотропные препараты
Воздействовать на противовирусный иммунитет можно применением индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые согласно инструкции производителя или рекомендациям исследователей могут применяться в комбинированном лечения аногенитальных бородавок в сочетании с различными деструктивными методами.
Гепон
Гепон – синтетический олигопептид, состоящий из 14 аминокислотных остатков. Препарат относится к группе иммуномодуляторов, показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами.
Иммунофармакологическое и противовирусное действия препарата гепон обусловлено тем, что он: — вызывает продукцию альфа- и бета-интерферонов; — мобилизует и активирует макрофаги; — ограничивает выработку цитокинов воспаления (интерлейкинов 1, 6, 8 и фактора некроза опухоли); — стимулирует продукцию антител к различным антигенам инфекционной природы; — подавляет репликацию вирусов; — повышает резистентность организма в отношении вирусных и бактериальных инфекций.
У больных с ослабленной иммунной системой гепон: — увеличивает сниженное содержание CD4+ T- и NK-клеток; — повышает функциональную активность нейтрофилов и CD8+ T-клеток, являющихся ключевыми звеньями защиты организма от бактерий, вирусов и грибов; — усиливает выработку антител, специфичных к возбудителям оппортунистических инфекций, актуальных для данного больного; — предупреждает развитие рецидивов оппортунистических инфекций.
Хотя в инструкции по применению препарата нет прямых указаний на его использование при папилломавирусной инфекции (препарат рекомендуют для повышения иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами), накопленный клинический опыт его назначения позволяет рекомендовать гепон при ВПЧ. Так, например, аппликации гепона на очаги ВПЧ-поражений после их удаления любым деструктивным методом (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снижают уровень рецидивирования (Соловьев А.М., 2003). Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю.
Иммуномакс
Перспективным является применение активатора противовирусного иммунитета – иммуномакса, представляющего собой кислый пептидогликан с молекулярной массой 1000-40000 кДа. Препарат выделен из растений комплексом биохимических методов, включающих ультрафильтрацию и хроматографию. Стерильный препарат иммуномакс выпускается в виде лиофилизированного порошка по 200 ЕД во флаконах для инъекций.
Имеются данные об использовании препарата при клинических проявлениях ВПЧ-инфекции в комбинации с любым из деструктивных методов. Больным удаляют остроконечные кондиломы и одновременно назначают внутримышечные инъекции иммуномакса по 200 ед 1 раз/сут на 1, 2, 3, 8, 9 и 10-й дни лечения (Перламутров Ю.Н. с соавт., 2003). У 68% больных сразу по окончании лечения наблюдается отсутствие рецидивирования кондилом, а после проведения дополнительных сеансов деструкции эффективность лечения достигает 98% (при контрольном наблюдении не менее 3 месяцев).
Эпиген-интим
Эпиген-интим – аэрозольный препарат растительного происхождения для местного применения, основным действующим веществом которого является глицирризиновая кислота, получаемая из корня солодки. Препарат активирует местный иммунитет за счет интерфероногенного действия, повышая при этом способность тканей к защите от инфекций. Глицирризиновая кислота, ингибируя ДНК и РНК вирусов, вызывает их инактивацию, блокирует внедрение активных вирусных частиц через мембрану внутрь клетки, нарушает синтез новых структурных компонентов вирусов. Основным механизмом противовирусной активности глицирризиновой кислоты является ингибирование киназы Р, влекущее за собой угнетение фосфорилирования клеточных и кодируемых вирусом белков в инфицированных клетках и находящихся в свободном состоянии.
Показано, что применение эпигена в комбинированной терапии анаогенитальных бородавок позволяет снизить частоту рецидивов (Чернова Н.И., 2004). Препарат также оказывает противовоспалительное и заживляющее действие, что важно при лечении кондилом деструктивными методами.
При периодическом использовании в течение длительного времени у больных с бессимптомным выделением ВПЧ эпиген оказывает профилактическое действие в отношении клинической манифестации инфекции – при наблюдении в течение 1 года кондиломы появились у 14,7%, тогда как в контрольной группе это произошло у 40% больных (Чернова Н.И., 2004).
Эпиген-интим применяют интравагинально, наружно и интрауретрально. При наружном применении препарат наносят на всю пораженную поверхность с расстояния 4–5 см путем 1–2 нажатий клапана. Интравагинально препарат впрыскивают путем 1–2 нажатий на специальную насадку. Препарат используют до удаления кондилом 3 раза в сутки, на фоне деструкции – 5 раз в сутки в течение 10 и более дней до заживления; для профилактики ближайших рецидивов – 3 раза в день в течение 1 месяца.
Иммунотропные препараты с прямым противовирусным действием
Иммунные препараты повышают эффективность лечения и позволяют снизить частоту рецидивов
Изопринозин (инозин пранобекс)
Изопринозин (инозин пранобекс) – противовирусное средство с иммуномодулирующими свойствами. Препарат нормализует дефицит или дисфункцию клеточного иммунитета, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Изопринозин повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного ?-интерферона и уменьшает продукцию интерлейкина-4 в организме.
Препарат усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Изопринозин также обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК.
Одним из показаний применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза/сут) как дополнение к местной терапии или хирургическому вмешательству в течение 14–28 дней пациентам с низкой степенью риска или 5 дней в неделю последовательно в течение 1–2 нед в месяц в течение 3 мес пациентам с высокой степенью риска.
В литературе описаны различные схемы и результаты применения изопринозина при папилломавирусной инфекции. Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок (Mohanty K.C., et al., 1986). Препарат применяли по 1 г 3 раза/сут в течение 28 дней. Эффективность терапии повышалась с 41 до 94% при добавлении изопринозина к традиционным методам лечения.
Похожие результаты показаны в работах Прилепской В.Н. и соавт. (2007). Добавление к стандартному лечению изопринозина в дозе 1 г 3 раза в сутки в течение 5 дней до проведения деструкции повышает эффективность терапии с 65,6% до 87,5%, в 3 раза снижает частоту рецидивов. Также отмечается высокая частота элиминации ВПЧ из очагов поражения – 65,6%.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия после проведения курсов изопринозина женщинам с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени. Изопринозин назначали по 1 грамму 3 раза/сут в течение 5 дней, 3 курса с интервалом 1 месяц.
Аналогичные результаты – улучшение морфологической картины эпителия вульвы – показаны в исследовании Sun Kuie Tay (1996). Инозин пранобекс назначали по 1 г 3 раза/сут в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, а в группе, принимавшей плацебо – у 16,7%. Для мониторинга и обработки результатов исследования с позиций доказательной медицины в 2008 г. была разработана и внедрена программа «Астра» – общероссийская многоцентровая программа мониторинга, обобщения и формирования статистической отчетности об особенностях и результатах применения изопринозина при лечении заболеваний, ассоциированных с HPV, в условиях обычной медицинской практики. В исследовании участвовали 6191 пациент (5896 женщин и 295 мужчин) (Костава М.Н. и соавт., 2009).
Пациенткам, принявшим участие в исследовании, лечение проводилось в соответствии с выявленными заболеваниями, в комплекс лечения был включен препарат изопринозин. При наличии только остроконечных кондилом вульвы и влагалища проводилась монотерапия изопринозином. Лечение CIN I-II, локализованное на ограниченном участке экзоцервикса, полностью доступное для кольпоскопии, без поражения цервикального канала у 58 пациенток также проводилось препаратом изопринозин. При отсутствии положительного эффекта производили адекватное иссечение пораженной ткани. Рекомендуемые терапевтические дозы изопринозина соответствовали тяжести поражения эпителия вирусом папилломы человека. При выявлении остроконечных кондилом в области вульвы и влагалища изопринозин назначали по 50 мг/кг в сутки в течение 5 дней тремя курсами с перерывом в месяц. При цитологических и гистологических данных, соответствующих CIN I–II, изопринозин применяли по 50 мг/кг/сут, 10 дней в месяц 3 курсами с перерывом в месяц. При субклинических формах ВПЧ-поражений эпителия препарат назначали по 50 мг/кг/сут, курс лечения – от 10 до 21 дня.
До лечения койлоцитоз при нормальной кольпоскопической картине был выявлен у 1367 пациенток, а после лечения – только у 71. Лечение остроконечных кондилом оказалось эффективным у 91% пациенток, комбинированное лечение CIN I – у 90%, комбинированное лечение CIN II – у 82%, лечение субклинической формы ВПЧ-инфекции — у 91% [Костава М.Н. и соавт., 2009].
Недавно был проведен метаанализ результатов применения изопринозина (Елисеева М.Ю. и соавт, 2009). Данные литературы, базирующиеся на 15 источниках, в которых описано 2369 случаев применения изопринозина в качестве монотерапии, 3369 – в комбинации с другими методами, в сравнении с 71 наблюдениями плацебо-контроля и 575 наблюдениями за традиционным лечением свидетельствуют об эффективности вспомогательной иммунотерапии изопринозином на фоне традиционных методов при терапии генитальных поражений, ассоциированных с ВПЧ.
Основным показателем эффективности любого метода удаления аногенитальных бородавок является отсутствие рецидивов. Так как частота рецидивов ВПЧ-инфекции не зависит от метода деструкции поражений (физической, химической или цитотоксической), то для врача на амбулаторном приеме особый интерес представляют методы деструкции, которые могут быть использованы непосредственно в кабинете. Поэтому в данной работе мы постарались сделать акцент на методиках, позволяющих быстро и эффективно бороться с проявлениями ВПЧ-инфекции и ее рецидивов без использования дорогостоящих методов деструкции, доступ к которым есть не в каждой специализированной клинике.
Преимуществом такого лечения является отсутствие риска заражения врача вирусными частицами, в отличие от проведения лазерной деструкции без использования врачом методов защиты. Для профилактики рецидивов ВПЧ-инфекции рекомендуется назначать иммунотропную терапию. Такой подход обеспечит эффективное лечение аногенитальных бородавок, что должно существенно сказаться на всех аспектах контроля ВПЧ-инфекции в популяции, включая уровень ее регистрации.
Основным показателем эффективности любого метода удаления аногенитальных бородавок является отсутствие рецидивов. Так как частота рецидивов ВПЧ-инфекции не зависит от метода деструкции поражений (физической, химической или цитотоксической), то в данной работе мы постарались сделать акцент на методиках, позволяющих быстро и эффективно бороться с проявлениями ВПЧ-инфекции и ее рецидивов. Для профилактики рецидивов ВПЧ-инфекции рекомендуется назначать иммунотропную терапию. Такой подход обеспечит эффективное лечение аногенитальных бородавок, что должно существенно сказаться на всех аспектах контроля ВПЧ-инфекции в популяции, включая уровень ее регистрации.
Следует признать, что даже современные достижения в исследованиях папилломавирусной инфекции и совершенствовании методов диагностики и терапии оставляют ряд нерешенных вопросов – отсутствие стандартов терапии ВПЧ, широкого распространения рекомендаций для пациентов по профилактике ВПЧ инфекции, алгоритмов ведения беременных женщин при ВПЧ.
Профилактика
Чтобы избежать развития заболеваний, связанных с ВПЧ рекомендуется:
- Использовать презервативы при половом контакте.
Это значительно снижает риск заражения генитальными бородавками. - Пройти вакцинацию.
Препарат Гардасил защищает от четырех штаммов ВПЧ, вызывающих рак, и используется для предотвращения генитальных бородавок.Другая вакцина Церварикс, защищает от рака шейки матки, но не от генитальных бородавок.
Рекомендуется проводить плановую вакцинацию против ВПЧ для девочек и мальчиков в возрасте 11 и 12 лет. Если прививки не были сделаны в детстве, рекомендуется, чтобы вакцину получили девушки и женщины в возрасте до 26 лет, а также мальчики и мужчины в возрасте до 21 года.
Препараты эффективны, если их поставить до наступления их сексуальной активности. По результатам исследований выявлено, что люди в возрасте до 21 года и от 21 до 30 лет, которые сделали вакцину против ВПЧ, защищены от инфицирования на 50 %.
Побочные эффекты от вакцин незначительны и выражаются в болезненности места инъекции (плечо), головных болях, снижении температуры или появлении симптоматики гриппа. Иногда после инъекции возникает головокружение или обморок, особенно у подростков.
Бородавки аногентальной области: причины рецидивов и борьба с ними
26.12.2018
1158
1
Аногенитальные бородавки – проявление заболевания, вызванного вирусом папилломы человека (ВПЧ) и характеризующееся появлением экзофитных и эндофитных разрастаний на коже и слизистых оболочках наружных половых органов, уретры, влагалища, шейки матки, перианальной области. ВПЧ относятся к роду папилломавирусов (Papillomavirus). Эти вирусы отличаются высокой тканеспецифичностью и классифицируется на группы высокого и низкого онкогенного риска в соответствии с их потенциалом индуцировать злокачественный рост [5, 6].
При аногенитальных бородавках в 45% случаев обнаруживаются высокоонкогенные типы папилломовирусной инфекции (ПВИ), которые способны инициировать рак шейки матки и другие предраковые и раковые поражения половых органов [8]. В последние годы обсуждается роль ВПЧ в развитии рака мочевого пузыря и рака предстательной железы [9]. В России аногенитальные бородавки регистрируются как инфекции, передаваемые половым путем [8].
Проблема достаточна распространена. В мире ежегодно регистрируется около 32 млн. новых случаев заболевания. В США за последние 40 лет заболеваемость увеличилась в 6 раз [11]. В Европе самый высокий уровень заболеваемости отмечен в Великобритании — 120 случаев на 100 тыс. населения [3, 17]. В Российской Федерации показатель заболеваемости аногенитальными бородавками в 2014 году составил 21,8 случаев на 100 тыс. населения, что существенно отличается от истинной распространенности ПВИ [6, 8].
Основной путь передачи ПВИ у взрослых является половой [12, 16]. У детей возможен трансплацентарный, перинатальный и контактно-бытовой путь инфицирования [6]. Клинические разновидности аногенитальных бородавок варьируют от остроконечных кондилом и образований в виде папул, до проявлений внутриэпителиальной неоплазии [13]. Само наличие аногенитальных бородавок является непосредственным показанием к лечению [14, 16].
Целью лечения проявлений ВПЧ является: 1) деструкция аногенитальных бородавок; 2) улучшение качества жизни пациентов [6, 16]. И если реализация первого пункта в современной медицине проблему не представляет (предложена масса эффективных малоинвазивных способов удаления аногенитальных бородавок), то с улучшением качества жизни больных ПВИ не все так благоприятно, и это связано в большей мере с рецидивами клинических проявлений ВПЧ [17]. Так, например, в 2021 году в Англии по данным служб сексуального здоровья было выявлено 122 тыс. эпизодов генитальных бородавок, из которых 49 % были диагностированы как рецидивы [1].
Склонность к рецидивированию и персистированию ПВИ определяется главным образом высокой стабильностью иммунитета пациента [19]. Причем персистирование вируса в организме связано в большей мере с системной иммунной защитой, в то время как рецидивы клинических проявлений ВПЧ определяет местная иммунореактивность в «проблемной» точке [18]. В пользу данных утверждений свидетельствует тот факт, что проявление ВПЧ-инфекции часто возникает при нарушении целостности кожи, слизистых оболочек, появлению повторных очагов в участках перенесенной деструкции кондилом и при ВИЧ-инфекции, сопровождающейся системной иммуносупрессией [7].
Факторами риска являются нарушения клеточного иммунитета, интерферонового и цитокинового статуса, хронические соматические заболевания (сахарный диабет, онкогематологические процессы и др.), смешанная вирусно-бактериальная инфекция, а также увеличение возраста [9, 11]. Также варианты течения ПВИ могут быть связаны с генетической и фенотипической неоднородностью по признаку резистентности к ВПЧ. Так у лиц с генами HLA DQW3 сцеплены «слабые» гены иммунного ответа на ВПЧ, что способствует хронизации инфекции, а у лиц с другими типами HLA, с генами которых сцеплены «сильные» гены иммунного ответа, развивается транзиторная инфекция, этим так же можно объяснить отсутствие инфекции у части половых партнеров в дискондартных парах [2, 8].
Как бороться с рецидивированием ВПЧ? Современный подход к лечению заболеваний должен осуществляться согласно принятым по данной нозоологии стандартам, разработанным на основании принципов доказательной медицины. В «Федеральных клинических рекомендациях (ФКР) по ведению больных аногенитальными (венерическими) бородавками» есть группа лекарственных средств, заслуживающих внимания именно в свете ограничения рецидивов и персистирования ПВИ, а именно «Иммуномодуляторы для местного применения» [4, 6].
ФКР рекомендуют первой линией терапии использовать крем имихимод (зарегистрирован в России под торговым названием «Вартоцид»), как неивазивное средство, легко применяемое пациентами без контроля врача [4, 6, 10]. Крем наносится тонким слоем на аногенитальные бородавки на ночь (на 6-8 часов) 3 раза в неделю (через день). Утром крем необходимо смыть с кожи теплой водой с мылом. Курсовое лечение продолжают до исчезновения аногенитальных бородавок, но не более 16 недель [4].
Эффективности и безопасности данного вида терапии присвоен высокий уровень доказательности – А, основанный на данных мета-анализов, систематических обзоров, оцененных максимальными баллами и демонстрирующих устойчивость результатов [6]. Также в качестве альтернативного режима лечения ФКР рекомендовано внутриочаговое введение препаратов α-интреферона (уровень доказательности – В) [6, 8].
Применение интерферонов системного действия (интерферона гамма по 500000 МЕ, вводится подкожно, 1 раз в сутки, через день, на курс 5 инъекций) и инозина пранобекса перорально рекомендовано, согласно ФКР, при тяжелом рецидивирующем течении ВПЧ-инфекции (уровень доказательности – А) [6, 11]. Комбинация препаратов для системного воздействия и местных иммуномодуляторов является более эффективной в плане снижения вероятности рецидивирования и дальнейший персистенции ПВИ, и обязательно должна применяться при неудаче лечения одним из компонентов [6].
Список литературы
- Public Health England. Sexually transmitted infections (STIs): annual data tables. Table 1: STI diagnoses and rates in England by gender, 2008 to 2017.https://www.gov.uk/government/statistics/sexually-transmitted-infections-stis-annual-data-tables. Accessed 14 Dec 2021.
- Кицак В.Я. «ВПЧ-негативный» и ВПЧ-негативный рак шейки матки: триггерная роль ВПЧ высокого канцерогенного риска и альтернативных этиологических факторов / В.Я. Кицак // Вестник последипломного медицинского образования.- 2009.- №1.- С. 82-83.
- Desai S, Wetten S, Woodhall SC, Peters L, Hughes G, Soldan K. Genital warts and cost of care in England. Sex Transm Infect. 2011;87:464–8.
- Смирнов В. С., Кудрявцева Т. А. Вартоцид (имихимод). – СПб: Гиппократ, 2021. – 144 с.
- Komericki P, Akkilic-Materna M, Strimitzer T, Aberer W. Efficacy and safety of imiquimod versus podophyllotoxin in the treatment of anogenital warts.Sex Transm Dis. 2011;38(3):216–8.
- «Федеральные клинические рекомендации по ведению больных аногенитальными (венерическими) бородавками». Москва. — 2015. — С.3-11.
- Moore RA, Edwards JE, Hopwood J, Hicks D. Imiquimod for the treatment of genital warts: a quantitative systematic review. BMC Infect Dis. 2001;1:3.13. Arany I, Tyring SK, Stanley MA, Tomai MA, Miller RL, Smith MH, et al. Enhancement of the innate and cellular immune response in patients with genital warts treated with topical imiquimod cream 5%. Antivir Res. 1999;43:55–63.
- Файзуллина Е.В. Клинико-организационные аспекты медицинской помощи пациентам с аногенитальными бородавками как важнейший фактор сохранения репродуктивного здоровья населения / Е.В. Файзуллина, Д.В. Фризин, Л.К. Бунакова // Практическая медицина.- 2012. — № 9 (65). — С. 170-174.
- Kirby P, Dunne A, King DH, Corey L. Double-blind randomized clinical trial of self-administered podofilox solution versus vehicle in the treatment of genital warts. Am J Med. 1990;88(5):465–9.
- Edwards L, Ferenczy A, Eron L, Baker D, Owens ML, Fox TL, et al. Self-administered topical 5% imiquimod cream for external anogenital warts. HPV study group. Human PapillomaVirus. Arch Dermatol. 1998;134(1):25–30.
- Beutner KR, Spruance SL, Hougham AJ, Fox TL, Owens ML, Douglas JM Jr. Treatment of genital warts with an immune-response modifier (imiquimod). J Am Acad Dermatol. 1998;38(2 Pt 1):230–9.
- Arican O, Guneri F, Bilgic K, Karaoglu A. Topical imiquimod 5% cream in external anogenital warts: a randomized, double-blind, placebo-controlled study. J Dermatol. 2004;31(8):627–31.
- Garland SM, Waddell R, Mindel A, Denham IM, McCloskey JC. An open-label phase II pilot study investigating the optimal duration of imiquimod 5% cream for the treatment of external genital warts in women. Int J STD AIDS. 2006;17(7):448–52.
- Fife KH, Ferenczy A, Douglas JM Jr, Brown DR, Smith M, Owens ML, et al. Treatment of external genital warts in men using 5% imiquimod cream applied three times a week, once daily, twice daily, or three times a day.Sex Transm Dis. 2001;28(4):226–31.
- Grillo-Ardila CF, Angel-Muller E, Salazar-Diaz LC, Gaitan HG, Ruiz-Parra AI, Lethaby A. Imiquimod for anogenital warts in non-immunocompromised adults. Cochrane Database Syst Rev. 2014;11:CD010389.
- Lacey CJ, Woodhall SC, Wikstrom A, Ross J. 2012 European guideline for the management of anogenital warts. J Eur Acad Dermatol Venereol. 2013;27(3): e263–70.
- British Association for Sexual Health and HIV. United Kingdom National Guidelines on the Management of Anogenital Warts 2015. London: British Association for Sexual Health and HIV; 2015.
- Schofer H, Van Ophoven A, Henke U, Lenz T, Eul A. Randomized, comparative trial on the sustained efficacy of topical imiquimod 5% cream versus conventional ablative methods in external anogenital warts. Eur J Dermatol. 2006;16(6):642–8.
- Geretti AM, Brook G, Cameron C, Chadwick D, French N, Heyderman RS, et al. British HIV Association guidelines on the use of vaccines in HIV-positive adults 2015. https://www.bhiva.org/vaccination-guidelines.aspx . Accessed 14 Dec 2017.
Комментарии
Вивтенко Лидия Андреевна — 26.12.2018 — 14:22:11
Из12 случаевдоказанного рака простаты-100 процентов наличие онкогенных штамов ВПЧ
Для отправки комментариев необходимо войти или зарегистрироваться
Бородавки на интимных местах: диагностика
Поставить точный диагноз только при внешнем осмотре невозможно.
Чтобы верно определить форму заболевания, врачу потребуется провести лабораторные и инструментальные исследования.
Достоверно установить диагноз может только венеролог, основываясь на клинических проявлениях.
При необходимости диагностики образований на шейке матки/эндоуретральных прибегают к инструментальным методам (кольпо-, уретроскопии).
В ряде ситуаций может потребоваться дополнительное лабораторное изучение (методами ПЦР, гисто-, цитологическое исследования).
Для лабораторных исследований используют анализы крови и пораженных тканей.
Подробная диагностика поможет врачу назначить оптимальное лечение.
Зуд аногенитальной области
К
ожный зуд – дерматологическое заболевание, характеризующееся нестерпимым желанием расчесывать участки кожи.
Зуд, как и тактильная, температурная и болевая чувствительность, воспринимается одними и теми же рецепторами – окончаниями безмиелиновых нервных волокон, находящихся в субэпидермальной зоне. Далее импульс передается по латеральному спино–таламическому тракту к таламусу и чувствительной зоне коры головного мозга.
Чувство зуда может возникать при легком прикосновении, изменении температуры, эмоциональном стрессе, химическом воздействии. Патогенез зуда окончательно не изучен. Показано, что при зуде выделяются медиаторы, в том числе гистамин, кинины, энкефалины, пентапептиды, возбуждающие опиатные рецепторы в головном мозге. Функциональные нарушения взаимосвязи процессов возбуждения и торможения в коре головного мозга, диэнцефальные расстройства, вегетативные дисфункции, изменения регулирующих ферментативных процессов являются важными факторами в патогенезе кожного зуда. Продукты циклооксигеназного окисления арахидоновой кислоты, в частности, циклическая эндоперекись, простагландин Е, подавляют чувство зуда.
Зуд может быть ограниченным или генерализованным, первичным или вторичным. Первичных морфологических элементов при зуде нет. При длительном существовании зуда возникает лихенизация, отдельные блестящие папулезные элементы. На ранних стадиях заболевания имеются экскориации, покрытые геморрагическими корками, может присоединяться вторичная гнойная инфекция, мацерация эпидермиса, экзематизация пораженных участков. При аногенитальной локализации зуда расчесы носят радиальный характер или имеют направление от гениталий к лобку или к анусу.
Зуд носит пароксизмальный характер, приступы его возникают чаще вечером или ночью, но могут быть и днем. Больные жалуются на нарушение сна, бессонницу, потерю аппетита, плохое настроение, раздражительность, отсутствие интереса к окружающему, невротические реакции, исхудание.
Причины кожного зуда
Анальный и генитальный зуд относятся к локальной форме зуда, у большинства больных он распространяется на обе области и диагностируется, как аногенитальный зуд.
Анальный зуд может быть первичным, возникающим вне связи с другими заболеваниями, и вторичным.
Ведущую роль в патогенезе первичного анального зуда играет загрязнение кожи каловыми массами из–за несоблюдения личной гигиены или слабости сфинктера заднего прохода (подтекание кала во время отхождения газов и при растяжении прямой кишки), а также вследствие вегетоневроза с локальным повышением потоотделения. Это приводит к мацерации, раздражению кожи и возникновению зуда. В дальнейшем развивается лихенизация, экзематизация, вторичная инфекция, что, естественно, сопровождается усилением зуда. Возникает порочный круг: зуд – расчесы – лихенизация – усиление зуда.
Вторичный зуд может быть симптомом самых различных заболеваний и патологических состояний, в том числе кожных. Так, кожный зуд является одним из характерных симптомов красного плоского лишая, чесотки, педикулеза, себорейной экземы, различных аллергических дерматитов, псориаза в прогрессирующей стадии, экземы в фазу обострения, микотического (особенно кандидозного) поражения кожи.
Зуд аногенитальной области, как правило, сопровождает паразитарные заболевания: тениоидоз, аскаридоз, описторхоз, амебиаз, лямблиоз и др. Иногда гонорейно–трихомонадная инфекция сопровождается кожным зудом.
Заболевания желудка (гипо– и гиперацидные гастриты, язвенная болезнь, полипоз), кишечника (колиты, дискинезии, дисбактериоз), геморрой, трещины заднего прохода, свищи с мацерирующим отделяемым, аногенитальные бородавки, остроконечные кондиломы также могут сопровождаться аногенитальным зудом. Различные эндокринопатии (сахарный диабет, гипо– и гиперфункция щитовидной железы и др.), патология тазовых органов (аднекситы, эрозии шейки матки, каруроз вульвы, простатиты, уретриты, циститы и др.), почечно–каменная болезнь, хроническая почечная недостаточность, различная патология печени и желчевыводящих путей, онкологическая патология нередко сопровождаются кожным зудом.
Кожный зуд может сопровождать хронические интоксикации (наркомания, алкоголизм, злоупотребление кофе и др.), различные аллергические реакции, в том числе на медикаменты, психические заболевания (патомимия, дерматозойный бред, психозы, неврозы и др.).
Лечение кожного зуда
Лечение кожного зуда, в том числе аногенитальной локализации, должно быть комплексным. Прежде всего необходимо устранить или ослабить воздействие выявленных этиологических и патогенетических факторов (лечение чесотки, педикулеза, амебиаза, глистной инвазии, трихомониаза, эндокринной, печеночной, почечной и др. патологий).
В случаях выраженных воспалительных явлений можно использовать глюкокортикоиды
(преднизолон 10–40 мг в сутки с последующей постепенной отменой препарата).
Антигистаминные препараты
предпочтительно применять во второй половине дня, желательно в инъекционной форме. Препараты кальция показаны в случае преобладания тонуса парасимпатической системы (яркий, быстро появляющийся красный дермографизм). В случае преобладания тонуса симпатической системы препараты кальция следует назначать с осторожностью ввиду возможных осложнений со стороны сердечно–сосудистой системы.
Из наружных средств
используются кортикостероидные мази, охлаждающие водно–спиртовые растворы с ментолом, анестезином, новокаином, лидокаином.
Хорошо зарекомендовал себя Гепатромбин Г
, довольно быстро облегчающий состояние больных. Гепатромбин Г – комбинированный препарат, содержащий гепарин, преднизолон и полидоканол. Гепарин обладает антикоагулянтным и противовоспалительным действием, преднизолон уменьшает воспаление (в том числе аллергическое) и зуд, полидоканол оказывает анальгезирующий эффект. Показаниями к применению Гепатромбина Г наряду с анальным зудом являются геморрой, свищи и трещины заднего прохода. Гепатромбин Г выпускается в виде суппозиториев и мази. Суппозитории вводят в прямую кишку 1–2 раза в сутки, а мазь применяют 2–4 раза в сутки (после стихания обострения – 1–2 раза в сутки). К тубе с мазью прилагается специальный наконечник для введения ее в прямую кишку. Препарат противопоказан при нарушениях гемостаза, специфических (грибковых, микобактериальных) поражениях аногенитальной области, в I триместре беременности.
В зависимости от выраженности невротических реакций показаны седативные средства
, транквилизаторы (валокордин, корвалол, настойка пустырника, валерианы, оксазепам и др.).
Полезным может оказаться включение физиотерапевтических методов в комплекс проводимой терапии (индуктотермия области надпочечников, иглорефлексотерапия, электросон, инфракрасный лазер).
Важным моментом в лечении таких больных является соблюдение личной гигиены (подмывание заднего прохода, присыпки с цеолитами, тальком), исключение контакта с синтетикой.
Интимные бородавки: чем лечить и к кому обращаться?
Для правильного лечения инфекции, ее последствий, необходимо обратиться к дерматологу-венерологу.
Специалист сможет точно выяснить форму течения заболевания и подобрать оптимальное лечение.
При необходимости консультаций других специалистов, их назначит лечащий врач.
Система обязательного медицинского страхования позволяет обратиться за помощью в государственные КВД.
Приема в таких учреждениях можно ждать несколько недель.
Платные услуги доступны пациенту намного быстрее и позволяют выбрать удобное для себя время посещение врача.
Бородавки в интимных местах: лечение
Как же лечить бородавки в интимных местах?
Основным методом лечения подобных образований служит их удаление.
Однако при решении вопроса о том, как избавиться от бородавки в интимном месте, стоит понимать, что аногенитальные бородавки весьма редко перерождаются в злокачественные образования.
Иногда они самопроизвольно пропадают (в период от пары месяцев до двух лет).
Удаление бородавок в интимных местах не позволяет полностью устранить вирус из человеческого организма и не предотвращает возможные рецидивы.
Для разных типов кондилом рекомендуются различные методы терапии, выбор которых – прерогатива лечащего врача.
К таким методикам относятся:
- криотерапия – метод, основанный на низкотемпературном воздействии жидкого азота, не требует обезболивания, хорошо переносится, практически не приводит к формированию рубцов
- хирургическое удаление
- внутриочаговое введение интерферонов
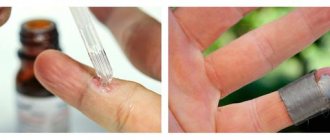
- применение препаратов подофиллина,имиквимода, синекатехинов (в виде мазей, кремов, растворов)
Оно может проводиться пациентом самостоятельно в домашних условиях после подробного инструктирования лечащим доктором;
- применение растворов трихлор- и дихлоруксусных кислот
- комбинированные
Оптимальный вариант лечения может подобрать только врач (так, для внутренних кондилом запрещено применение ряда препаратов, используемых для удаления наружных).
Не стоит забывать про риск озлокачествления образований.
Поэтому нельзя отказываться от рекомендованного врачом гистологического исследования.
Оно поможет точно определить, есть ли в кондиломе злокачественные клетки.
Чтобы понять, как лечить бородавки в интимных местах, важно помнить и о терапевтических вмешательствах.
Разрастание кондилом часто является последствием снижения иммунитета.
Поэтому врач может назначить препараты для его повышения.
Принимать такие лекарства нужно строго по назначению и в рекомендованной врачом дозировке.
Для непосредственной борьбы с возбудителем используются противовирусные препараты.
При правильном их использовании, снижается количество вирусов папилломы человека в крови.
Это минимизирует риск повторного образования кожных наростов.
Причины зуда и жжения в аногенитальной области
Причины дискомфорта в области вульвы могут быть спровоцированы как гинекологической патологией, так и другими факторами.
Гинекологическая патология:
- инфицирование грибами рода Кандида (молочница);
- специфические вульвовагиниты (гонорея, трихомоноз);
- инфекции, передающиеся половым путем (хламидии, микоплазмы);
- дисбактериоз влагалища или гарднереллез;
- беременность;
- генитальный герпес;
- аборты и выскабливания;
- атрофические вульвовагиниты.
Возможно, зуд и жжение спровоцированы средствами, которые вы используете для интимной гигиены. Без выявления причин и их устранения в области гениталий могут развиться язвы, которые довольно сложно поддаются лечению. Запишитесь к врачу и верните себе жизнь без дискомфорта.
Другие причины:
- аллергические реакции (на моющие средства, ароматизаторы, свечи и лубриканты);
- гипотиреоз, сахарный диабет;
- психоэмоциональное напряжение (стрессы, неврозы, депрессии);
- гельминтозы (как правило, острицы);
- нарушение гигиены;
- травмы вульвы (грубый коитус, разрывы во время родов, ношение узкого синтетического белья);
- лечение онкологических заболеваний (химио- и лучевая терапия);
- заболевания пищеварительного тракта;
- лечение антибиотиками и гормонами.
Зуд и жжение в области гениталий всегда являются признаками развития болезни. Даже если проблема исчезла самостоятельно, это не означает, что вы выздоровели. Неприятные симптомы вернутся, а болезнь перейдет в более тяжелую форму. Если вы когда-либо испытывали зуд и жжение к области гениталий, срочно запишитесь к врачу для выяснения причины дискомфорта.