- Причины и симптомы нарушений
- Где находится селезенка и как ее исследуют?
- Есть ли жизнь без селезенки?
Селезенка — малоизученный орган, функции которого медицине до конца не понятны. Многие вообще считают его не важным и чуть ли не лишним. Но на самом деле селезенка являются частью лимфатической системы и выполняет важные защитные функции, участвует в формировании иммунитета. И чтобы найти причину многих неприятностей, нужно сделать МРТ селезенки.
Анатомия.
Также по теме:
АНАТОМИЯ ЧЕЛОВЕКА
Селезенка состоит из нескольких типов ткани. Эмбрионально она происходит из среднего зародышевого листка – мезодермы. Некоторое количество исходных мезенхимных клеток сохраняется в селезенке всю жизнь, тогда как остальные превращаются в лимфоидные и ретикуло-эндотелиальные клетки. Пульпа (мякоть) селезенки состоит преимущественно из последних, а лимфоидные клетки группируются в лимфоидные образования, т.н. мальпигиевые тельца. Селезенка имеет обильное кровоснабжение, ее цвет – тускло-багровый. В дополнение к брюшине (серозной оболочке) она покрыта плотной эластичной фиброзной капсулой с примесью гладкомышечных волокон. Капсула продолжается в толщу органа в виде перекладин – трабекул, образующих остов селезенки и разделяющих ее на дольки. Селезенка непосредственно связана с системой воротной вены (несущей обогащенную питательными веществами кровь от желудочно-кишечного тракта к печени) и большим кругом кровообращения.
Правильная диагностика
Методы установления диагноза:
- Подробный расспрос (характер боли, перенесенные ранее заболевания и т. п.);
- Прощупывание пациента (пальпация), нет ли изменений в размерах органа, чувствительность; подвижность,
- УЗИ (и селезенки, и органов малого таза);
- Пункция;
- Анализ крови (на определение стойкости эритроцитов);
После диагностики определяются методы и способы лечения.
При постановке диагноза заболевания селезенки, очень велика вероятность ошибки. Применять лечение можно только после назначения специалистом.
Рекомендации диетолога
Самый быстрый и эффективный метод наладки функционирования органа – диета.
Употреблять:
- продукты, богатые железом;
- жирная рыба;
- орехи;
- капуста;
- гранат;
- мёд;
- авокадо;
- яблоки;
- цитрусовые.
Не употреблять или сократить до минимума:
- сливочное масло;
- соль;
- кофе;
- кислые фрукты;
- кислые овощи;
- копчености;
- соления;
- алкоголь (строго запрещено).
Принимать пищу необходимо маленькими порциями, не менее 5-6 раз в день.
Лекарственные препараты
Подбор лекарственных препаратов индивидуален. Необходимо устранение нарушений функций селезенки, избежать осложнений.
В случае, когда лечение лекарственными препаратами не даёт результата, решается вопрос операции.
Народные методы лечения
Наряду с лекарственными препаратами, народные средства способны помочь при лечении селезенки.
Основные рецепты:
- Отвар из корней цикория. Заливаем 20 гр. порошка из корня цикория одним стаканом кипятка, настоять 40 минут. Процедить, принимать не горячим, за 30 мин до приема пищи, по 2 ст. л., утром, в обед и вечером.
- Пакетированный экстракт из цикория, принимать по инструкции.
- Отвар из шишек хмеля. Залить стаканом кипятка одну столовую ложку шишек, настоять 30 мин. Процедить. Принимаем: 2 ст. л. три раза в день, до приема пищи.
Эти методы не только помогают лечению селезенки, но и помогают оздоровлению всего организма.
- Травы: листья земляники, цветы фиалки, череда, крапива:
- в равных пропорциях берем и смешиваем.
- 2 столовые ложки трав заливаем 0,5 л. кипятка, настаиваем 1 час. Отвар пить утром в обед и вечером.
- Отвар из пастушьей сумки. Это средство очень эффективно в лечении селезенки:
- 20 г сушеной травы на два стакана кипятка;
- дать настояться не менее 20 мин;
- процеживаем, принимаем 5 раз в день (теплой).
- Также для лечения и предотвращения заболеваний селезенки хорошо помогает изюм. Пятьдесят грамм изюма заливаем 200 мл. виноградного уксуса, на ночь. Принимать по утрам, съедать ягоды и пить не более 30 мл жидкости. Таким способом можно избавиться от опухолей и остановить кровотечения.
- Хорошее лечебное действие оказывают редька и хрен. Необходимо взять крупную редьку, вырезать середину, заполнить ее натертым хреном, сверху положить мед, запечь в духовке.
Принимать по две столовые л. утром и по одной столовой ложке до сна, не менее 10 дней.
Существует еще один метод в народной медицине, который применяют для лечения селезенки – фитоаппликация.
Особенно помогает при увеличении органа. Распаренные травы выкладывают на селезенку по ее форме, сверху накрывают клеенкой и тканью.
Травы должны быть разогреты не более 40 градусов. Время на компресс- 30 минут. Положение – лежа.
Физиология.
Гален считал селезенку органом, «полным таинственности». Известно, что древние греки и римляне удаляли бегунам селезенку, чтобы увеличить скорость бега. Функции селезенки не до конца изучены. Долгое время ее считали эндокринной (лишенной выводных протоков) железой. Поскольку нет достоверных данных о секреторной деятельности селезенки, от этой теории пришлось отказаться, хотя в последнее время она в какой-то степени получила вторую жизнь. Теперь селезенке приписывают гормональную регуляцию функции костного мозга.
Также по теме:
АНАТОМИЯ СРАВНИТЕЛЬНАЯ
На ранних стадиях развития плода селезенка служит одним из органов кроветворения. К девятому месяцу внутриутробного развития образование как эритроцитов, так и лейкоцитов гранулоцитарного ряда берет на себя костный мозг, а селезенка, начиная с этого периода, производит лимфоциты и моноциты. При некоторых болезнях крови, однако, в селезенке вновь появляются очаги кроветворения, а у ряда млекопитающих она функционирует как кроветворный орган в течение всей жизни.
У взрослого человека селезенка выполняет несколько функций. Как часть ретикуло-эндотелиальной системы она фагоцитирует (разрушает) отжившие кровяные клетки и тромбоциты, а также превращает гемоглобин в билирубин и гемосидерин. Поскольку гемоглобин содержит железо, селезенка – один из самых богатых резервуаров железа в организме. Как лимфоидный орган селезенка является главным источником циркулирующих лимфоцитов, особенно в юности и у молодых взрослых. Кроме того, она действует как фильтр для бактерий, простейших и инородных частиц, а также продуцирует антитела; люди, лишенные селезенки, особенно маленькие дети, очень чувствительны ко многим бактериальным инфекциям. Наконец, как орган, участвующий в кровообращении, она служит резервуаром эритроцитов, которые в критической ситуации вновь выходят в кровоток.
Где находится селезенка и как ее исследуют?
Небольшой по размеру орган расположен позади желудка в левом подреберье, поэтому проверить его состояние довольно непросто. Для исследования используют пальпацию, рентген, УЗИ и более совершенные методы томографии. Преимущество МРТ в том, что диагностика дает самое полное представление о расположении, размере, состоянии тканей органа. Кроме того, это самый безопасный метод, который не приносит никакого вреда организму. Можно хоть каждый день проходить обследование, если препятствием не является материальная сторона вопроса.
Но нужно отметить, что стереотипы о недемократичности томографии сильно преувеличены. Цена МРТ селезенки начинается от 2500 рублей (в Москве, а в регионах еще дешевле). На нашем сайте MRT-kliniki.ru можно найти список всех диагностических центров, сравнить стоимость, выбрать клиники с льготными условиями или акциями и записаться на обследование со скидкой до 50%.
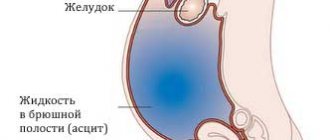
Спленомегалия,
или увеличение селезенки, – характерный ответ органа на множество патологических состояний. Спленомегалия может быть связана с увеличением лимфатических узлов, асцитом (наличием жидкости в брюшной полости), желтухой, лейкопенией (уменьшением количества белых кровяных клеток), лихорадкой, увеличением печени или тяжелой анемией. Она наблюдается при многих сердечно-сосудистых заболеваниях; при многих инфекционных болезнях – малярии, брюшном тифе, оспе, кори, сифилисе, менингите, скарлатине и др.; при болезнях крови – лейкозе, гемолитической желтухе, хронических гемолитических анемиях, обычно врожденных. Иногда увеличение селезенки встречается при болезни Ходжкина; огромных размеров она достигает при хроническом миелолейкозе. Нарушения метаболизма, особенно жирового обмена, тоже часто сопровождаются спленомегалией. Многие заболевания печени отражаются на состоянии селезенки. В первую очередь это касается синдрома Банти, при котором цирроз печени сопровождается застойной спленомегалией и анемией. При наследственном заболевании – болезни Гоше – наблюдается нарушение обмена жиров и спленомегалия.
Поскольку спленомегалия – лишь проявление какого-либо другого заболевания, лечение должно быть направлено на первичную причину. Удаление селезенки показано в редких случаях; иногда оно производится при заболеваниях, связанных с повышенным разрушением в ней эритроцитов или тромбоцитов, в частности при гемолитической желтухе, тромбоцитопенической пурпуре, синдроме Банти, но и тогда улучшения показателей крови можно ожидать лишь в 30–60% случаев.
См. также ЛИМФАТИЧЕСКАЯ СИСТЕМА.
Осложнения аневризмы селезёночной артерии
Разрыв с внутренним кровотечением развивается у большинства пациентов и иногда бывает первым и последним проявлением этого заболевания. Особенно опасен разрыв аневризмы селезёночной артерии у беременных женщин, летальность достигает 70%. Поэтому выявление аневризм у женщин детородного возраста ставит перед врачом вопрос об обязательном хирургическом лечении.
При разрыве появляются симптомы внутреннего кровотечения: слабость, бледность кожных покровов, холодный липкий пот. Отмечается снижение артериального давления и учащение частоты сердечных сокращений. Определяется болезненность при пальпации живота, можно отметить притупление в отлогих местах при перкуссии. На фоне внутреннего кровотечения развивается геморрагический шок и наступает летальный исход.
Профилактические меры
- Приоритет здоровому образу жизни.
- Ограничение употребления алкоголя.
- Физические нагрузки, но не тяжелые. Очень полезен бег (через два часа после еды), частые прогулки на свежем воздухе.
- Часто проверять организм на наличие инфекций.
- Укреплять иммунитет.
- Беречься от всевозможных повреждений, ударов в область живота, падений.
- Сдавать анализ крови каждые полгода.
Жизнь без селезенки
Жить без селезенки возможно. Но важно помнить, что основная функция органа, это защита всего организма от проникновения инфекций и болезнетворных микробов.
Если орган по какой-либо причине отсутствует, то его функции выполняют костный мозг и печень. Очищение крови от заразы нарушается.
Появляется большая вероятность тромбоза, ведь тромбоциты больше не выводятся из организма человека. В этом случае существует необходимость приема лекарственных препаратов, и постоянного наблюдения доктора.
Если селезенку удалили, то вероятность заболеть вирусными инфекциями значительно повышается, особенно этому подвержены дети.
Лапароскопическая спленэктомия
Лапароскопическая спленэктомия является альтернативой открытой операции и при соответствующих мануальных навыках хирурга и достаточном материально-техническом обеспечении учреждения позволяет значительно снизить частоту интра- и послеоперационных осложнений, уменьшить послеоперационный койко-день и улучшить качество жизни больных.
Первая в мире лапароскопическая спленэктомия у девочки, страдающей тромбоцитопенической пурпурой, была проведена Delaitre B. в сентябре 1991 года. В России проф. К.В.Пучковым в марте 1995 года.
Иммунная система человека
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА
Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
Рис.2. Тимус
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
Рис. 3. Небные миндалины
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
Рис. 4. Селезенка
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Рис. 5. Лимфоузел
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!
Врожденный иммунитет на клеточном уровне представляют:
- моноциты – предшественники макрофагов (клетки, пожирающие чужеродные частицы). Образуются в костном мозге, затем поступают в кровь, но быстро ее покидают, превращаясь в тканевые макрофаги и дендритные клетки (рис. 7);
Рис.7. Моноцит
- макрофаги и дендритные клетки расположены в коже, слизистых. Обладают подвижностью, переносятся с током крови и лимфы. Они поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Дендритные клетки ветвятся подобно дереву. Благодаря ветвям-антеннам они работают связистами между врожденным и приобретенным видами иммунитета(рис.8);
Рис.8. Дендритная клетка и
и макрофаг
- клетки крови, содержащие в цитоплазме гранулы (гранулоциты): нейтрофилы, эозинофилы и базофилы (рис.9);
Рис.9. Гранулоциты
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
- натуральные (естественные) киллеры или NK-клетки (англ. Natural killer cells, NK cells) – тип цитотоксических лимфоцитов, участвующий в функционировании врождённого иммунитета. Они на высокой скорости уничтожают клетки, инфицированные бактериями и вирусами, а также опухолевые клетки.
Рис.10. Натуральный киллер
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
- белки, связывающие ионы металлов (железа, цинка), необходимых для жизнедеятельности и размножения патогенов – лактоферрин, кальпротектин, мембранный белок и другие;
- ферменты, генерирующие окислители – кислород и оксид азота:
- ферменты, способные расщеплять клеточную мембрану патогенов – лизоцим, хитиназа, фосфолипаза А2;
- белки и пептиды, нарушающие целостность клеточной оболочки микроорганизма – комплемент, эозинофильный протеин, дефензины и другие.
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Рис.16. Адаптивный
иммунитет
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
Адаптивный иммунитет основывается на трех главных процессах:
- распознавание антигенов (как правило чужеродных для организма) с помощью рецепторов;
- удаление (элиминация) распознанных чужеродных агентов (рис. 17);
- формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять этот антиген при повторном его распознавании.
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.
С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
| Обозначение кластера | Клетки |
| CD 10, CD34 | Лимфоидная стволовая клетка |
| CD3 | Т-лимфоцит |
| CD4 | Т-хелпер |
| CD8 | Т-киллер |
| CD19, CD72, CD79 и др. | В-лимфоцит |
| CD16/ CD56 | NK-клетки |
| CD14, CD64 | Моноцит/макрофаг |
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
- Т-киллеры (их еще называют CD8+ Т-лимфоциты), которые подобно NK-клетке (натуральному киллеру), выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени;
- Т-хелперы (от английского helper – помощник). Они еще обозначаются как Th-клетки, CD4+ T-лимфоциты. Активированные Т-хелперы продуцируют хемокины и цитокины, участвующие в иммунном процессе (рис.19);
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
- Т-супрессоры (Ts) подавляют (супрессируют) реакции В-лимфоцитов и блокируют Т-хелперы. Притом эти клетки вовсе не устраивают саботаж иммунным процессам и не вредят здоровью. Они просто регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители (тушить пожар, а не костер);
- Т-регуляторные клетки (Tr1) влияют на образование зернистых лейкоцитов (гранулоцитов), которых мы уже представляли в качестве макрофагов.
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
| Результат молекулярного исследования | Тест на антитела | Интерпретация | |
| IgM | IgG | ||
| Положительный | Отрицательный | Отрицательный | Острая инфекция |
| Положительный | Положительный | Отрицательный | Острая инфекция |
| Положительный | Положительный | Положительный | Инфицированный пациент |
| Положительный | Отрицательный | Положительный | Инфицированный или повторно инфицированный пациент |
| Отрицательный | Положительный | Отрицательный | Ранние стадии инфекции. Требуется дополнительное исследование |
| Отрицательный | Положительный | Положительный | Инфекция. Требуется дополнительное исследование |
| Отрицательный | Отрицательный | Положительный | Постинфекционный период |
| Отрицательный | Отрицательный | Отрицательный | Неинфицированный пациент |
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
- симптомов, которые могут быть признаками первичных иммунодефицитов:
- 4 и более случаев отита в течение года;
- 2 и более синусита в течение года;
- низкая эффективность антибиотиков в течение двух и более месяцев приема;
- 2 и более случаев пневмонии в течение года;
- невозможность ребенка набирать вес и нормально расти;
- частые и глубокие абсцессы кожи и внутренних органов
- постоянный кандидоз полости рта и кожи;
- необходимость внутривенного введения антибиотиков для разрешения инфекции;
- две и более системных инфекции, включая сепсис;
- наследственная предрасположенность.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
- 1-я группа – преимущественно гуморальные, или В-клеточные ПИД;
- 2-я группа – комбинированные ПИД (при всех Т-клеточных иммунодефицитах есть нарушение функции В-клеток);
- 3-я группа – ПИД, обусловленные дефектами фагоцитоза;
- 4-я группа – ПИД, обусловленные дефектами в системе комплемента.
Таблица 3. Некоторые первичные иммунодефициты
| Патология | Симптомы | Диагностика | Лечение |
| Дефекты антителообразования | |||
| Агаммаглобулинемия | Частые бактериальные инфекции | Дефицит или полное отсутствие В-лимфоцитов | Антибиотики, пожизненное введение IgG |
| Общая вариабельная иммунная недостаточность | Частые респираторные инфекции, отиты | Дефекты Т- и В- лимфоцитов | Антибиотики, пожизненное введение IgG |
| Комбинированные ПИД | |||
| Атаксия-телеангиоэкстазия (синдром Луи-Бар) | Аномалия двигательной функции, слабость мышц, нарушение речи | Дефицит Т- и В- лимфоцитов | Симптоматическое |
| ПИД, обусловленные дефектами фагоцитоза | |||
| Хроническая гранулёматозная болезнь | Частые пневмонии, гнойные инфекции | Генетический дефект | Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма |
| ПИД, обусловленные дефектами в системе комплемента | |||
| Наследственный ангионевротический отек | Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни | Низкая концентрация ингибитора эстеразы С1 | Введение концентрата ингибитора эстеразы С1 |
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
| Возраст, лет | Виды поддержки | |||
| семьи | врача | психолога | общества | |
| 0-14 | +++ | + | + | +++ |
| 14-18 | +++ | + | +++ | +++ |
| 18-65 | + | ++ | + | +++ |
| Старше 65 | + | ++ | ++ | +++ |
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
- аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги;
- мишенями для антител могут стать рецепторы на поверхности клетки.
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
- аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
- гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток;
- гиперчувствительность II типа характеризуется присутствием антител, распознающих его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и (IgM);
- гиперчувствительность III типа обусловлена иммунными комплексами, состоящими из антигенов, белков комплемента, IgG и IgM;
- гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2-3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги.
Эффективные методы воздействия на иммунитет:
- регулярная вакцинация по скорости и качеству реакции превышает естественный процесс формирования иммунитета на конкретную инфекцию;
- сбалансированное питание, обеспечивающее поддержание нормального обмена веществ;
- регулярные физические нагрузки, обеспечивающие физиологическое функционирование всех систем организма, поддержание оптимальных показателей массы тела;
- отказ от вредных привычек, приводящих к зависимостям (алкогольной, никотиновой, наркотической, токсической, компьютерной);
- режим дня, особенно влияние циркадных ритмов (смена дня и ночи): во время бодрствования пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины; во время сна достигает своего пика формирование Т-клеток памяти.
Спекулятивные методы вокруг иммунитета:
- прием иммуностимуляторов клинически не оправдан. Если постоянно стимулировать выработку лейкоцитов лекарственными средствами, иммунная система начнет утрачивать свои непосредственные функции. Вот тогда и наступает момент начала серьезных проблем с иммунитетом. Совершенно не влияют на иммунную систему природные адаптогены: лимонник китайский, женьшень, элеутерококк, радиола розовая. Они воздействуют, как усилители синтеза РНК и белков (основу человеческих клеток), активизируют ферменты обмена и работу эндокринной и вегетативной систем;
- прием витаминов явно переоценен. Положительное влияние на иммунную систему оказывает витамин D, который стимулирует образование Т-киллеров. Все остальные группы витаминов прямого участия в функционировании иммунной системы не принимают;
- банные процедуры и сауна на иммунную систему не влияют;
- народные средства, такие как мед и чеснок обладают легким бактерицидным, но не иммуногенным действием.
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.
Причины развития и группы риска
Злокачественные опухоли развиваются в результате мутаций, которые возникают в клетках. Эти мутации затрагивают гены, регулирующие клеточное размножение, апоптоз (запрограммированную клеточную гибель), восстановление поврежденной ДНК. Почему такие мутации произошли в каждом конкретном случае — сказать сложно.
Некоторые условия повышают вероятность развития рака — их называют факторами риска. Если говорить о самой распространенной разновидности рака селезенки — лимфоме, то факторы риска будут следующими:
- Возраст. С годами в клетках тела человека накапливаются мутации и повышается вероятность развития различных типов рака.
- Пол. Мужчины болеют чаще.
- Семейный анамнез: если лимфома была диагностирована у близких родственников.
- Нарушения со стороны иммунной системы: ослабленный иммунитет, аутоиммунные заболевания.
- Воздействие на организм некоторых вредных веществ.
- В ходе некоторых исследований была обнаружена связь между хроническим гепатитом C и B-клеточной неходжкинской лимфомой.