Фармакологические свойства препарата Налоксон-м
Налоксон является конкурентным антагонистом опиатных рецепторов и относится к группе так называемых чистых антагонистов опиатных рецепторов. Блокирует преимущественно m-рецепторы и благодаря значительному сродству с этими рецепторами налоксон вытесняет наркотические анальгетики из мест связывания, ликвидируя таким образом симптомы передозировки опиоидов и устраняет действие как эндогенных опиатных пептидов, так и экзогенных опиоидных анальгетиков; в меньшей степени влияет на другие опиатные рецепторы. Введение налоксона предотвращает, ослабляет или устраняет (в зависимости от дозы и времени введения) эффекты опиоидных анальгетиков, восстанавливает дыхание, уменьшает седативное действие и эйфорию, ослабляет гипотензивный эффект. Налоксон устраняет действие широкой группы наркотических средств как агонистов, так и агонистов-антагонистов опиатных рецепторов: морфина, апоморфина, диаморфина (героина), кодеина, дигидрокодеина, тримеперидина, метадона, пентазоцина, фентанила, бупренорфина. Препарат устраняет центральные и периферические токсические симптомы: угнетение дыхания, сужение зрачков, замедление опорожнения желудка, дисфорию, кому и судороги, а также анальгетический эффект наркотических анальгетиков, кроме того, он устраняет токсическое действие высоких доз алкоголя. Налоксон эффективен также в борьбе с нарушениями функции дыхания при смешанных отравлениях, вызванных опиоидными средствами в сочетании с барбитуратами, бензодиазепинами и алкоголем. Налоксон провоцирует синдром отмены у больных с опиоидной зависимостью. Препарат не обладает анальгезирующей активностью, не вызывает дисфории и психомиметических симптомов, развития привыкания и формирования лекарственной зависимости. При в/в введении действие препарата начинается уже через 0,5–2 мин, продолжительность действия составляет 20–40 мин. При в/м или п/к введении действует через 2–3 мин, продолжительность действия — 2,5–3 ч. Средний период полураспада — 1–1,5 ч; у новорожденных более длительный (3 ч). Налоксон метаболизируется в печени с образованием глюкуронидов. Метаболиты выводятся с мочой. Применение при печеночной и почечной недостаточности не изучено. Проникает через гематоэнцефалический и плацентарный барьеры.
Антидот по рецепту. Никита Сологуб – о дефицитном налоксоне
Передозировка – основная причина смерти потребителей опиоидных наркотиков. Она случается по разным причинам: получить передозировку можно, если наркотик слишком чистый или слишком грязный, если потребитель принимает опиаты вместе с алкоголем, седативными препаратами и стимуляторами или если из-за привыкания организма ему кажется, что прежней дозы уже недостаточно. По словам главного нарколога Минздрава Евгения Брюна, ежегодно в России от передозировки умирают около 8 тысяч человек; в Москве около полутора тысяч из них. При этом, отмечает Брюн, в подавляющем большинстве таких случаев (в 85%) смерть наступает до приезда скорой.
РС в Телеграме
РС в Google новостях
РС в мобильном
Единственный препарат, который, по мнению подавляющего большинства специалистов, реально снижает смертность от передозировки, – антагонист опиоидных рецепторов налоксон. Этот препарат задействует те же рецепторы мозга, что и героин и другие опиоиды, вытесняет и блокирует их действие на 30–90 минут, помогая восстановить дыхание, помогая избежать смерти. Блокирование опиоидных рецепторов – исключительное назначение этого препарата; наркопотребитель не получит от него «кайф», а если ввести налоксон человеку, который не употребляет опиаты, то с ним вообще ничего не произойдет, как если бы он получил инъекцию воды.
В 2014 году Всемирная организация здравоохранения опубликовала рекомендации для снижения уровня смертности от передозировок, в том числе призвав мировое сообщество разработать программы по расширению доступа к налоксону. В разных странах ситуация и выглядит по-разному: где-то налоксон попросту негде приобрести, где-то программы снижения вреда работают на государственном уровне и антидот отпускается без рецепта и выдается сотрудникам всех служб, которые могут столкнуться со случаями передозировок, от полиции до скорой помощи. Большое количество смертей от передозировок и возрастающее понимание проблемы на политическом уровне склоняет все больше стран ко второму варианту.
В России налоксон – один из девяти антидотов, включенных в перечень жизненно необходимых, важнейших лекарственных препаратов. Тем не менее отпускается он строго по рецепту. Вероятно, это связано с формой выпуска: в России отпускают по рецептам все препараты, которые нужно вводить внутривенно или внутримышечно, даже воду для инъекций. Поскольку российские медики зачастую пренебрежительно относятся к жизням наркопотребителей, большинство из них, даже зная о существовании налоксона, не пойдут к врачу за рецептом на него, а если бы пошли, то вряд ли бы рецепт получили.
«Какое-то время назад мы подумали: раз налоксон отпускается по рецепту, то любой наркозависимый может прийти в обычный районный наркодиспансер и сказать: «Я колюсь героином, чтобы снизить риск передозировки, выпишите мне рецепт на налоксон, я его куплю, пусть он у меня лежит, и мама если что мне его вколет, пусть знает, что он есть», – рассказывает сотрудник Фонда содействия защите здоровья и социальной справедливости имени Андрея Рылькова (организация, выполняющая, по мнению Министерства юстиции РФ, функции иностранного агента) Максим Малышев. – Пару месяцев назад мы такой эксперимент провели, двое наших знакомых сходили в свои наркодиспансеры. Наркологи не дают рецепты, они говорят: «Мы не должны его давать, мы наркологи, но налоксон мы не выписываем». То есть никак не мотивируют, не объясняют». А из Филиала №6 ГБУЗ «Московского научно-практического центра наркологии ДЗМ» на запрос Фонда имени Рылькова пришел такой ответ: налоксон применяется только «либо в скоропомощных условиях, либо в условиях стационара».
Фонд имени Рылькова борется за повсеместный доступ наркопотребителей к налоксону уже много лет. 31 августа 2015 года, в Международный день повышения осведомленности о передозировках, активисты Фонда и Евразийской сети людей, употребляющих наркотики, провели пикетирование Минздрава и Московского научно-практического центра наркологии. Участники акции требовали придать препарату безрецептурный статус и информировать потребителей наркотиков (в частности, тех, которые проходят лечение в государственных наркологических больницах) о существовании налоксона. Вскоре доктор Брюн пообещал раздать 30 тысяч упаковок налоксона московским наркопотребителям, находившимся на лечении в наркодиспансере. Однако на лечение отправляются немногие, большинство предпочитают не прибегать к помощи медиков в решении своих проблем. Поэтому многие по-прежнему рискуют умереть от передозировки.
Люди, чьи жизни налоксон может спасти, продолжают погибать
Чтобы спасти этих людей, в 2014 году волонтеры Фонда имени Рылькова начали раздавать налоксон в своем офисе и во время уличной работы. В то время на российском рынке были представлены три варианта этого препарата: от испанского, польского и российского производителей, сейчас лишь один (от Московского эндокринного завода). Приобретали его активисты через интернет-аптеки, которые не спрашивали рецепт. В среднем на одну закупку уходило около 10 тысяч рублей (это примерно 50 пачек, в каждой по 10 ампул, или 500 потенциально спасенных от передозировки жизней). Чтобы не создать Фонду проблем с налоговой инспекцией, сотрудники и волонтеры закупают препарат на собственные средства. Фонд ведет статистику: в 2014 году об использовании налоксона при передозировке сообщили 223 наркопотребителя, с которыми работал Фонд, в 2015-м – 194, в 2016-м – 318, в 2017-м – 423. Хоть эти подсчеты и приблизительны, таким образом можно предположить, сколько жизней было спасено благодаря этому препарату.
Фонд имени Рылькова вот уже более трех лет переписывается с Минздравом в надежде изменить позицию государства по вопросу о рецептурности препарата. «Это разговор немого с глухим. Мы задаем конкретные вопросы: почему, основываясь на каких исследованиях, было принято решение сделать налоксон рецептурным? Они долго готовят ответ – после каждого запроса мы ждем не меньше месяца, но получаем абсолютно бессодержательную отписку», – говорит Малышев. В 2015 году, например, в ответ на запрос из министерства сообщили, что рецептурность препарата определяется «в процессе экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного средства», которая проводится при его госрегистрации. Позже добавили: «Спектр показаний к применению, способ введения препарата не соответствуют принятой концепции отпуска безрецептурных препаратов в России».
Выходом могло бы стать производство препарата в форме, не предполагающей отпуск из аптек по рецепту (например, интраназальный налоксон свободно продается в США). Поскольку единственным предприятием на российском рынке, реализующим налоксон, остался Московский эндокринный завод, активисты Фонда обратились к его руководству с предложением добавить новую форму выпуска, однако обращение попросту проигнорировали. Не так давно из российских аптек пропал и инъекционный налоксон. Как говорит Малышев, проблемы начались в апреле 2021 года: в интернет-аптеках сотрудникам Фонда стали отвечать, что в наличии остались лишь одна-две пачки препарата, и закупить на 10–15 тысяч рублей, как раньше, стало невозможно. В июле налоксон пропал из продажи окончательно – в аптеках обещали, что препарат появится со дня на день, но потом выяснилось, что поставщики перестали его закупать.
В конце октября в ответ на запрос из Московского эндокринного . Малышев объясняет этот ответ так: «Видимо, МЭЗ не производит налоксон самостоятельно, но покупает субстанцию, и на заводе ее разливают по ампулам, доводят до товарного вида, а старого поставщика по каким-то причинам пришлось поменять. Теперь наверняка эту субстанцию тоже нужно будет сертифицировать, и пока налоксон дойдет до аптек, пройдет два-три месяца». В офисе Фонда имени Рылькова сегодня, когда отмечается Всемирный день борьбы со СПИДом, осталось всего две пачки налоксона из 13, который Малышев привез из своей последней поездки за границу.
Фонд Андрея Рылькова — единственная организация, которая пытается информировать наркопотребителей о существовании налоксона и обеспечивать доступ к нему. Но Фонд сейчас в основном занят тем, что пытается собрать деньги на выплату неподъемного штрафа в размере 800 тысяч рублей за газетную статью, в которой рассказывалось о последствиях употребления «солей». «Налоксон — жизненно важное лекарственное средство, способное спасать человеческие жизни, и очень важно, чтобы оно было доступно людям, которые употребляют опиаты, и их родственникам, и друзьям, чтобы в критический момент можно было спасти жизнь близкого человека», — считает президент Фонда Рылькова Анна Саранг.
На государственном уровне на проблему отсутствия налоксона на рынке пока не обратили внимания. А люди, чьи жизни налоксон может спасти, продолжают погибать.
Никита Сологуб – журналист
Высказанные в рубрике «Блоги» мнения могут не отражать точку зрения редакции
Показания к применению препарата Налоксон-м
Передозировка наркотических анальгетиков, бензодиазепинов, барбитуратов, кома при остром алкогольном отравлении. В анестезиологии используется для ускорения выхода из наркоза, нейролептанальгезии, при угнетении дыхательного центра, вызванном галотаном или кетамином, при операциях по поводу фокальной эпилепсии, перед завершением управляемого дыхания; для восстановления дыхания у новорожденных после введения роженице опиоидных анальгетиков; при шоке в комбинированной терапии; в качестве диагностического средства у больных с подозрением на опиоидную зависимость.
Налоксон (Naloxone)
Раствор для инъекций Налоксон применяют внутривенно струйно (инъекция), внутривенно капельно (инфузия), а также внутримышечно и подкожно. Дозу устанавливает врач индивидуально для каждого пациента. Внутримышечные й подкожные инъекции назначают в случае, когда внутривенное введение невозможно.
В острых случаях следует отдавать предпочтение внутривенному применению препарата, так как оно обеспечивает самый быстрый терапевтический эффект.
При введении внутримышечно эффект препарата проявляется позднее, но длится дольше (по сравнению с внутривенным применением).
Продолжительность действия раствора для инъекций Налоксон зависит от введенной дозы, пути введения и колеблется в пределах от 45 мин до 4 ч.
Так как действие некоторых опиоидов длится дольше, чем действие налоксона, пациенты должны находиться под непрерывным медицинским наблюдением, а повторные дозы можно назначать только в случае необходимости.
При передозировке опиоидов.
Взрослые
Начальная доза составляет 0,4 — 2 мг внутривенно. Если дыхание не восстанавливается, введение следует повторить через 2 — 3 мин. Налоксон можно также вводить внутримышечно, начальная доза — 0,4 — 2 мг, если внутривенное введение невозможно. Если при введении налоксона в дозе 10 мг состояние пациента не улучшилось, можно сделать вывод, что угнетение дыхательного центра вызвано другими факторами или другими препаратами, а не опиоидами.
Дети
Рекомендованная начальная доза — 0,01 мг на 1 кг массы тела внутривенно Если желаемый эффект не достигнут, налоксон вводится повторно в дозировке 0,1 мг на 1 кг массы тела. В зависимости от состояния пациента может быть показана внутривенная инфузия. Если внутривенное введение невозможно, препарат вводят медленно, внутримышечно или подкожно в начальной дозе 0,01 мг на 1 кг массы тела. При необходимости возможно повторное введение.
При угнетении дыхательного центра, вызванном опиоидами.
Взрослые
Дозы определяет врач индивидуально с целью нормализации функции дыхания при поддержке адекватной анальгезии. Внутривенная инъекция налоксона в дозе 0,1 — 0,2 мг (приблизительно 0,0015 — 0,003 мг на 1 кг массы тела) обычно является достаточной. При необходимости дополнительно можно вводить 0,1 мг с интервалом 2 мин до полного восстановления дыхания и сознания. Дополнительноевведение может понадобиться в период от 1 до 2 ч — в зависимости от типа действия активного вещества (кратковременный эффект или замедленное действие),
относительно которого налоксон является антагонистом, его применяемого количества, длительности и способа введения.
Альтернативно препарат можно применять как внутривенную инфузию.
Продолжительность действия некоторых опиоидов больше продолжительности действия налоксона, введенного внутривенно болюсно. Поэтому если угнетение дыхательного центра вызвано такими веществами или есть подозрение на это, препарат следует применять в виде внутривенной инфузии. Скорость введения зависит от состояния пациента, а также его реакции на внутривенную инъекцию и инфузию. Следует рассмотреть возможность непрерывной внутривенной ин и при необходимости применить меры для поддержания дыхания.
Дети
Начальная доза раствора для инъекций Налоксон составляет 0,01 — 0,02 мг на 1 кг массы тела внутривенно в течении 2-3 мин до полного восстановления дыхания и сознания. Дополнительно дозы можно назначать с интервалом 1 — 2 ч в зависимости от реакции пациента, дозы и длительности действия применяемых опиатов.
Для восстановления дыхания у новорожденных после введения роженице опиоидных анальгетиков.
Обычная доза — 0,01 мг на 1 кг массы тела внутривенно. Если при применении этой дозы дыхательная функция не восстанавливается, введение можно повторить через 2-3 мин. При невозможности внутривенного введения налоксон вводят внутримышечно или подкожно в начальной дозе 0,01 мг на 1 кг массы тела.
Пациенты пожилого возраста
У пациентов пожилого возраста с сердечно-сосудистыми заболеваниями, или которые получали кардиологические препараты, препарат следует применять с осторожностью. Следует учитывать такие нежелательные эффекты, как тахикардия и фибрилляция желудочков у послеоперационных больных во время назначения Налоксона.
В качестве диагностического средства у больных с подозрением на опиоидную зависимость.
Начальная дозировка для взрослых — 0,4 — 2 мг внутривенно. Необходимо ввести дважды с трехминутным интервалом. Если при введении налоксона в дозе 10 мг мсостояние пациента не улучшилось, можно сделать выыод, что угнетение дыхательного центра вызвано другими фаторами или другими препаратами, а не опиоидами.
Послеоперационное применение: ускорение выхода пациента из общей анестезии, перед окончанием управляемого дыхания ( послеоперационно препарат применяется только в случае введени опиоидных анальгетиков во время анестезии).
Обычная доза составляет 0,1 — 0,2 мг внутривенно, что соответствует 0,0015 — 0,003 мг на килограмм массы тел. Дозу следует титровать в соответствии с индивидуальной реакцией пациента на введение препарата. Для сохранения адекватного обезболивания и оптимального восстановления дыхания, налоксон необходимо вводить медленно по 0,1 мг. Следующие 0,1 мг вводятся повторно спустя 2 минуты после первой инъекции. Дополнительное введение налоксона может быть необходимо в течение одного — двух раз в час в зависимости от реакции пациента и продолжительности действия введенных ранее опиоидов.
— Разведение раствора
Для внутривенной инфузии раствор для инъекций Налоксон разводят 0,9 % раствором натрия хлорида или 5 % раствором глюкозы. Содержимое 5 ампул препарата (2 мг) разводят в 500 мл в одном из перечисленных растворителей до получения концентрации готового раствора 0,004 мг/мл.
Перед применением необходимо проверить раствор (также и после разведения) на прозрачность.
Применяется только прозрачный, бесцветный, без видимых частичек раствор.
Применение препарата Налоксон-м
Доза препарата и путь введения зависят от состояния больного и количества опиоидного средства, находящегося в организме. При передозировке наркотических анальгетиков Налоксон-М вводят в/в (медленно капельно, в течение 2–3 мин), в/м или п/к: взрослым — в дозе 0,4 мг. При угрожающих жизни состояниях предпочтителен в/в путь введения. При недостаточном эффекте препарат вводят повторно в той же дозе через каждые 3–5 мин до восстановления сознания и спонтанного дыхания. Если после введения суммарной дозы препарата 10 мг не наступает восстановление сознания и дыхания, то диагноз отравления опиоидными анальгетиками ставится под сомнение. Начальная доза для детей составляет 0,005–0,01 мг/кг массы тела. При необходимости возможны повторные введения препарата. Для ускорения выхода из хирургического наркоза Налоксон-М назначают в/в взрослым в дозе 0,1–0,2 мг (0,0015–0,003 мг/кг массы тела); детям — 0,001–0,002 мг/кг массы тела через каждые 2–3 мин до появления спонтанного дыхания и восстановления сознания больного, но без отчетливых болевых ощущений и дискомфорта. Если желаемого эффекта нет, повторно вводят препарат в дозах до 0,1 мг/кг массы тела через каждые 2–3 мин. При невозможности проведения в/в инъекции препарат вводят в/м или п/к дробными дозами. Для новорожденных начальная доза составляет 0,01 мг/кг массы тела. Введение можно повторить в соответствии с принципами применения у взрослых с послеоперационным угнетением дыхания на фоне применения опиоидных анальгетиков. При депрессии дыхания у новорожденных, вызванной введением опиоидных анальгетиков во время родов, Налоксон-М вводят в дозе 0,1 мг/кг массы тела в/м, п/к или в/в. Перед введением препарата необходимо удостовериться в проходимости дыхательных путей у новорожденного. Возможно профилактическое в/м введение 0,2 мг (0,06 мг/кг массы тела). Для диагностики опиоидной зависимости Налоксон-М вводят в дозе 0,8 мг в/в и наблюдают за состоянием больного с целью выявления признаков синдрома отмены.
История опийных антагонистов, и в частности налоксона, как одного из членов этой группы фармпрепаратов, берёт свое начало в середине XX века, когда были синтезированы первые аллильные производные дериватов опия [1–3]. В результате экспериментальных испытаний полученных соединений выяснилось, что замещение метильной группы при атоме азота морфинанового ядра опиоидов более массивными углеводородными радикалами (рис. 1) сопровождается существенным увеличением аффинитета (сродства) такой модифицированной молекулы к опиатным рецепторам головного мозга [4–6].
Рис. 1. Замещение метильной группы (–CH3) при атоме азота морфинанового ядра опиоидов углеводородными радикалами (–R3)
Из нейрофизиологии известно, что для нормального прохождения нервного импульса через синапс необходимо, чтобы молекулы лигандов (веществ, способных взаимодействовать с соответствующими рецепторами, в данном случае — опиоидов), после взаимодействия с рецепторами постсинаптической мембраны быстро удалялись из синаптической щели или ферментативно разрушались в ней, дабы освободить место для следующей их порции. Возросший аффинитет упомянутых модифицированных опиоидов приводил к тому, что они дольше обычного задерживались на опиатных рецепторах, медленнее удалялись из синаптической щели и, следовательно, нарушали передачу нервных импульсов в синапсах системы эндогенных опиоидов, имеющих отношение к управлению восприятием болевых стимулов и к формированию эмоций. Таким образом, у синтезированных соединений появились свойства опийных антагонистов.
В процессе химического преобразования «чистых» опийных агонистов (наркотиков) были получены вещества с промежуточными свойствами, т. н. агонисты-антагонисты, а также «чистые» опийные антагонисты (рис. 2), что следует считать примером классического перехода количества (аффинитета к рецепторам) в качество (агонизм-антагонизм). При этом только «чистые» опийные антагонисты, а именно налоксон и налтрексон, могут быть с полным правом названы блокаторами опиатных рецепторов.
Рис. 2. Изменение свойств опиоидов (от агонистических к антагонистическим) по мере увеличения их аффинитета к опиатным рецепторам
За полвека клинического применения блокаторов опиатных рецепторов мировое медицинское сообщество прошло все стадии известной эволюции взглядов на любое новое средство: «энтузиазм — разочарование — заслуженное место в повседневной практике». Наиболее наглядное представление об этой эволюции даёт динамика численности публикаций, посвящённых блокаторам опиатных рецепторов, в медицинских журналах мира (рис. 3), по данным информационной системы Национальной медицинской библиотеки Соединённых Штатов Америки «MedLine» [7].
Рис. 3. Динамика численности публикаций, содержащих в названии слова «naloxone» или «naltrexone» по результатам поиска в информационной системе MedLine [7]
Важно отметить, что большинство публикаций было посвящено именно налоксону (всего 4623 статьи, по состоянию на 01.01.2007 г.), что позволяет отнести данный препарат к числу наиболее изученных лекарственных средств в истории фармакологии. Другой известный блокатор опиатных рецепторов — налтрексон более чем в три раза уступает налоксону по данному показателю (всего 1502 статьи, по состоянию на 01.01.2007 г.).
Хорошо заметно, что пик интереса к налоксону наблюдался в 80-х годах XX столетия. Затем наступил спад, который продолжался до рубежа тысячелетий и, наконец, в последние годы наблюдается стабилизация динамики публикаций с признаками оживления интереса мировой общественности к данному препарату. Причины этого оживления кроются в продолжающемся росте численности лиц, зависимых от опиоидов, в современном мире (основной контингент, нуждающийся в назначении блокаторов опиатных рецепторов), а также в новых показаниях к применению налоксона, которые подробно будут изложены ниже.
Налоксон в терапии острых отравлений
Как уже было сказано, налоксон — это «чистый» опийный антагонист, т. е. соединение, практически лишённое свойств классических опиоидных наркотиков (обезболивания, эйфоригенности, способности к угнетению дыхания и т. п.). Его способность блокировать опиатные рецепторы широко используется в клинической практике и, прежде всего, при лечении острых отравлений (передозировок) наркотиками опийного ряда (морфином, героином, метадоном и т. п.).
Обычно внутривенного введения налоксона бывает достаточно для того, чтобы привести больного в сознание за считанные секунды. Однако при купировании отравлений опиоидами налоксоном необходимо следует учитывать три обстоятельства.
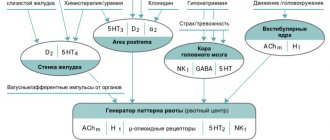
Во-первых, быстрое выведение больных с зависимостью от опиоидов из интоксикации может привести к развитию тяжёлого синдрома отмены. Чтобы избежать этого, налоксон следует вводить дробно, начиная с дозы 0,2–0,4 мг, а затем повторять его внутривенные вливания в этой дозе с интервалом полчаса–час или чаще (в случае необходимости) вплоть до устойчивого прояснения сознания. Если синдром отмены всё же развился, то для снижения его остроты вводят клофелин (клонидин).
Во-вторых, период полувыведения налоксона существенно меньше, чем у большинства опиоидов. Поэтому отравившийся опиоидами пациент нуждается в продолжительном наблюдении и, возможно, во введении дополнительной дозы блокатора опиатных рецепторов уже после того, как сознание восстановилось, чтобы избежать повторного утяжеления состояния за счёт сохранившейся в организме остаточной дозы опиоида, вызвавшего интоксикацию. Последнее замечание особенно актуально при отравлении такими длительно действующими препаратами как метадон, пентазоцин или левометадил.
В-третьих, угнетение дыхания при отравлении бупренорфином лечению налоксоном не поддаётся!
Кроме того, следует иметь в виду, что при отравлении опиоидами нередки случаи, когда ограничиться введением налоксона нельзя. В дополнение к назначению антидота в таких случаях требуется восстановление и поддержание (порой длительное) жизненно важных функций. При резком нарушении дыхания и кровообращения начинают сердечно-лёгочную реанимацию. Часто бывает показана интубация трахеи, если же её не проводят, то принимают меры против аспирации желудочного содержимого. Во время проведения других диагностических и лечебных мероприятий поддержание жизненно важных функций не прекращают.
В любом случае следует установить венозный катетер, чтобы обеспечить надёжный путь оперативного введения необходимых медикаментов, поскольку все достаточно крупные для инъекций подкожные вены у больных с зависимостью от опиоидов, особенно с большим наркотическим стажем, практически полностью облитерированы. Через катетер забирают кровь для всех необходимых исследований.
Если известно, что препарат принят внутрь и произошло это недавно, то промывают желудок. Однако, при угнетении дыхания у неинтубированных больных промывание желудка противопоказано.
Возможный при отравлении опиоидами отёк лёгких различной тяжести (от бессимптомного до опасного для жизни) является интерстициальным и альвеолярным, поэтому сердечные гликозиды и диуретики в этом случае неэффективны и не показаны. Необходимы: ингаляции кислорода и искусственная вентиляция лёгких.
Учитывая длительность действия некоторых опиоидов при их передозировке, а также возможность сочетанного употребления различных психоактивных веществ, больных необходимо наблюдать, по крайней мере, в течение 24 часов. Необходимо помнить также о том, что передозировка опиоидов могла быть суицидальной попыткой [8, 9].
Как следует из сказанного выше, лечение отравлений опиоидными наркотиками с применением их специфического антидота налоксона — это сложная медицинская процедура, требующая участия квалифицированного персонала. Тем не менее, в последние годы в мировой специальной литературе всё чаще обсуждается возможность выдачи налоксона лицам, страдающим зависимостью от опиоидов, для само- и взаимопомощи при передозировке наркотиков во внебольничных условиях [11–24]. Получены свидетельства того, что такая практика может существенно сократить смертность среди данной категории пациентов.
С той же целью проводятся исследования возможностей интраназального введения раствора налоксона при лечении передозировок опийными наркотиками. Установлено, что через слизистую оболочку полости носа налоксон проникает в системный кровоток почти так же быстро, как и при внутривенном введении [25–30].
Налоксон также рекомендуется применять во всех случаях отравления неизвестными ядами при наличии угнетения дыхания и помрачённого сознания, поскольку таким неизвестным ядом может оказаться опиоид либо комбинация веществ, содержащая опиоиды [9].
Кроме того, в последнее время появились сообщения о том, что налоксон может быть успешно применён для лечения отравлений препаратами вальпроевой кислоты (антиконвульсантами) [31, 32], а также ибупрофеном [33].
Налоксон в диагностике и лечении состояний зависимости от опиоидов
Лечение острых отравлений — не единственная сфера применения налоксона. Так, например, налоксон применяют для установления наличия и тяжести зависимости от опиоидов [34]. Из-за болезненных для больного проявлений синдрома отмены применяют налоксон, в основном, в случае бессознательного состояния пациента. При этом диагностические цели (определение вида психоактивного вещества, вызвавшего кому) и лечебные цели (неотложная помощь) назначения этого препарата могут быть достигнуты одновременно. Кроме того, налоксоновый тест проводят перед началом длительного противорецидивного лечения налтрексоном.
Налоксон в дозе 0,2–0,4 мг вводится внутривенно в течение 5 минут, подкожно или внутримышечно, после чего тщательно наблюдают за пациентом, пытаясь обнаружить ранние признаки синдрома отмены: расширение зрачков, тахипноэ, слезотечение, ринорея и потливость. Если в течение 15–30 минут нет реакции на введение налоксона, препарат вводят повторно внутривенно в дозе 0,4 мг или подкожно в дозе 0,4–0,8 мг и снова наблюдают за пациентом. Если и при повторном введении реакции на налоксон нет, то это свидетельствует об отсутствии физической зависимости от опиоидов на момент проведения настоящего исследования. Следует помнить о том, что налоксоновая проба может быть отрицательной, в том числе, и у больных опиоманией, находящихся в состоянии ремиссии.
Известны схемы применения данного препарата, предназначенные для купирования синдрома отмены, в частности: форсированная детоксикация по А. П. Чуприкову — А. А. Педаку [35–37], а также ультрабыстрая опиоидная детоксикация (УБОД) под общей анестезией по А. В. Бутрову — А. Г. Гофману — С. Г. Цимбалову [38].
Реализация схемы А. П. Чуприкова — А. А. Педака начинается с подбора минимальной дозы налоксона, приводящей к развитию состояния отмены. Затем лечебные мероприятия проводят в соответствии со «Способом купирования синдрома отмены вследствие употребления опиатов»[37].
С целью поддержания преципитированной абстинентной реакции каждые 30–40 минут вводят ранее подобранную индивидуальную дозу налоксона. Одновременно оценивают развитие признаков и симптомов отмены. В случаях выраженной абстинентной реакции вводят 10 мг диазепама. Проведение опийной детоксикации прекращают при отсутствии признаков синдрома отмены после двукратного введения индивидуально подобранной дозы налоксона. Контрольный системный налоксоновый тест (доза 0,4 мг внутривенно) повторяется на следующий день после проведения детоксикации.
В ходе форсированной детоксикации интенсивность проявлений синдрома отмены в ответ на очередное введение налоксона закономерно убывает на протяжении 7–9 часов вплоть до полного их отсутствия. Курсовая доза налоксона при описанной схеме форсированной детоксикации в среднем составляет 4,4±0,8 мг. Результаты контрольного налоксонового теста на следующий день обычно отрицательные.
Ультрабыстрая опиоидная детоксикация под наркозом по А. В. Бутрову — А. Г. Гофману — С. Г. Цимбалову [38] применяется в основном при большой длительности приёма наркотика и больших суточных дозировках опиатов. Основным критерием отбора больных для УБОД является наличие установки на лечение, готовность полностью отказаться от потребления наркотика, участвовать в реабилитационных программах, начать здоровый образ жизни.
Противопоказаниями к проведению УБОД являются: сочетание зависимости от опиоидов с зависимостью от других наркотиков или психоактивных средств; беременность или кормление грудью; сочетание опиоидной зависимости с тяжёлыми соматическими заболеваниями в стадии декомпенсации; четвёртая степень анестезиологического риска (по стандартной пятибалльной шкале анестезиологического риска) у больных с опиоидной зависимостью.
Для реализации данной методики необходимы следующие условия:
- наличие помещения, соответствующего стандартам противошоковой палаты отделения реанимации;
- наличие результатов развёрнутого клинического анализа крови (с показателями свертывания крови); биохимического анализа крови (общий белок, билирубин, креатинин, мочевина, АлАТ, АсАТ); электролитов крови (K, Na, Cl); общего анализа мочи; анализ крови на ВИЧ-инфекцию, гепатиты B и C; ЭКГ; рентгенограммы грудной клетки; результатов определения группы крови и резус-фактора, а также коагулограммы (по показаниям);
- наличие мониторинга жизненно важных функций: частоты сердечных сокращений; артериального давления (неинвазивно); ЭКГ; частоты дыхательных движений; дыхательного объёма; минутной вентиляции лёгких; пикового давления в дыхательных путях; вдыхаемой концентрации кислорода; градиента температуры; почасового диуреза; продуктов деградации героина в моче.
Для реализации методики необходимы следующие препараты: налоксон; налтрексон; клонидин (клофелин). Группа анестезиологически-реанимационных препаратов является стандартной и не относится к особенностям материально-технической базы предлагаемой методики.
Начало проведения процедуры УБОД определяется наркологом индивидуально по клинической картине. От больного берётся расписка о его согласии на проведение лечения. В среднем время между приёмом последней дозы наркотического препарата и началом УБОД составляет 6–12 часов.
Собственно детоксикации предшествует введение пациента в состояние общей анестезии: пациенту проводят вводный наркоз, интубируют, устанавливают назогастральный зонд и продолжают процедуру УБОД под наркозом с управляемой вентиляцией лёгких.
Это даёт гарантию адекватной защиты дыхательных путей и возможность проведения глубокого наркоза. Тщательный мониторинг жизненно важных функций позволяет корригировать и удерживать последние в интервале нормы. Поскольку больной находится под наркозом, он не ощущает никаких проявлений абстинентного синдрома. Наркоз обычно длится от 6 до 8 часов.
Сама детоксикация проводится в соответствии со схемой. Налоксон вводится внутривенно в дозах 0,4 мг, 0,8 мг, 1,6 мг, 3,2 мг, 6,4 мг каждые 15 минут в течение первого часа после интубации (общая доза налоксона 12,4 мг), затем капельно 0,4–0,8 мг/час в течение 24 часов в первые сутки (таким образом, инфузия налоксона начинается во время наркоза и продолжается в ближайшем постдетоксикационном периоде).
Время ультрабыстрой опиоидной детоксикации при общей анестезии составляет 6–8 часов. Критерием окончания УБОД является регрессия симптомов абстинентного синдрома: нормализация АД и пульса, уменьшение отделяемого по назогастральному зонду, снижение температуры, уменьшение слезоотделения, уменьшение диареи. После пробуждения и экстубации могут наблюдаться остаточные явления абстинентного синдрома, которые быстро регрессируют или купируются дополнительной медикаментозной терапией.
Существуют свидетельства того, что применение налоксона у больных, зависимых от опиоидов, может быть полезным и в постабстинентном периоде. Так, было показано, что малые дозы налоксона (0,2–0,4 мг) в составе комплексной терапии лиц, зависимых от героина, существенно продлевают период полувыведения лей-энкефалина в сыворотке крови, значительно снижают интенсивность влечения к наркотику и интенсивность аффективных расстройств в постабстинентном периоде, что, по мнению авторов, способствует повышению качества и продолжительности терапевтических ремиссий [39, 40].
Потенциально перспективные показания к применению налоксона
Налоксон, будучи блокатором опиатных рецепторов, не обладает собственной анальгетической активностью. Однако, как свидетельствуют результаты некоторых клинических исследований, в низких и сверхнизких дозах налоксон способен потенцировать анальгетический эффект таких опиоидов, как бупренорфин и нальбуфин. Некоторые исследователи уже используют налоксон в качестве адъюванта в комплексной терапии болевых синдромов различного происхождения [41–44].
Другой важной особенностью налоксона является его способность подавлять нежелательные явления и последствия общей и эпидуральной анестезии, а также неблагоприятные последствия купирования болевых синдромов в онкологической практике. Препарат эффективно устраняет постоперационную недостаточность подвижности кишечника [45, 46], снижает частоту вызванного опиоидами эзофагального рефлюкса и связанных с ним пневмоний у пациентов, находящихся в условиях реанимации и/или интенсивной терапии [47], подавляет тошноту и рвоту у пациентов с эпидуральной морфиновой анестезией [48, 49] и облегчает явления вызванной опиоидами непереносимости кормления через интрагастральный зонд [50].
Кроме того, было показано [51], что раннее назначение умеренных доз налоксона в остром периоде черепно-мозговой травмы может существенно снизить смертность пострадавших и улучшить их посттравматический неврологический статус. Установлено также, что назначение налоксона при шоке улучшает показатели гемодинамики и, в частности, артериальное давление [52].
Неожиданные и обнадёживающие результаты были получены при изучении действия налоксона у больных с деперсонализацией — у более чем половины пациентов, получавших этот препарат, наблюдалось полное обратное развитие этого расстройства [53]. Данное наблюдение проливает свет на роль системы эндогенных опиоидов в генезе деперсонализационных расстройств. Не менее неожиданной представляется способность налоксона снижать избыточную секрецию инсулина у женщин в постменопаузальном периоде, что делает налоксон потенциально полезным средством при соответствующей заместительной гормонотерапии [54].
Налоксон привлекает также внимание исследователей, занимающихся разработкой методов лечения синдрома Туретта [55].
Успешное применение налоксона при травматическом шоке, деперсонализационных расстройствах и дисгормональных состояниях позволяет уверенно прогнозировать скорое и существенное расширение сферы применения данного препарата.
Сегодня налоксон используется, главным образом, в наркологии, токсикологии и анестезиологии.
Интересно обсуждение возможности выдачи налоксона лицам, страдающим зависимостью от опиоидов, для само- и взаимопомощи при передозировке наркотиков во внебольничных условиях, а также введение налоксона в перечень медикаментов, входящих в оснащение выездных бригад скорой помощи.
Литература
- Blumberg H., Dayton H. B., Wolf P. S. Counteraction of narcotic antagonist analgesics by the narcotic antagonist Naloxone // Proceedings of the Society for Experimental Biology and Medicine. — 1966. — Vol. 123, № 3. — P. 755–758.
- Foldes F. F., Davidson G. M., Duncalf D., Kuwabara S., Siker E. S. The respiratory, circulatory, and analgesic effects of naloxone-narcotic mixtures in anaesthetized subjects // Canadian Anaesthetists’ Society Journal. — 1965. — Vol. 12, № 6. — P. 608–621.
- Jasinski D. R., Martin W. R., Haertzen C. A. The human pharmacology and abuse potential of N-allylnoroxymorphone (naloxone) // Journal of Pharmacology and Experimental Therapeutics. — 1967. — Vol. 157, № 2. — P. 420–426.
- Osterlitz H. W., Watt A. J. Kinetic parameters of narcotic agonists and antagonists, with particular reference to N-allylnoroxymorphone (naloxone) // British Journal of Pharmacology and Chemotherapy. — 1968. — Vol. 33, № 2. — P. 266–276.
- Smits S. E., Takemori A. E. Quantitative studies on the antagonism by naloxone of some narcotic and narcotic-antagonist analgesics // British Journal of Pharmacology. — 1970. — Vol. 39, № 3. — P. 627–638.
- Takemori A. E., Kupferberg H. J., Miller J. W. Quantitative studies of the antagonism of morphine by nalorphine and naloxone // Journal of Pharmacology and Experimental Therapeutics. — 1969. — Vol. 169, № 1. — P. 39–45.
- https://www.ncbi.nlm.nih.gov .
- Психиатрия / Под ред. Р. Шейдера; Пер. с англ. — М.: Практика, 1998. — 485 с.
- Фридман Л. С., Флеминг Н. Ф., Робертс Д. Г. и др. Наркология. — М.: Бином; СПб: Невский диалект, 1998. — 320 с.
- Clarke S. F., Dargan P. I., Jones A. L. Naloxone in opioid poisoning: walking the tightrope // Emergency Medicine Journal. — 2005. — Vol. 22, № 9. — P. 612–616.
- Lenton S. R., Hargreaves K. M. Should we conduct a trial of distributing naloxone to heroin users for peer administration to prevent fatal overdose? // Medical Journal of Austria. — 2000. — Vol. 173, № 5. — P. 260–263.
- Coffin P. O., Fuller C., Vadnai L., Blaney S., Galea S., Vlahov D. Preliminary evidence of health care provider support for naloxone prescription as overdose fatality prevention strategy in New York City // Journal of Urban Health. — 2003. — Vol. 80, № 2. — P. 288–290.
- Seal K. H., Downing M., Kral A. H., Singleton-Banks S., Hammond J. P., Lorvick J., Ciccarone D., Edlin B. R. Attitudes about prescribing take-home naloxone to injection drug users for the management of heroin overdose: a survey of street-recruited injectors in the San Francisco Bay Area // Journal of Urban Health. — 2003. — Vol. 80, № 2. — P. 291–301.
- Galea S., Worthington N., Piper T. M., Nandi V. V., Curtis M., Rosenthal D. M. Provision of naloxone to injection drug users as an overdose prevention strategy: early evidence from a pilot study in New York City // Addictive Behaviors. — 2006. — Vol. 31, № 5. — P. 907–912.
- Baca C. T., Grant K. J. Take-home naloxone to reduce heroin death // Addiction. — 2005. — Vol. 100, № 12. — P. 1823–1831.
- Lagu T., Anderson B. J., Stein M. Overdoses among friends: drug users are willing to administer naloxone to others // Journal of Substance Abuse Treatment. — 2006. — Vol. 30, № 2. — P. 129–133.
- Worthington N., Markham Piper T., Galea S., Rosenthal D. Opiate users’ knowledge about overdose prevention and naloxone in New York City: a focus group study // Harm Reduction Journal. — 2006. — Vol. 3. — P. 19.
- Maxwell S., Bigg D., Stanczykiewicz K., Carlberg-Racich S. Prescribing naloxone to actively injecting heroin users: a program to reduce heroin overdose deaths // Journal of Addictive Diseases. — 2006. — Vol. 25, № 3. — P. 89–96.
- Wright N., Oldham N., Francis K., Jones L. Homeless drug users’ awareness and risk perception of peer «take home naloxone» use — a qualitative study // Substance Abuse Treatment, Prevention, and Policy. — 2006. — Vol. 1. — P. 28.
- Heller D. I., Stancliff S. Providing naloxone to substance users for secondary administration to reduce overdose mortality in New York City // Public Health Reports. — 2007. — Vol. 122, № 3. — P. 393–397.
- Piper T. M., Rudenstine S., Stancliff S., Sherman S., Nandi V., Clear A., Galea S. Overdose prevention for injection drug users: lessons learned from naloxone training and distribution programs in New York City // Harm Reduction Journal. — 2007. — Vol. 4. — P. 3.
- Beletsky L., Ruthazer R., Macalino G. E., Rich J. D., Tan L., Burris S. Physicians’ knowledge of and willingness to prescribe naloxone to reverse accidental opiate overdose: challenges and opportunities // Journal of Urban Health. — 2007. — Vol. 84, № 1. — P. 126–136.
- Sporer K. A., Kral A. H. Prescription naloxone: a novel approach to heroin overdose prevention // Annals of Emergency Medicine. — 2007. — Vol. 49, № 2. — P. 172–177.
- Byrne A. Emergency naloxone for heroin overdose: over the counter availability needs careful consideration // British Medical Journal. — 2006. — Vol. 333, № 7571. — P. 754.
- Barton E. D., Ramos J., Colwell C., Benson J., Baily J., Dunn W. Intranasal administration of naloxone by paramedics // Prehospital Emergency Care. — 2002. — Vol. 6, № 1. — P. 54–58.
- Kelly A. M., Koutsogiannis Z. Intranasal naloxone for life threatening opioid toxicity // Emergency Medicine Journal. — 2002. — Vol. 19, № 4. — P. 375.
- Kelly A. M., Kerr D., Dietze P., Patrick I., Walker T., Koutsogiannis Z. Randomised trial of intranasal versus intramuscular naloxone in prehospital treatment for suspected opioid overdose // Medical Journal of Austria. — 2005. — Vol. 182, № 1. — P. 24–27.
- Seal K. H., Thawley R., Gee L., Bamberger J., Kral A. H., Ciccarone D., Downing M., Edlin B. R. Naloxone distribution and cardiopulmonary resuscitation training for injection drug users to prevent heroin overdose death: a pilot intervention study // Journal of Urban Health. — 2005. — Vol. 82, № 2. — P. 303–311.
- Barton E. D., Colwell C. B., Wolfe T., Fosnocht D., Gravitz C., Bryan T., Dunn W., Benson J., Bailey J. Efficacy of intranasal naloxone as a needleless alternative for treatment of opioid overdose in the prehospital setting // Journal of Emergency Medicine. — 2005. — Vol. 29, № 3. — P. 265–271.
- Ashton H., Hassan Z. Best evidence topic report. Intranasal naloxone in suspected opioid overdose // Emergency Medicine Journal. — 2006. — Vol. 23, № 3. — P. 221–223.
- Roberge R. J., Francis E. H. Use of naloxone in valproic acid overdose: case report and review // Journal of Emergency Medicine. — 2002. — Vol. 22, № 1. — P. 67–70.
- Thanacoody H. K. Chronic valproic acid intoxication: reversal by naloxone // Emergency Medicine Journal. — 2007. — Vol. 24, № 9. — P. 677–678.
- Easley R. B., Altemeier W. A. Central nervous system manifestations of an ibuprofen overdose reversed by naloxone // Pediatric Emergency Care. — 2000. — Vol. 16, № 1. — P. 39–41.
- Минко А. И., Линский И. В. Наркология. — 2-е изд., испр. и доп. — М.: Эксмо, 2004. — 736 с.
- Педак А. А. Форсированная детоксикация налоксоном в комплексном лечении психических и поведенческих расстройств вследствие употребления опиатов // Актуальні питання неврології, психіатрії та наркології у світлі концепції розвитку охорони здоров’я населення України: Матеріали пленуму науково-практичного товариства неврологів, психіатрів та наркологів України, присвяченого Року Здоров’я. — Тернопіль: Укрмедкнига, 2001. — С. 559–564.
- Патент на винахід № 99031322. Спосіб опіатної детоксикації / А. П. Чуприков, А. А. Педак (Україна); Заявл. 11.03.1999; Опубл. 15.04.2003, Бюл. № 4.
- Патент 20894 А Україна, MKІ A61N 1/18, A61/N 1/32. Cпociб купірування синдрому відміни внаслідок вживання психоактивних речовин / А. П. Чуприков, А. А. Педак (Україна). — № 96124725; Заявл. 18.12.96; Опубл. 07.10.97 — 3 с.
- Бутров А. В., Гофман А. Г., Цимбалов С. Г. Купирование опийного абстинентного синдрома антагонистами опиатов под общей анестезией: Пособие для врачей. — М., 2000. — 20 с.
- Литвинова С. В., Надеждин А. В., Шульговский В. В. и др. Использование низких доз налоксона в комплексной терапии постабстинентного героинового синдрома: энкефалиназные механизмы // Бюллетень экспериментальной биологии и медицины. — 2001. — Т. 132, № 5. — С. 1070–1072.
- Надеждин А. В., Литвинова С. В., Тетенова Е. Ю. и др. Возможности использования низких доз налоксона в лечении героиновой зависимости // Журнал неврологии и психиатрии им. С. С. Корсакова. — 2006. — Т. 106, № 1. — С. 56–57.
- Schmidt B. L., Gear R. W., Levine J. D. Response of neuropathic trigeminal pain to the combination of low-dose nalbuphine plus naloxone in humans // Neuroscience Letters. — 2003. — Vol. 343, № 2. — P. 144–146.
- Cepeda M. S., Alvarez H., Morales O., Carr D. B. Addition of ultralow dose naloxone to postoperative morphine PCA: unchanged analgesia and opioid requirement but decreased incidence of opioid side effects // Pain. — 2004. — Vol. 107, № 1–2. — P. 41–46.
- La Vincente S. F., White J. M., Somogyi A. A., Bochner F., Chapleo C. B. Enhanced buprenorphine analgesia with the addition of ultra-low-dose naloxone in healthy subjects // Clinical Pharmacology and Therapeutics. — 2008. — Vol. 83, № 1. — P. 144–152.
- Gordon A. T., Levine J. D., Dubois M. Y., D’Angelo R., Conlon A. M., Levacic D., Lebovits A. Open-label exploration of an intravenous nalbuphine and naloxone mixture as an analgesic agent following gynecologic surgery // Pain Medicine. — 2007. — Vol. 8, № 6. — P. 525–530.
- Lee J., Shim J. Y., Choi J. H., Kim E. S., Kwon O. K., Moon D. E., Choi J. H., Bishop M. J. Epidural naloxone reduces intestinal hypomotility but not analgesia of epidural morphine // Canadian Journal of Anaesthesia. — 2001. — Vol. 48, № 1. — P. 54–58.
- Mercadante S., Villari P., Ferrera P. Naloxone in treating central adverse effects during opioid titration for cancer pain // Journal of Pain and Symptom Management. — 2003. — Vol. 26, № 2. — P. 691–693.
- Meissner W., Dohrn B., Reinhart K. Enteral naloxone reduces gastric tube reflux and frequency of pneumonia in critical care patients during opioid analgesia // Critical Care Medicine. — 2003. — Vol. 3, № 3. — P. 776–780.
- Kim E. S., Lee J., Choi J. H. Optimal dose range of epidural naloxone to reduce nausea in patients receiving epidural morphine // Canadian Journal of Anaesthesia. — 2004. — Vol. 51, № 10. — P. 1048–1049.
- Kim M. K., Nam S. B., Cho M. J., Shin Y. S. Epidural naloxone reduces postoperative nausea and vomiting in patients receiving epidural sufentanil for postoperative analgesia // British Journal of Anaesthesia. — 2007. — Vol. 99, № 2. — P. 270–275.
- Mixides G., Liebl M. G., Bloom K. Enteral administration of naloxone for treatment of opioid-associated intragastric feeding intolerance // Pharmacotherapy. — 2004. — Vol. 24, № 2. — P. 291–294.
- Randomized double-blind clinical trial of moderate dosage naloxone in acute moderate and severe traumatic brain injury // Hunan Yi Ke Da Xue Xue Bao. — 2002. — Vol. 27, № 1. — P. 58–60.
- Boeuf B., Poirier V., Gauvin F., Guerguerian A. M., Roy C., Farrell C. A., Lacroix J. Naloxone for shock // Cochrane Database of Systematic Reviews. — 2003. — Vol. 4. — CD004443.
- NULLer Y. L., Morozova M. G., Kushnir O. N., Hamper N. Effect of naloxone therapy on depersonalization: a pilot study // Journal of Psychopharmacology. — 2001. — Vol. 15, № 2. — P. 93–95.
- Cucinelli F., Soranna L., Perri C., Romualdi D., Barini A., Mancuso S., Lanzone A. Naloxone decreases insulin secretion in hyperinsulinemic postmenopausal women and may positively affect hormone replacement therapy // Fertility and Sterility. — 2002. — Vol. 78, № 5. — P. 1017–1024.
- Van Wattum P. J., Chappell P. B., Zelterman D., Scahill L. D., Leckman J. F. Patterns of response to acute naloxone infusion in Tourette’s syndrome // Movement Disorders. — 2000. — Vol. 15, № 6. — P. 1252–1254.
Побочные эффекты препарата Налоксон-м
При быстром введении Налоксона-М могут возникать различные реакции. Со стороны ЖКТ: тошнота, рвота. Со стороны сердечно-сосудистой системы: тахикардия, АГ (артериальная гипертензия), остановка сердца. Со стороны ЦНС: дрожь, судороги. Аллергические реакции: кожная сыпь, зуд. Прочие: усиленное потоотделение. При применении Налоксона-М в послеоперационный период в дозах, превышающих необходимые, возможно исчезновение анальгезии и возбуждение, артериальная гипотензия или АГ (артериальная гипертензия), желудочковая тахикардия, фибрилляция желудочков, отек легких. При применении в терапевтических дозах у больных, в организме которых не содержатся опиоиды, Налоксон-М обычно не вызывает побочных эффектов.
Особые указания по применению препарата Налоксон-м
Длительность действия некоторых опиоидных анальгетиков может превышать длительность действия Налоксона-М, поэтому пациенты должны находиться под постоянным медицинским наблюдением и в условиях, которые дают возможность проводить ИВЛ и другие реанимационные мероприятия. Больным с опиоидной зависимостью следует вводить препарат очень осторожно, так как возможно появление синдрома отмены. С осторожностью применяют в период беременности и кормления грудью. Неизвестно, выделяется ли налоксон с грудным молоком. Применение препарата в период беременности и кормления грудью возможно при оценке соотношения риск/польза. Во время применения Налоксона-М запрещается управлять транспортными средствами и обслуживать движущиеся механизмы.