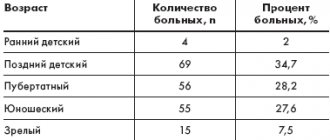
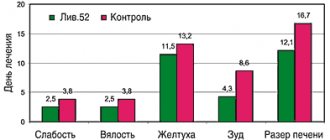
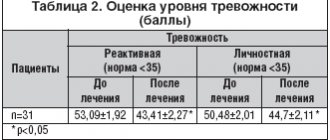
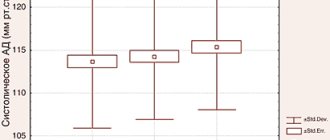
Малые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. Закись азота не вызывает раздражения дыхательных путей. Растворенная в плазме крови закись азота, практически не изменяется, не метаболизируется и не связывается с гемоглобином. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде.
Вдыхание закиси азота с кислородом происходит при помощи удобной маски, чувствуется приятный аромат и чувство расслабленности. Эта процедура совершенно безопасна, поскольку закись не вызывает побочных эффектов и привыкания, аллергических реакций, быстро и легко выводится из организма, не имеет последействия. Эта технология применяется как в детской, так и во взрослой стоматологии. Закись азота применяется в странах с прогрессивной стоматологией уже более 30 лет. В США, Израиле, Великобритании почти 100% детских стоматологических клиник повседневно применяют эту методику. Поэтому её нельзя назвать новой, скорее проверенной.
Фармакологические свойства
Фармакодинамика
Динитрогена оксид – средство для ингаляционной анестезии. Механизм действия обусловлен способностью неспецифически взаимодействовать с мембранами нейронов, угнетать передачу нервных импульсов в центральной нервной системе, изменять корково-подкорковые взаимоотношения.
Характеризуется высокой анальгезирующей активностью. В малых концентрациях вызывает легкую сонливость и чувство опьянения.
Стадия анальгезии достигается через 2–3 минуты после ингаляции газовой смеси, содержащей до 80% Азота закиси и 20% кислорода. Через 6–8 минут после кратковременной, но достаточно выраженной стадии возбуждения наступает I стадия хирургической анестезии.
Для поддержания анестезии достаточно концентрации динитрогена оксида 40–50% с соответствующим увеличением концентрации кислорода. При этом не достигается достаточная релаксация скелетной мускулатуры. В связи с этим для достижения необходимого эффекта Азота закись применяют в комбинации с другими средствами, предназначенными для ингаляционной анестезии, и миорелаксантами.
Пробуждение наступает спустя 3–5 минут после прекращения подачи ингаляционной газовой смеси.
Азота закись угнетает дыхание, вызывает сужение периферических сосудов, увеличивает частоту сердечных сокращений, может повышать внутричерепное давление.
Фармакокинетика
Через легкие Азота закись попадает в системный кровоток. В плазме находится в растворенном состоянии, не метаболизируется. Выводится преимущественно через легкие в неизмененном виде (через 10–15 минут), в незначительных количествах – через кожу.
Период полувыведения составляет 5–6 минут.
Хорошо проникает через гематоэнцефалический и плацентарный барьеры.
Лекарство от похмелья
В подвале Пневматического института за машиной Ватта-Беддоуса наблюдал молодой химик Гемфри Дэви — и заодно пробовал на себе разные газовые смеси, которые производила машина (о другом ценном наблюдении, сделанном Дэви, мы рассказывали в материале «Хризопея воды»). В 1800 году в своей книге «Исследования, химические и философские» Дэви описал неординарный эффект одного из газов — закиси азота, которую ему удалось выделить в чистом виде: она помогла ему справиться с похмельем. «После третьего вдоха я не почувствовал головной боли, возникло приятное возбуждение, сила воли была ослаблена, яркие идеи быстро промелькнули в моем уме; я прошелся по комнате и несколько минут пребывал в сильном возбуждении».
Идея облегчить похмелье закисью азота возникла у химика неспроста — до этого он уже дышал этим газом. При этом, писал он, «повышенная мышечная активность сопровождалась очень приятными ощущениями. <…> Я засмеялся, пошатнулся и попытался заговорить, но не смог произнести ни слова».
Дэви назвал закись азота «веселящим газом» — и это имя, а заодно и само вещество, быстро ушли в народ. Беддоус все еще разбирался, помогает ли закись азота от туберкулеза — а британские вельможи уже начали проводить светские приемы, где вместо вина и деликатесов подавали мешки с веселящим газом. По описаниям современников, на этих вечеринках некоторые «бегали вверх и вниз по лестнице и по всему дому, говоря странные вещи», другие «теряли ощущение собственного веса», а третьи и вовсе «чувствовали себя звуком арфы». Были и те, кто описывал ощущения как «возвращение с прогулки по снегу в теплую комнату».
В общем, развлечение, на которое подсели британские аристократы в 1799 году, современные люди, в зависимости от контекста, назвали бы или рекреационным употреблением наркотиков — или злоупотреблением психоактивными веществами.
«Жить стало легче: лекарство для склочных жен» — сатирическая гравюра 1830 года, изображающая Гемфри Дэви, вводящего дозу веселящего газа женщине
CC0
Поделиться
Как именно закись азота «веселит», никто в то время объяснить не мог. Более того, и сейчас это ясно не до конца. Эксперименты на крысах показали, что она блокирует NMDA-рецепторы, из-за чего в участках мозга, ответственных за удовольствие, высвобождается дофамин. С точки зрения нейрофизиологии эти процессы действительно должны отвечать за чувство радости и положительные эмоции. Но на людях никто до сих пор этого экспериментально не подтвердил. Не знали Дэви и его последователи и о том, что вызванное газом веселье не проходит для них без следа. Любое вещество, вызывающее чувство удовольствия, может вызвать зависимость — закись азота здесь не исключение. Высвобождение дофамина, которое приносит смех и хорошее настроение, связано с формированием психической зависимости, если он высвобождается в определенных участках мозга. То, что пристрастившимся к веселящему газу полномасштабная химическая зависимость не грозит, за три века доказательно не ответил никто. Хотя и клинических примеров химической аддикции к N2O тоже никто не предоставил. Есть отдельные соображения о том, что газ недостаточно сильно действует на дофаминергические пути и нейроны от его воздействия не теряют чувствительности: это, по идее, должно отменять синдром отмены. Но все это не мешает закиси азота, такой дешевой, доступной и простой в употреблении, губить пристрастившихся потребителей.
Показания к применению
Согласно инструкции по применению, Азота закись используют в следующих случаях:
- Ингаляционная комбинированная анестезия в сочетании с наркотическими анальгетиками и миорелаксантами, проводимая на специальном оборудовании;
- Общая анестезия в оперативной гинекологии, общей хирургии, стоматологии и для обезболивания родов, не требующая миорелаксации и глубокой анестезии;
- Профилактика травматического шока, а также для усиления анальгетического и наркозного действия других лекарственных препаратов, включая лечебный анальгетический наркоз после хирургической операции;
- Купирование болевого синдрома при остром панкреатите, инфаркте миокарда, острой коронарной недостаточности;
- Отключение сознания для обезболивания при выполнении медицинских процедур.
Подготовка к проведению наркоза
Когда пациента подготавливают к ингаляции закисью азота, ему дают седативные средства. В последнее время наркоз все чаще сочетают с такими лекарствами, как фторотан и циклопропан. Благодаря этому можно достичь необходимой глубины наркоза, чтобы провести серьезную хирургическую операцию. Однако эти препараты могут быть использованы не для каждого организма. Они имеют целый ряд противопоказаний, которые в обязательном порядке должны учитываться врачом.
Перед ингаляционным наркозом необходимо придерживаться голодной диеты, а также принимать выданные доктором таблетки. В основном пациенту прописывают успокоительные препараты, которые снимают стресс перед операцией и снижают уровень напряжения.
Противопоказания
- Патологии нервной системы;
- Гипоксия;
- Хронический алкоголизм или состояние алкогольного опьянения;
- Период грудного вскармливания;
- Повышенная чувствительность к препарату.
С осторожностью препарат применяют у пациентов с черепно-мозговой травмой, внутричерепной опухолью, повышением внутричерепного давления в анамнезе.
В случае необходимости применения в период беременности препарат назначают в небольших концентрациях (в пропорции 1:1 к кислороду) на малое время (в течение 2-3 вдохов).
Недостатки применения у детей
Среди минусов данной процедуры можно отметить следующие побочные действия:
- У некоторых детей может появиться головная боль или головокружение.
- Запах газа может не понравиться малышу и даже вызвать рвотный рефлекс.
- Закись азота нельзя использовать во время насморка, а также любых других заболеваниях органов дыхания.
- Процедура седации стоит довольно дорого.
- Бывают случаи, что ребенок, наоборот, становится слишком активным и возбужденным во время ингаляции. Такое явление считается исключением, но, тем не менее, возможно.
- Закись азота не исключает необходимость использования дополнительного анестетика.
Азота закись, инструкция по применению: способ и дозировка
Азота закись применяют в виде ингаляции в комбинации с кислородом и другими анестетиками при помощи специального оборудования для газового наркоза в стационарных условиях.
Обычно анестезию начинают со смеси с содержанием 70-80% динитрогена оксида и 20-30% кислорода.
Рекомендованная концентрация динитрогена оксида:
- Лечебный наркоз при купировании и профилактике болевого синдрома: 40-75%;
- Общая анестезия: доза для быстрого погружения на необходимую глубину наркоза – 70-75%, поддерживающая доза – 40-50%. В случае необходимости в смесь можно добавлять мощные наркотические препараты, включая фторотан, барбитураты, эфир. После отключения подачи динитрогена оксида, подачу кислорода рекомендуется продолжать еще 4-5 минут, с целью недопущения диффузионной гипоксии;
- Обезболивание родов: 40-75%, используя метод прерывистой аутоанальгезии, при котором вдыхание смеси роженица начинает при появлении предвестников схватки и прекращает на ее пике или к окончанию схватки;
- Отключение сознания для выполнения медицинских процедур: 25-50%.
Концентрацию Азота закиси детям подбирают индивидуально, при этом содержание кислорода в смеси должно составлять 30% и более. После завершения анестезии необходимо продолжить ингаляционную подачу кислорода в течение 5 минут для профилактики гипоксии.
Ингаляционная анестезия проводится на фоне премедикации. С целью предупреждения тошноты и рвоты, для понижения эмоционального возбуждения и усиления действия показано внутримышечное введение 2-3 мл 0,25% раствора дроперидола (5-7,5 мг), 1-2 мл 0,5% раствора диазепама (5-10 мг).
Глоток благополучия
Пока законодатели перекрывают воздух дилерам веселящего газа, врачи ищут ему достойное применение. Когда стало ясно, что он не состоится ни как антибиотик, ни как анестестик, появилась новая идея — использовать веселящий газ при психических расстройствах. Еще в первой половине XX века врачи проверили его на пациентах с шизофренией и заметили, что он будто бы облегчил ее симптомы — хотя, по-видимому, в дальнейшем усугубил тяжесть течения болезни.
Чем именно закись азота может помочь поврежденному мозгу, тогда было непонятно. Некоторые психиатры, например, считали , что кислородное голодание может быть полезно при психических расстройствах. Для этого больной должен был вдыхать смесь газов, в которой доля воздуха могла достигать всего 45 процентов, а то и вовсе нуля. В таких смесях часто использовались углекислый газ и, конечно, закись азота. И несмотря на то, что эффекты самого газа в отдельности тогда никто не проверял (его использовали исключительно для удушающего действия), в некоторых работах психиатры докладывали, что их пациенты сообщали о «ярких снах», хотя вспомнить они их не могли, и чувстве «благополучия» (но не эйфории), которое длилось несколько часов после процедуры.
Побочные действия
Применение Азота закиси может вызывать побочные эффекты в виде брадикардии, наджелудочковых аритмий, недостаточности кровообращения – в период введения больного в состояние общей анестезии.
Нежелательными эффектами после выхода из наркоза могут стать: сонливость, тошнота, рвота, диффузная гипоксия, спутанность сознания, ощущение тревоги, возбуждение, нервозность, галлюцинации, двигательное возбуждение. Продолжительное применение (2 и более дня) может привести к угнетению дыхания, нарушению функции костного мозга (лейкопения, панцитопении), вызвать послеоперационный озноб и гипертермический криз.
Недостатки данного вида ингаляций
Даже у такого щадящего метода ингаляции есть свои минусы. К ним можно отнести следующее:
- Невозможно ввести пациента в состояние глубокого наркоза. Этот метод не позволяет сделать серьезную операцию.
- Если будет введена большая доза, снизится уровень насыщения крови кислородом. Это может вызвать гипоксию.
- Сократительная активность миокарда незначительно, но понизится.
- Если во время операции пациент почувствует сильную боль – он может резко дернуться, осложнив этим работу врача.
- Большие дозы могут способствовать угнетению мозговой деятельности.
Передозировка
Передозировка Азота закиси может проявляться следующими симптомами: угнетение дыхания, острая гипоксия, снижение артериального давления, аритмия, брадикардия, делирий.
Лечение:
- брадикардия: введение атропина в дозе 0,3–0,6 мг;
- аритмия: коррекция содержания газов в крови;
- недостаточность кровообращения, артериальная гипотензия: уменьшение глубины или прекращение общей анестезии, введение плазмы или плазмозаменяющих средств;
- гипертонический криз: прекращение ингаляции, повышенная подача кислорода, коррекция нарушений метаболического ацидоза и водно-солевого баланса, введение антипиретиков. При необходимости внутривенно капельно вводят дантролен в дозе 1 мг/кг (суммарная доза не должна превышать 10 мг/кг) до тех пор, пока не купируются симптомы криза. Во избежание рецидива криза в течение 1–3 суток после операции применяют дантролен (внутрь или внутривенно в суточной дозе 4–8 мг/кг в 4 приема);
- угнетение дыхания или неадекватная послеоперационная вентиляция легких: снижение дозы анестетика (если он еще применяется), обеспечение проходимости дыхательных путей или искусственная вентиляция легких;
- делирий после выхода из общей анестезии: введение наркотического анальгетика в малых дозах.
Медицинские интернет-конференции
В 2001 г. группой саратовских авторов впервые было предложено использовать электромагнитные колебания миллиметрового диапазона с частотами, соответствующими вращательным молекулярным спектрам важнейших клеточных метаболитов (NO, CO, O2, CO2, OH и др.) [1]. Поскольку молекулярные спектры излучения и поглощения клеточных метаболитов находятся в коротковолновой части субмиллиметрового (терагерцового) диапазона [2], который располагается на шкале электромагнитных волн между КВЧ и оптическим инфракрасным диапазонами [3], новое направление получило название «терагерцовой терапии» (ТГЧ-терапии) [4].
Известно, что именно молекулы-метаболиты являются фундаментальной основой функционирования сложных биологических систем, поэтому чрезвычайно большой интерес представляет возможность управления их реакционной способностью, что может быть использовано для регуляции процессов метаболизма.
Для реализации новых научных задач в ОАО ЦНИИИА (г.Саратов) был создан панорамно-спектрометрический измерительный комплекс с квазиоптическим рефлектометром, работающем в частотном диапазоне 118-600 ГГц [1], так как именно указанный диапазон включает спектры резонансного поглощения и излучения молекул вышеупомянутых клеточных метаболитов [2], в том числе и молекулярный спектр излучения и поглощения оксида азота (150,176…150,644 ГГц).
Молекулярный спектр излучения и поглощения оксида азота (NO) привлек внимание исследователей в первую очередь, поскольку уже более 20 лет проблема оксида азота является одной из ключевых в современной биологии и медицине.
В 1987 г. была открыта реакция образования NO внутри клеток макроорганизма [5], после чего стали интенсивно изучаться способы ускорения и замедления этой реакции, взаимодействие NO с нервной, эндокринной и иммунной системами организма, цитотоксичность NO в отношении макроорганизма и микробов. Открытие внутриклеточного синтеза NO привело к открытию ранее неизвестной регуляторной системы организма человека и млекопитающих животных – системы окиси азота [5]. В биологии возникло новое направление – биология NO [6], дающее новые фундаментальные сведения, которые могут быть использованы в медицине. Ряд авторов считают, что анализ циклических превращений NO будет не менее плодотворным для медиков и биологов ХХI века, чем изучение цикла трикарбоновых кислот в середине ХХ века [7].
В 1998 г. трое американских ученых — Р.Фурчгот (R. Furchgott), Л.Игнарро (Luis J. Ignarro) и Ф.Мурад (Ferid Murad) — были удостоены Нобелевской премии в области физиологии и медицины за открытие роли «оксида азота как сигнальной молекулы в кардиоваскулярной системе» [8]. Молекула оксида азота названа «молекулой XX века» [7]. NO является не только универсальным регулятором физиологических и метаболических процессов в отдельной клетке и в организме в целом, но и осуществляет межклеточные взаимодействия, функционируя как сигнальная молекула практически во всех органах и тканях человека и животных [9-11]. Характерной особенностью NO является его способность быстро диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и также легко (не нуждаясь в рецепторах) проникать в клетки-мишени, что определяет свойства NO как нейротрансмиттера [12, 13]. Именно благодаря изучению оксида азота был установлен новый принцип передачи сигналов в биологических системах: NO образуется в одних клетках, проникает через мембраны и регулирует функции других клеток [7]. Эндогенный NO участвует во многих жизненно важных физиологических процессах. Это универсальный модулятор разнообразных функций организма, таких как межнейронные коммуникации, синаптическая пластичность, состояние рецепторов, внутриклеточная передача сигнала, высвобождение других нейротрансмиттеров [13].
Внутри клетки NO активирует одни энзимы и ингибирует другие. Основными физиологическими мишенями для NO считают растворимую гуанилатциклазу и ADP-риббозилтрансферазу [7, 14]. Активация растворимой гуанилатциклазы вызывает повышение cGMP, что в свою очередь, приводит к снижению внутриклеточного содержания Ca2+ [7]. По мнению многих авторов, способность регулировать внутриклеточную концентрацию ионов Ca 2+ является одним из важнейших свойств NO [15].
Эндогенный оксид азота существует и непрерывно синтезируется в органах, тканях и клетках ферментативным путем при участии NO-синтаз (NOS) – ферментов, использующих в качестве единственного субстрата аминокислоту L-аргинин [6].
Изучены 3 изоформы NOS: эндотелиальная, нейрональная и макрофагальная [1,16]. Эндотелиальная NOS обнаруживается в клетках эндотелия сосудов, тромбоцитах, миокарде и эндокарде. Эндотелиальный механизм образования NO из L-аргинина активируется при нарушениях кровотока и при воздействии ацетилхолина, брадикинина, гистамина и фактора агрегации тромбоцитов [1, 8, 16]. Нейрональную NOS обнаруживают в нейроцитах ЦНС и периферических сплетений вегетативной нервной системы (ВНС). В ЦНС и ВНС имеются нитрергические (нитринергические) синапсы [1, 8]. Их медиатором является NO. По эфферентным нитрергическим нервам NO распространяется в органы дыхательной системы, желудочно-кишечного тракта, мочеполовой системы, в матку [5, 16].
Нейрональная и эндотелиальная NOS имеют много общих свойств, их объединяют вместе и называют конститутивной NOS [5, 16]. Конститутивная NOS является кальций-зависимой, поскольку для ее активации необходим Ca2+. Фермент синтезирует NO в физиологических концентрациях, необходимых для поддержания гомеостаза организма, стационарный уровень NO, поддерживаемый конститутивной NOS в тканях, не превышает нескольких микромолей [16]. Образование NO происходит в дискретном режиме и небольшими порциями, причем только в те промежутки времени, когда в NO-синтезирующей клетке повышается концентрация кальция [5]. Система гипоталамус – гипофиз – кора надпочечников не оказывает никакого тормозящего влияния на конститутивную NOS [5]. Конститутивная NOS в регуляции артериального давления выступает как антагонист адренэргической нервной системы. Врожденная или приобретенная недостаточность конститутивной NOS приводит к артериальной гипертонии, а ее гиперфункция – к гипотонии.
Помимо конститутивной NOS выделяют также «индуцибельную» или «кальций-независимую» NOS. Ее обнаруживают в макрофагах (поэтому она носит ещё название «макрофагальной»), гепатоцитах, фибробластах, гладкомышечных клетках сосудов, желудочно-кишечного тракта и мочеполовой системы, мышечных клетках сердца и матки [5, 16-18]. Индуцибельная NOS появляется в клетках только после индукции их бактериальными токсинами и некоторыми медиаторами воспаления, например, провоспалительными цитокинами [5, 16, 17]. В клетках, находящихся в покое, она не определяется. Индуцибельная NOS синтезирует NO в непрерывном режиме, причем независимо от содержания кальция в NO-синтезирующих клетках и в количествах, в сотни тысяч раз превышающих концентрации NO, вырабатываемые конститутивной NOS [16]. Продуцируемый индуцибельной NOS NO прежде всего предназначен для защиты организма хозяина, способствует снижению активности пограничных воспалительных клеток, гибели микроорганизмов и внутриклеточных паразитов, тормозя агрегацию тромбоцитов и улучшая местное кровообращение [12].
Система гипоталамус – гипофиз – кора надпочечников может предотвратить активацию еще не активированной индуцибельной NOS, но не может остановить секрецию NO, начавшуюся под влиянием уже активированной индуцибельной NOS [5]. Косвенно подсчитано, что скорость синтеза NO в макроорганизме может изменяться в миллионы раз [5].
В условиях гипоксии стабильность NO повышается, что усиливает его биологическое действие [7].
Выработка NO может замедляться или прекращаться под влиянием этанола, глюкокортикостероидов, индометацина [7, 19].
Инактивация NO осуществляется гемоглобином крови с образованием нитрозогемоглобина, который распадается до метгемоглобина [5]. Избыток NO может связываться при взаимодействии его с супероксидными радикалами, тиолами и металлами (особенно с Fe2+) [20].
У оксида азота описаны и нежелательные эффекты. Согласно современным представлениям, они обусловлены образованием сильнейшего окислительного агента – пероксинитрита, возникающего в реакции NO с анионом супероксида. Пероксинитрит выступает в качестве интегрального звена, объединяющего две системы активных низкомолекулярных агентов, возникающих в клетках и тканях – NO и активных форм кислорода [16].
Высокие концентрации NO оказывают цитотоксическое или цитостатическое действие на любую клетку, не дифференцируя, является ли она нормальной клеткой хозяина, опухолевой клеткой или макрофагом [5, 7]. Период полураспада молекулы NO исчисляется секундами, поэтому ее действие распространяется только на близлежащие клетки [5]. Установлено, что хронический избыток NO в организме приводит к аутоиммунным заболеваниям [5].
Коссвенно подсчитано, что скорость синтеза NO в макрооргнизме может изменяться в миллионы раз. Резкая гиперпродукция NO – частый спутник тяжелого течения острых терапевтических, хирургических и инфекционных заболеваний [5]. В то же время сам NO, избыточно накапливаясь в клетке, может вызвать повреждение ДНК и давать провоспалительный эффект при эндотоксемии, септическом шоке, воспалительных заболеваниях легких [12].
Следует особо подчеркнуть, что в настоящее время все шире стали говорить о полифункциональности действия NO, которое порой носит противоположный характер. Так, стало известно, что NO может как усиливать процессы ПОЛ в мембранах клеток, так и ингибировать их, вызывать как расширение сосудов, так и вазоконстрикцию, индуцировать апоптозную гибель клеток и оказывать защитный эффект в отношении апоптоза, индуцированного другими агентами [7, 21]. Для NO характерна как антиканцерогенная активность, так и мутагенное действие [19].
Условия, при которых защитное действие NO переходит в повреждающее, недостаточно ясны. Множественность эффектов NO может объясняться наличием большого количества продуктов метаболизма в цикле оксида азота (NO2-, NO3-, NO+, NO-, NO2.-радикал и т.д.), которые обладают различным биологическим действием [7].
Существует мнение, что различные эффекты NO определяются разнообразными сигнальными путями NO (которые зависят от относительной скорости формирования NO, окислительно-восстановительных реакций, а также комбинаций кислорода, супероксидного радикала и других биологических молекул) и чувствительностью клеточных систем к тому или иному сигнальному пути [21]. Итоговый эффект NO в сосудах может зависеть от места его генерации, локальной концентрации и взаимодействия с другими компонентами ткани [20].
Особый интерес биологические эффекты NO вызывают у кардиологов, поскольку NO является нейромедиатором, мощным фактором гемостаза, антиагрегантом, эндогенным вазодилататором [14, 16, 22-27], обладает стресс-лимитирующим эффектом [28], принимает непосредственное участие в механизмах модуляции иммунного ответа [18], является универсальным регулятором центральной и периферической нервных систем [7, 13]. Описаны нитринергические синапсы в ЦНС и вегетативной нервной системе, нитринергические нервы в сердце, желудочно-кишечном тракте, дыхательных путях и мочеполовой системе [5, 12], что позволяет предположить существование третьего (наряду с холин- и норадренэргическим) типа нервной системы [12].
Оксид азота, продуцируемый в мозге, является одним из важнейших рычагов, с помощью которых нервная система управляет тонусом сосудов, причем описаны несколько механизмов такой регуляции — через прямую стимуляцию высвобождения вазопрессина либо модулируя взаимоотношения в системе «гипоталамус-эпифиз-надпочечники» [7].
Однако основной механизм сосудорасширяющего действия NO непосредственно связан с функционированием гуанилатциклазы, причем только растворимой ее формы, и опосредуется через активацию растворимой гуанилатциклазы с накоплением циклического 3’, 5’-гуанозинмонофосфата (сGMP), что в дальнейшем приводит к выходу Ca2+ из мышечных клеток и в конечном итоге – к вазодилатации [17]. Доказано, что NO участвует в расслаблении гладких мышц сосудов [7, 29, 30-34].
Более того, установлено, что многие физиологические вазодилататоры оказывают свое сосудорасширяющее действие именно через активацию синтеза NO. Лечебный эффект наиболее известных нитровазодилататоров – нитроглицерина, нитросорбида, нитропруссида натрия и др. – также связан с взаимодействием NO, образующегося в результате их биотрансформации, с гемом гуанилатциклазы, активацией фермента и накоплением сGMP.
Известное свойство оксида азота ингибировать агрегацию тромбоцитов также связано с его способностью активировать растворимую гуанилатциклазу [14, 29, 35, 36]. Гуанилатциклаза регулирует агрегацию по механизму обратной связи: инициация агрегации способствует активации фермента, а накапливающийся сGMP опосредует сигнал к дезагрегации и ингибирует агрегацию через общий механизм торможения накопления Са2+.Таким образом, гуанилатциклазу можно рассматривать как защитный механизм на пути развития агрегации. В этой связи направленная активация гуанилатциклазы оксидом азота и NO-генерирующими соединениями может быть использована для ослабления повышенной способности тромбоцитов к агрегации. А поскольку регуляторная роль гуанилатциклазы проявляется на самых ранних стадиях агрегационного процесса, новые активаторы фермента будут способны не только ослаблять гиперагрегацию, но и предупреждать их спонтанную агрегацию, а следовательно, предупреждать возникновение и развитие сосудистых осложнений.
Цитопротекторное действие NO обусловлено его способностью предотвращать не только агрегацию, но и адгезию тромбоцитов [16, 19].
Известно, что оксид азота способствует нормализации функционального состояния клеточной стенки, а также коагуляционного потенциала крови и микроциркуляции [17, 34, 37].
Кроме того, под влиянием оксида азота происходит снижение агрегационной способности эритроцитов как в условиях in vitro, так и in vivo [38], изменение геометрии сосудов вследствие их дилатации [23, 27, 39], то есть эндогенный оксид азота во многом определяет реологические свойства крови, которые, в первую очередь, зависят от качественного и количественного состава эритроцитов.
Большое значение имеет обнаруженное антистрессорное действие NO, которое связывают с активацией им стресс-лимитирующих механизмов [28]. Известно, что при этом в крови уменьшается содержание фибриногена, влияющего как на агрегацию тромбоцитов, так и на реологические свойства крови [40-42].
При длительном стрессорном воздействии происходят снижение продукции эндогенного оксида азота и уменьшение его регуляторных функций [28].
Установлено, что оксид азота принимает участие в регуляции ПОЛ: в физиологических концентрациях NO выступает как антиоксидант, который тормозит развитие радикальных окислительных реакций, связываясь со свободными и входящими в состав гема ионами Fe2+ и ингибируя разложение перекисей [7].
Таким образом, регуляторная система оксида азота оказывает влияние на основные патогенетические механизмы развития сердечно-сосудистой патологии: тромбоцитарный гемостаз, гемокоагуляцию, реологические свойства крови, функциональное состояние эндотелиального и гладкомышечного компонентов сосудистой стенки, стресс-лимитирующие факторы, перекисное окисление липидов.
Заболевания сердечно-сосудистой системы могут развиваться как вследствие снижения, так и в результате неконтролируемого повышения концентрации NO в организме.
Понижение секреции NO приводит к развитию артериальной гипертензии и патологии коронарных сосудов. Так, результаты экспериментов на подопытных животных выявили существование причинной связи между понижением секреции NO и возникновением артериальной гипертензии [43, 44].
Механизм этого действия объясняется, во-первых, тем, что NO является (наряду с простациклином и др.), активатором гуанилатциклазы [17] и вызывает расслабление гладкой мускулатуры сосудов. Во-вторых, NO оказывает на артериальное давление и центральное депрессивное действие, вероятно, за счет влияния на паравентрикулярные ядра гипоталамуса и ядро одиночного пути [17, 45]. Установлено, что повышенная концентрация эндогенных блокаторов NOS является одной из причин почечной гипертензии [46].
Исследования с донаторами и ингибиторами NO показали, что их внутрикоронарное введение оказывает непосредственное влияние на тонус венечных артерий у больных с атеросклерозом либо с гиперхолестеринемией. Так, у больных с атеросклерозом венечных артерий внутрикоронарное вливание ингибитора NO ацетилхолина приводит к парадоксальной реакции – уменьшению диаметра субэндокардиальных артерий, тогда как у здоровых подобная процедура вызывает их увеличение [47]. Опыты с донатором NO L-аргинином показали, что при его внутрикоронарном введении у больных с гиперхолестеринемией значительно увеличивался венечный кровоток, что подтверждает роль NO в регуляции тонуса коронарного русла [48]. При этом отмечено, что дисфункция сосудистого эндотелия проявляется, по-видимому, задолго до развития клинически значимого атеросклероза [48].
Благодаря своим сосудорасширяющим свойствам и способности угнетать генерацию О2- фагоцитирующими клетками NO играет ключевую защитную роль в ишемическом поражении миокарда [7].
Известно также обязательное участие оксида азота, выделяющегося в синоатриальном узле, в автономном контроле сердцебиения [7]. NO может также принимать участие в процессах ремоделирования сосудов [20].
Доказана роль NO в регуляции сосудистого тонуса легких в условиях гипоксии: острая блокада синтеза NO приводила к усилению гипоксической вазоконстрикции [12]. Недостаточное образование и выделение NO является преимущественным механизмом развития гипертонии малого круга и потери легочными сосудами способности отвечать вазодилятацией на эндотелийзависимые субстанции при хронической гипоксии [12]. Во многих случаях ингаляции NO устраняют легочную вазоконстрикцию, связанную с гипоксией, первичной легочной гипертензией, сердечными пороками, респираторным дистресс-синдромом взрослых [12].
Увеличение концентрации NO является одним из патогенетических звеньев различного вида шоков [5]. Доказано, что прогрессивное снижение артериального давления в случаях затяжного инфекционно-токсического шока, обусловлено повышенной секрецией окиси азота в результате экспрессии индуцибельной NOS под влиянием воспалительных стимулов [20, 49]. При этом отмечается рефрактерность даже к большим дозам вазоконстрикторов, однако доказано, что сразу же после внутривенного назначения ингибиторов NO артериальное давление у таких больных повышается [49]. Аналогичная ситуация отмечается и при геморрагическом шоке [50].
Концентрация NO в крови увеличивается не только при шоке, но и при многих других болезнях [11, 51]. Для большинства из них характерна склонность к гипотонии и понижению резерва сократительной функции сердца.
Отрицательное инотропное действие провоспалительных цитокинов на изолированную папиллярную мышцу опосредуется NO, который является эффективной молекулой цитокинов [52]. Развитие недостаточности кровообращения при системных воспалительных реакциях также связано с гиперпродукцией NO в сосудах под действием воспалительных стимулов [20].
В кардиомиоцитах больных дилятационной кардиомиопатией была обнаружена индуцибельная NOS, которая в здоровых кардиомиоцитах не встречается [53]. В экспериментальных исследованиях выявлено отрицательное хронотропное действие NO на миокард [54]. Повышенное содержание NO в крови является, по-видимому, одной из причин нарушения сократительной функции сердца при дилатациоонной кардиомиопатии, миокардите и инфаркте миокарда [55, 56].
Известно, что местные сосудистые реакции, вызванные атеросклерозом и разрушением эндотелия, также приводят к гиперпродукции оксида азота в результате экспрессии индуцибельной NOS [20].
Представленные данные свидетельствуют, что как дефицит, так и избыток оксида азота способствуют возникновению самой разнообразной патологии сердечно-сосудистой системы.
Понижение секреции NO приводит к развитию артериальной гипертензии, патологии коронарных сосудов, прогрессированию предтромботических и тромботических состояний, нарушению микроциркуляции, усилению гипоксической вазоконстрикции легочных сосудов. Оксид азота играет ключевую защитную роль в ишемическом поражении миокарда, принимает участие в патогенезе ишемического инфаркта мозга, процессах ремоделирования сосудов, активации стресс-лимитирующих факторов, в механизмах модуляции иммунного ответа.
Чрезмерное повышение концентрации NO в крови приводит к гипотонии и понижению резерва сократительной функции сердца, является одним из патогенетических звеньев различного вида шоков.
Таким образом, для кардиологов вопросы поддержания физиологического уровня концентрации и функционального состояния эндогенного NO в организме человека представляются чрезвычайно актуальными как в научном, так и в практическом отношении.
Особое значение имеет тот факт, что эффективность работы цикла оксида азота резко повышается при функциональных нагрузках, связанных с усиленной утилизацией кислорода, при ишемиях мозга и миокарда, при многочисленных патологических процессах, протекающих в условиях гипоксии. Лишь в тех случаях, когда использование кислорода будет полностью компенсироваться его поступлением, роль цикла окиси азота может оставаться такой же, какую он выполняет в обычных физиологических условиях [57]. Следовательно, роль цикла окиси азота резко возрастает при таких заболеваниях, как ишемическая болезнь сердца и мозга, артериальная гипертензия, врожденные и приобретенные пороки сердца, миокардиодистрофии.
В настоящее время ведутся интенсивные поиски методов по созданию фармакологических активаторов гуанилатциклазы на основе химических структур (доноров), обеспечивающих возможность образования в организме эндогенного оксида азота, регуляцию его концентрации и реакционной способности [6, 14].
К сожалению, пока препараты на основе описанных соединений не внедрены в клиническую практику. Кроме того, фармакологическая коррекция содержания NO может сопровождаться возникновением нежелательных побочных эффектов, поскольку в настоящее время в клинике отсутствуют доступные методы определения концентрации оксида азота в кровотоке.
В связи с вышеизложенным представляет интерес использование в качестве потенциального регулятора цикла оксида азота электромагнитного излучения миллиметрового диапазона (ЭМИ ММД) или излучение в диапазоне крайне высоких частот (КВЧ-излучение), которое включает электромагнитные колебания частотой от 3 ´ 1010 до 3 ´ 1011 Гц, что соответствует длинам волн от 1 до 10 мм [59]. Одним из основных свойств ЭМИ ММД является зависимость результатов воздействия ЭМИ ММД от фазы биологического развития и от исходного состояния объекта: на нормальное функционирование здорового организма ЭМИ ММД практически не влияет [59, 60, 61], а при возникновении патологии может отрегулировать его функционирование в пределах, присущих данному биологическому виду [62].
По мнению ряда современных авторов, при облучении ЭМИ терагерцового диапазона на частотах молекулярного спектра оксида азота (ЭМИ ТГЧ-NO) может не только возрастать синтез эндогенного оксида азота и повышаться его реакционная способность, но и увеличиваться продолжительность существования оксида азота в клетках [63].
В настоящее время выявлено положительное влияние ЭМИ ТГЧ-NO на функциональные свойства тромбоцитов и реологические параметры при облучении крови больных стенокардией в условиях in vitro [64, 65], а также восстановление исходно нарушенных реологических показателей и функциональной активности тромбоцитов при облучении ЭМИ ТГЧ-NO белых крыс, находящихся в состоянии иммобилизационного стресса [66].
С 2004 г., после изучения воздействия ЭМИ на частотах молекулярного спектра оксида азота у здоровых добровольцев, на кафедре терапии ФПК и ППС Саратовского медицинского университета впервые были начаты исследования по изучению влияния ТГЧ-терапии-NO у больных кардиологического профиля [67]. Первые результаты подтвердили предполагаемые вазоактивный, антиангинальный и гипокоагуляционный эффекты ТГЧ-излучения-NO [67], что позволяет рассматривать ЭМИ ТГЧ-NO в качестве нового перспективного направления в терапии кардиоваскулярной патологии, требующего серьезного изучения.
В дальнейшем было установлено, что ТГЧ-терапия-NO способствует усилению антиангинального и гипотензивного действия медикаментозного лечения у больных как стабильной, так и нестабильной стенокардией, улучшает отдаленные результаты лечения данных категорий пациентов, благоприятно влияет на реологические свойства крови, что чрезвычайно важно для оптимизации процессов микроциркуляции, а также оказывает выраженный положительный эффект на течение хронического ДВС-синдрома у пациентов со стабильной стенокардией высоких функциональных классов [68, 69].
В то же время, при изучении влияния ЭМИ ТГЧ-NO у больных стенокардией среднего и пожилого возраста получены результаты, которые свидетельствуют об относительно независимой динамике показателей гемокоагуляционного потенциала и антиангинального эффекта ТГЧ-терапия-NO [70]. Купирование приступов стенокардии происходило в равной степени у пациентов среднего и пожилого возраста, в то время как изменение параметров тромбогенного потенциала крови существенно различалось.
У больных среднего возраста улучшение гемокоагуляционных показателей происходило за счет увеличения активности естественного антикоагулянта антитромбина-III вплоть до его полной нормализации, при этом воздействия на прокоагулянтный потенциал не отмечено. В группе пациентов пожилого возраста, напротив, влияние ТГЧ-терапии-NO реализовывалось через положительную динамику уровня естественных прокоагулянтов, причем воздействие осуществлялось как на начальные, так и на конечные этапы свертывания крови, что проявлялось в снижении уровня фибриногена в сочетании с удлинением АВР. При этом отсутствовала динамика активности антитромбина-III [70]
В последних работах установлено, что эффективность ТГЧ-терапии-NO зависит от тяжести исходного состояния больных стенокардией III-IV ф.к. [71]
У пациентов с исходно менее частыми приступами стенокардии (1-3 в сутки) почти в 90% (89,5%) удается добиться полного исчезновения приступов стенокардии к моменту выписки из стационара. При этом максимальное антиангинальное действие ЭМИ ТГЧ-NO выявлено к окончанию курса лечения – к 7-му сеансу.
У больных стенокардией III-IV ф.к.с более частыми приступами (более 3-х в сутки) полного купирования приступов стенокардии удалось добиться только в 51,4% случаев, что существенно ниже, чем у пациентов с более легким течением стенокардии, но максимальный антиангинальный эффект был достигнут раньше, к 6-му сеансу [71]
Таким образом, у более тяжелых пациентов, вероятно, целесообразно ограничиваться укороченным курсом ТГЧ-терапии-NO. Полученные сведения соответствуют одному из основных положений о взаимодействии волн миллиметрового диапазона с живыми объектами: при более тяжелом исходном состоянии для нормализации гомеостаза требуется менее активное воздействие [59-62].
Чрезвычайно интересным представляется тот факт, что влияние ЭМИ ТГЧ-NO на показатели гемокоагуляции и реологии крови принципиально отличается в двух обследованных группах: при менее частых приступах стенокардии выявлено только снижение прокоагулянтного потенциала, тогда как в группе с более частыми болевыми приступами увеличивается и восстанавливается активность антикоагулянтного звена, а также повышается деформируемость эритроцитов [71]. Объяснить механизм подобных различий с учетом имеющихся сведений пока не представляется возможным.
Вместе с тем данные результаты могут быть связаны с активацией различных компонентов цикла оксида азота в отдельных группах больных стенокардией, поскольку известно, что многочисленные, зачастую противоположные эффекты оксида азота связаны с разнообразными сигнальными путями NO (которые зависят от относительной скорости формирования NO, окислительно-восстановительных реакций, а также комбинаций кислорода, супероксидного радикала и других биологических молекул) и чувствительностью клеточных систем к тому или иному сигнальному пути [12]. Итоговый эффект NO может зависеть от места его генерации, локальной концентрации и взаимодействия с другими компонентами тканей [11].
Полученные результаты свидетельствуют, что ЭМИ ТГЧ-NO является перспективным методом, оказывающим влияние на патогенетические механизмы развития сердечно-сосудистой патологии (тромбогенный потенциал, гемореологические показатели), повышающим антиангинальное и антигипертензивное воздействие медикаментозжных препаратов.
Вместе с тем выявленные различия эффектов ТГЧ-терапии-NO в отдельных группах больных стенокардией требуют дальнейших исследований для разработки индивидуального подхода при использовании волн терагерцового диапазона в клинической практике.
Особые указания
Применение препарата необходимо сопровождать контролем артериального давления, частоты сердечных сокращений (ЧСС), сердечного ритма, а также наблюдать за состоянием газообмена и дыхания, температурой тела пациента. Во время наркоза рекомендуется периодически откачивать газ из манжетки эндотрахеальной трубки.
Применение Азота закиси показано при лечении детей грудного и старшего возраста. Нельзя назначать препарат новорожденным.
Длительный контакт с препаратом у медицинского персонала повышает риск развития лейкопении.
Определенные концентрации смеси с циклопропаном, эфиром, хлорэтилом взрывоопасны.
Для больных хроническим алкоголизмом требуется назначение высоких концентраций динитрогена оксида.
Влияние на способность к управлению автотранспортом и сложными механизмами
Препарат не применяют при управлении транспортными средствами и механизмами.
Физиологическая регуляция продукции NO
Способность к продукции NO служит маркером нормального функционального состояния эндотелия: устранение эффектов NO в здоровом организме (например, путем фармакологической блокады eNOS) ведет к сужению сосудов и повышению уровня системного артериального давления. В результате действия почти всех нормальных физиологических стимулов содержание NO-синтазы в эндотелии (и/или ее активность) повышается. Ключевой фактор, регулирующий продукцию NO, — поток крови []. При ее движении по сосуду на поверхности эндотелия возникает напряжение сдвига. Этот стимул передается к локализованной внутри клеток эндотелиальной NO-синтазе через активацию механочувствительных каналов и вход Са2+. Другой вариант передачи — посредством мембранных ферментов, если повышается активность протеинкиназы Akt и фосфорилируется eNOS (по сайту Ser1177). Поток крови обеспечивает постоянную секрецию эндотелием небольших количеств NO (рис. 3).
Рис. 3.
Схема влияния фосфорилирования молекул eNOS на активность этого фермента. Под действием нормальных стимулов (напряжения сдвига, многих гормонов, физиологической гипоксии и др.) такие протеинкиназы, как Akt, АМФ-активируемая (
АМПК
) и протеинкиназа А (
ПКА
), осуществляют фосфорилирование по серину-1177 (
Ser117
;
левая часть схемы
). В результате эндотелиальная NO-синтаза активируется, что приводит к синтезу NO. С другой стороны, гипергликемиия, активные формы кислорода, окисленные липопротеиды или медиаторы воспаления действуют на протеинкиназу С (
ПКС
), которая фосфорилирует треонин-495 (
Thr495
). При этом активность eNOS уменьшается, а следовательно, сокращается и продукция оксида азота. Таким образом, интенсивность работы eNOS в эндотелиальных клетках может регулироваться разными протеинкиназами
Важную роль в чувствительности эндотелия к напряжению сдвига играет гликокаликс. Это покрывающий клетки слой полимерных молекул углеводной природы, толщина которого может составлять несколько микрометров и даже превышать толщину самого эндотелия []. Поскольку «кустики» гликопротеидов растут внутрь просвета сосуда, именно они в первую очередь испытывают действие потока крови. Деформируясь, волокна гликокаликса передают сигнал мембранным белкам и далее — eNOS. Хотя этот механизм пока изучен мало, о его важности говорит тот факт, что нарушение реакции сосудов на напряжение сдвига при различных заболеваниях (атеросклерозе, сахарном диабете и др.) сопряжено с «облысением» эндотелия, т. е. с уменьшением толщины и изменением структуры гликокаликса.
Повышение скорости кровотока ведет к активации эндотелиальной NO-синтазы и к расширению сосудов, а подобные длительные или многократные воздействия увеличивают содержание этого фермента в эндотелии. На этом основано благотворное влияние физических упражнений: известно, что с помощью тренировки можно значительно улучшить работу эндотелия без применения лекарств! Однако следует отметить, что такое полезное влияние оказывают не любые упражнения. Во-первых, нагрузка должна сопровождаться повышением скорости кровотока в работающих мышцах, как это происходит при быстрой ходьбе, беге или езде на велосипеде, а силовые упражнения с гирями такого влияния не оказывают. Во-вторых, нельзя тренироваться через силу: при чрезмерных нагрузках резко повышается секреция основного гормона стресса, кортизола, который снижает активность eNOS.
Дополнительную активацию эндотелиальной NO-синтазы при физической нагрузке обеспечивает протеинкиназа, активируемая аденозинмонофосфатом (АМФ), которая содержится почти во всех клетках нашего организма, в том числе и в эндотелиальных. Этот фермент называют «сенсором энергетического статуса клеток», потому что он активируется, когда в цитоплазме клетки повышается отношение АМФ / АТФ, т. е. расход энергии начинает превышать ее образование. В эндотелии артерий, расположенных внутри интенсивно сокращающихся скелетных мышц, это может происходить в результате гипоксии — мышечные клетки потребляют много О2, и его не хватает эндотелию сосудов. Кроме того, недавно было показано, что активация этой протеинкиназы в эндотелиальных клетках возможна при увеличении напряжения сдвига, т. е. при усилении притока крови к работающим мышцам. Активированная протеинкиназа фосфорилирует eNOS по сайту Ser1177, продукция NO увеличивается и сосуды расширяются.
Врачи-кардиологи хорошо знают, что путем регулярных физических тренировок можно улучшить функцию эндотелия не только в скелетных мышцах и сердце, которые при работе интенсивно снабжаются кровью, но и в органах, напрямую не задействованных в тренировке, — в головном мозге, коже и т. д. Это говорит о том, что помимо влияния потока крови на эндотелий имеются и другие механизмы регуляции эндотелиальной NO-синтазы. Среди них ведущая роль принадлежит гормонам, которые продуцируются железами внутренней секреции, транспортируются кровью и распознают клетки-мишени в различных органах по наличию специальных белков-рецепторов [].
Из гормонов, которые могут влиять на функцию эндотелия при физической нагрузке, отметим гормон роста (соматотропный гормон), который секретируется гипофизом. Как сам по себе, так и через свои посредники, инсулин-подобные факторы роста, гормон роста увеличивает образование эндотелиальной NO-синтазы и ее активность.
Наиболее известный пример гормональной регуляции функций эндотелия — это влияние женских половых гормонов, эстрогенов. Исходно такое представление сформировалось благодаря эпидемиологическим наблюдениям, когда выяснилось, что по какой-то причине женщины детородного возраста по сравнению с мужчинами меньше страдают от сосудистых нарушений, связанных с дисфункцией эндотелия. Более того, у женщин его способность продуцировать NO меняется в течение менструального цикла, причем в первой половине, когда концентрация эстрогенов в крови высокая, расширение сосудов, зависимое от эндотелия, более выражено. Эти наблюдения послужили толчком к проведению многочисленных экспериментов на животных. Так, удаление яичников у самок крыс уменьшало содержание и активность эндотелиальной NO-синтазы в артериях разных органов (головного мозга, сердца, скелетных мышц, почек, кишечника и др.), а введение таким самкам эстрогенов способствовало нормализации нарушенной функции. Влияние эстрогенов на активность eNOS связано с активацией протеинкиназы Akt, а повышение синтеза eNOS — с их воздействием на геном эндотелиальных клеток.
Интересно, что нарушение реакций артерий мозга обнаружили и в экспериментах с удалением половых желез у самцов, хотя семенники секретируют не эстрогены, а андрогены, мужские половые гормоны. Этот парадокс стал понятным, когда в эндотелии артерий мозга обнаружили ароматазу — фермент, превращающий андрогены в эстрогены. Таким образом, защитное влияние эстрогенов на эндотелий сосудов может иметь место и у особей мужского пола. Однако в данном случае следует говорить о локальной регуляции, которая обеспечивается эстрогенами, образующимися непосредственно в сосудистой стенке.
В заключение рассмотрим регуляцию эндотелиальной NO-синтазы гормонами щитовидной железы. Известно, что при нарушениях ее работы в эндотелии сосудов меняется интенсивность синтеза NO: при гипертиреозе повышается, а при гипотиреозе снижается. Такое влияние обусловлено в основном изменением содержания NO-синтазы в клетках эндотелия. Однако в последнее время появились данные о существовании еще одного механизма действия этих гормонов на эндотелиальные клетки сосудов. Так, Ca2+-зависимая активность eNOS и степень ее фосфорилирования по сайту Ser1177 в артериях крыс c экспериментальным гипертиреозом оказалась значительно выше, чем у крыс с гипотиреозом.
Известно, что гормоны щитовидной железы играют ключевую роль в дифференцировке тканей в развивающемся организме. Но их влияние не сводится лишь к ускорению или замедлению протекающих процессов, а зачастую имеет программирующий характер. Это означает, что при недостатке гормонов щитовидной железы в определенном критическом возрасте клетки не смогут превратиться в полноценно функционирующие, даже если вводить гормоны на последующих этапах жизни (у человека гормональная терапия эффективна лишь в течение первых месяцев после рождения). Механизмы программирующего влияния гормонов щитовидной железы подробно изучены лишь для нервной системы, а для остальных систем — значительно хуже. Вместе с тем хорошо известно, что гипотиреоз у матери во время беременности служит, помимо прочего, фактором риска развития у ребенка сердечно-сосудистых заболеваний. Интересно, что в артериях детенышей крыс в первые недели после рождения выявляются повышенные уровни рецепторов тиреоидных гормонов, а также фермента дейодиназы, который превращает тироксин (тетрайодтиронин) в более активный трийодтиронин. На основании этих наблюдений заманчиво предположить, что гормоны щитовидной железы могут оказывать программирующее влияние и на эндотелий сосудов. Насколько это верно, покажут будущие исследования.
Лекарственное взаимодействие
При одновременном применении Азота закиси:
- Амиодарон – повышает вероятность артериальной гипотензии и не купируемой атропином брадикардии;
- Фентанил и его производные – усиливают влияние на сердечно-сосудистую систему, способствуют снижению минутного объема сердца и ЧСС;
- Ксантины – увеличивают риск аритмий;
- Транквилизаторы, средства для ингаляционной анестезии, нейролептики, наркотические анальгетики, антигистаминные препараты – усиливают действие.
При сочетании препарат усиливает эффекты диазоксида, ганглиоблокаторов, диуретиков, производных кумарина и индандиона, средств, угнетающих нервную систему и дыхание.
Ингаляции азотом при лечении детей
Чаще всего лечение зубов у ребенка не обходится без использования анестезии. Одним из самых лучших методов успокоить малыша и настроить на позитивный лад считается ингаляция с закисью азота. Детям ее вводят в очень малых дозах, и ребенок даже не засыпает. Конечно, если у малыша сильная истерика, будет лучше, если он заснет на полчаса. Тогда используют закись азота для наркоза. Обычно этого времени хватает, чтобы стоматолог закончил манипуляции с больным зубом. Многих родителей смущает подобная процедура. Они не знают, как организм ребенка ее перенесет, возникнут ли побочные действия и не станет ли ему хуже после ингаляции. Поэтому необходимо разобраться во всех нюансах процедуры, узнать о ее преимуществах и недостатках.
Отзывы об Азота закиси
Отзывы об Азота закиси как о средстве для общей анестезии на сайтах и форумах немногочисленны: наркоз переносится хорошо, серьезных побочных эффектов не вызывает.
Чаще всего встречаются сообщения о применении у детей Азота закиси в стоматологии. Родители пишут, что Азота закись в качестве седативного средства им порекомендовал стоматолог после того, как ребенок наотрез отказался лечить зубы. В этом случае газовую смесь подают через нос. Лечение, сопровождаемое седацией, проходило успешно, ребенок находился в сознании, но был спокойнее, чем обычно. Из побочных эффектов описана только сонливость после процедуры.
Запретный воздух
Двоюродный брат Эдгара По, Джордж, тоже поучаствовал в деле популяризации веселящего газа — когда придумал способ его сжижать. До того закись азота приходилось возить в огромных мешках, это было дорого и неудобно, особенно по сравнению с инъекционными анальгетиками — например, морфином, который во второй половине XIX века уже набирал популярность. Сжиженная закись азота занимала значительно меньше места, на смену мешкам пришли металлические баллоны, которые надолго обосновались в стоматологических кабинетах. А оттуда попадали на вечеринки.
В этом качестве закись азота просуществовала весь XX век. И если оборот медицинской закиси азота еще можно было как-то контролировать, то баллоны поменьше, которые использовались, чтобы взбивать сливки в ресторанах, из-под этого контроля ускользали. Поэтому добыть веселящий газ было несложно. К тому же он недорого стоил — например, на американском рок-фестивале 1970-х газ обходился по 25 центов за воздушный шарик.
Философ Бертран Рассел в 15-й главе «Истории западной философии» вспоминает со ссылкой на Уильяма Джеймса (того самого, с которого мы начали наш рассказ) такой анекдот о некоем любителе веселящего газа: «Всякий раз, когда он находился под воздействием этого газа, он знал тайну Вселенной, но когда приходил в себя, то забывал ее. Наконец ему удалось путем огромного усилия записать эту тайну до того, как видение исчезло. Совершенно очнувшись, он бросился посмотреть то, что записал. Это было: „Повсюду пахнет нефтью“».
Судя по всему, Рассел ошибся с источником и немного изменил цитату — есть основания считать, что это отсылка к экспериментам медика Оливера Холмса не с веселящим газом, а эфиром, никакого отношения к тайне Вселенной не имевшим, а пахло для Холмса все не нефтью, а скипидаром. Тем не менее, широкую известность получила именно версия Рассела, Летов спел «вечность пахнет нефтью», а веселящий газ, под действием которого Джеймс изучал Гегеля, помимо эйфории, действительно может вызывать галлюцинации.
Несмотря на неоднозначность своих эффектов, веселящий газ не только не растерял свою аудиторию — но даже, наоборот, нарастил ее по мере криминализации конкурентов. К концу 2000-х годов в США около 15 процентов подростков хотя бы раз в жизни пробовали закись азота. А у себя на родине, в Великобритании, она к 2021 году стала восьмым по популярности наркотиком. С ней был лично знаком по крайней мере каждый третий житель королевства — в то время как опиоиды принимали меньше процента взрослых британцев. Сколько потребителей веселящего газа в России — неизвестно, хотя, судя по отдельным медицинским исследованиям, они есть, и их немало.
Таких исследований последствий потребления веселящего газа появляется все больше по всему миру — и мы все больше узнаем о возможных побочных эффектах, которые, как оказывается, у веселящего газа тоже есть. Сами по себе ингаляции обычно безвредны: психогенный эффект газа проходит уже через пять минут, поскольку долго он в крови не задерживается и выходит через легкие обратно. Хотя дезориентация в пространстве и возможные галлюцинации могут, конечно, привести к травмам — особенно если человек находится за рулем автомобиля.
Но от «веселых передышек» могут быть и долгосрочные последствия. Закись азота в больших количествах окисляет кобальт в молекуле витамина B12 и выводит его из строя. А B12, в свою очередь, участвует в синтезе ДНК. Поэтому хронические ингаляции могут привести к снижению числа эритроцитов и лейкоцитов в крови. Кроме того, нарушение обмена витамина приводят к накоплению метилмалоновой кислоты, которая вызывает повреждение миелиновых оболочек в спинном мозге и, как следствие, неврологические нарушения. Их часто описывают исследователи из Китая: пациенты жалуются на слабость, нестабильность походки и бегание мурашек по телу.
На фоне растущего спроса на веселящий газ правительства сразу нескольких стран решили объявить закись азота вне закона. Великобритания в 2021 году ужесточила наказание за нелегальные производство и сбыт веселящего газа (правда, это снова относится только к медицинской закиси азота, а «пищевой» веселящий газ остается легко доступным). Северная Ирландия тоже приняла такой закон — в 2021 году, после смерти пятнадцатилетнего подростка.
В России с 1 января 2021 года действует федеральный закон № 472-ФЗ «Об ограничении оборота закиси азота в Российской Федерации». Согласно нему, запрещены производство, изготовление, поставка, хранение, перевозка и пересылка закиси азота не для медицинского, промышленного или технического применения. Кроме того, запрещена реализация и сбыт такой продукции, а сама закись азота считается «одурманивающим веществом».
Признаки и симптомы зависимости от «веселящего газа»
Заподозрить то, что подросток вдыхает газ, можно по таким признакам:
- беспричинный смех;
- головокружения;
- падения в обморок;
- частые головные боли.
К сожалению, родители часто пропускают первые звоночки, настолько они еле заметны. Долгосрочную зависимость от «веселящего газа» скрыть сложнее, близкие легко заподозрят неладное по таким симптомам:
- эмоциональная неустойчивость;
- глубокая депрессия;
- бессонница;
- агрессия;
- ухудшение слуха и осязания;
- невнятность речи;
- шаткая походка;
- хронический тонзиллит;
- синяки и ссадины по всему тела.
Необходимость ингаляций в детской стоматологии
Чаще всего лечение закисью азота проводят не по желанию родителей. Данный метод выбирается врачом во время знакомства с ребенком. Использовать закись азота для ингаляции приходится в следующих ситуациях:
- Если у ребенка много запущенных зубов.
- При паническом страхе, перерастающим в истерику. Он будет бояться врача и всячески мешать этим лечению. Седация успокоит ребенка и поможет ему избавиться от страха к стоматологам.
- При дошкольном возрасте. Малыш просто не в состоянии будет высидеть час и более в кресле стоматолога.
Если врач настаивает на применении, необходимо принять его сторону. Однако следует убедиться, что у ребенка нет противопоказаний к данному виду анестезии.
Пищевая промышленность
Применяется N2O высокой очистки. Закись азота выступает в роли консерванта (обозначение – Е942), продлевая срок хранения продуктов и напитков. Ее используют на этапе упаковки. Закись азота помогает сохранить:
- шоколад;
- мясо и колбасные изделия;
- вина, другой алкоголь;
- тесто.
Попадая в тару, вещество вытесняет водяной пар и кислород. Так создается менее благоприятная для многих патогенов среда, сохраняются вкусовые качества товаров. Закись азота также используются на разных этапах производства. С ее помощью получают пористый шоколад, взбитые сливки. Вещество применяют для охлаждения.
Эффективность лечения пристрастия к «веселящему газу»
Главное, что нужно понимать: закись азота вызывает не только физическую, но и психологическую зависимость. Поэтому самостоятельно справиться с пагубным пристрастием невозможно. Это и является главной причиной, по которой мы настаиваем на лечении зависимости от «веселящего газа» в стационаре.
Курс рассчитан на 21 день пребывания в клинике. Этого достаточно, чтобы вывести пациента в ремиссию, провести симптоматическое лечение органов-мишеней, выработать мотивацию к трезвой жизни. А чтобы добиться полного выздоровления и снизить вероятность срыва, мы продолжаем наблюдать реабилитантов ещё год после выписки из стационара.
Наши пациенты раз в месяц продолжают приходить в клинику на психотерапевтические сеансы. И всегда могут позвонить лечащему врачу, если чувствуют, что могут сорваться.