Химические свойства
Что такое альфа-липоевая кислота? Тиоктовая кислота также имеет названия тиоктацид, липоевая кислота. Это витаминопободное вещество, кофактор пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов, антиоксидант.
Вещество синтезируют в виде светло-желтого кристаллического горького порошка, который не растворяется в воде, но хорошо растворим в этаноле. В лекарственных препаратах используют растворимую форму химического соединения – его натриевую соль. Вещество в большом количестве содержится в печени, шпинате, почках и сердце, рисе. Организм в норме способен синтезировать достаточное количество альфа-липоевой кислоты. Лекарство выпускают в форме концентрата для инфузионного раствора и внутримышечных инъекций, в виде покрытых оболочкой таблеток.
Альфа-липоевая кислота в бодибилдинге
Вещество применяют спортсмены для ликвидации свободных радикалов и снижения показателей оксидации после тренировок. Средство замедляет процессы разрушения белков и клеток, ускоряет восстановление после тренировки. Также вещество ускоряет и улучшает усвоение глюкозы мышцами, стимулирует процессы сохранения гликогена. Также считается, что кислоту можно применять в качестве эффективного жиросжигателя.
Рассеянный склероз (РС) – прогрессирующее аутоиммунное заболевание центральной нервной системы (ЦНС) с дегенеративным компонентом, поражающее преимущественно пациентов молодого возраста и зачастую приводящее к инвалидизации [1].
За последнее время в мире достигнут значительный прогресс в разработке и внедрении препаратов, изменяющих течение рассеянного склероза (ПИТРС), влияющих на снижение частоты обострений РС. К ПИТРС, зарегистрированным в Российской Федерации [2], относятся интерфероны, глатирамера ацетат, натализумаб, финголимод и внутривенные иммуноглобулины, разрабатываются и готовятся к регистрации новые препараты. Однако вопросы симптоматической терапии, стандарты купирования обострения (экзацербации) заболевания до настоящего времени полностью не разрешены. Наибольшую эффективность при этом показали методы массивной иммуносупрессии – пульс-терапия метилпреднизолоном, использование обменного плазмафереза, в меньшей степени назначают большие дозы глюкокортикоидов и иммуносупрессантов перорально [2]. В то же время появляются данные о возможности воздействия на отдельные патогенетические механизмы для купирования обострения РС, в частности при помощи антиоксидантной терапии [3]. Причем различные авторы предлагают применять альтернативные подходы как наряду с международными стандартами лечения обострения, так и вместо них (например, при «мягких» обострениях либо сопровождающихся лишь чувствительной симптоматикой). Большая значимость данного направления состоит и в том, что при частом применении гормонотерапии эффективность повторных курсов иммуносупрессии неуклонно снижается, а возможность применения альтернативных препаратов для купирования обострений умеренной тяжести позволит сохранить эффективность стандартной схемы пульс-терапии.
Тикотовая (α-липоевая) кислота (АЛК) – эндогенный антиоксидант, который является коферментом, входящим в состав энзимов группы кокарбоксилаз, участвующим в углеводном и жировом обменах [4]. АЛК, обладающая выраженным антиоксидантным действием, по результатам многочисленных исследований показала свою эффективность при лечении заболеваний периферической нервной системы и ЦНС [5]. При лечении диабетической полиневропатии тиоктовая кислота на основании мета-анализа признана единственным препаратом с уровнем доказательности класса А [6–9]. Проведено много исследований эффективности тиоктовой кислоты при заболеваниях ЦНС: рассеянного склероза [10, 11], острого нарушения мозгового кровообращения [12], черепно-мозговой травмы [14], болезни Альцгеймера [15], болезни Паркинсона [16]. Показана значительная эффективность препаратов при лечении экспериментального аутоиммунного энцефалита – основной модели демиелинизирующих заболеваний у лабораторных животных [9].
В качестве биохимических показателей эффективности антиоксиданной терапии предлагаются [10, 11] степень ингибирования индуцируемой нитроксидсинтазы, матриксная металлопротеаза-9 (MMP-9), растворимые внутриклеточные молекулы адгезии-1 (sICAM-1), оксид азота и др. Данные показатели не только связаны с оксидативным стрессом, но и кореллируют с активностью процесса миграции активированных Т-лимфоцитов через гематоэнцефалический барьер в ЦНС. Несколько независимых исследовательских групп выявили значимое снижение MMP-9, sICAM-1 при применении как ПИТРС, так и тиоктовой кислоты [10, 11].
С учетом роли окислительного стресса в патогенезе демиелинизации и поддержания аутоиммунного процесса у больных РС перспективными направлениями оптимизации терапии этого заболевания являются замедление процессов образования оксида азота, введение извне молекул-«мусорщиков» или же усиление энзиматических путей инактивации свободных радикалов. Известно, что некоторые из общеизвестных методов лечения больных РС оказывают патогенетическое воздействие на эти процессы. Так, одним из эффектов пульс-терапии метилпреднизолоном является достоверное снижение образования супероксида.
В настоящее время выпускается несколько препаратов, содержащих различные соли тиоктовой кислоты (этилендиаминовую, трометамоловую, меглюминовую). При введении меглюминовой соли тиоктовой кислоты частота побочных эффектов ниже, чем при инфузии других солей тиоктовой кислоты.
Ряд авторов считают необходимыми дальнейшие исследования применения тиоктовой кислоты в качестве препарата, снижающего вероятность обострения, средства симптоматической терапии, а также лечения экзацебраций в виде монотерапии или в составе комплексной терапии.
Целью нашей работы стала оценка эффективности применения препарата α-липоевой кислоты при купировании экзацербации у больных РС.
Материал и методы
Было проведено одномоментное проспективное исследование с участием пациентов неврологического отделения с обострением РС. Состояние больных оценивали по шкале Куртцке EDSS (Expanded Disability Status Scale).
Критерии включения в исследование: возраст от 18 до 45 лет, наличие обострения РС, поступление в отделение в течение 10 дней от начала обострения, наличие сенсорных нарушений в структуре заболевания, информированное добровольное согласие на участие в исследовании. Всего в исследование были включены 42 пациента с обострением РС, разделенных на две группы случайным образом.
I группа – 22 пациента с обострением РС, имеющих сенсорные нарушения, в возрасте от 19 до 36 лет. В среднем 24,27±2,61 года. Среди обследованных были 15 (68,18%) женщин и 7 (31,82%) мужчин. II группа – 20 пациентов с обострением РС, имеющих сенсорные нарушения, в возрасте от 18 до 42 лет.
В среднем 23,93±1,55 года. Среди обследованных были 14 (70%) женщин и 6 (30%) мужчин.
Терапия всех пациентов с обострением РС осуществлена с учетом клинических рекомендаций по схеме: метилпреднизолон 1000 мг внутривенно, капельно, 5–7 дней в зависимости от тяжести обострения.
К лечению пациентов II группы добавили препарат АЛК по схеме: 600 мг (24 мл) α-липоевой кислоты внутривенно, капельно, медленно на 200 мл физиологического раствора ежедневно в течение 5 суток, затем прием α-липоевой кислоты 600 мг 1 раз в сутки перорально в течение 5 недель.
Оценка клинической симптоматики проведена до начала лечения, через 2 и 6 недель от начала терапии по расширенной шкале инвалидизации при РС Курцтке EDSS.
Статистическая обработка полученных результатов и построение диаграмм осуществлены с использованием программ Microsoft Excel 5,0 for Windows»и SPSS 15.0 for Windows.
Оценка эффективности вмешательства – по клинически значимому исходу лечения (отсутствие или сохранение остаточной клинической симптоматики обострения РС). Сравнивались группы больных в зависимости от применяемой схемы лечения с последующим построением таблицы сопряженности [17].
Результаты исследования
На рисунке представлена динамика клинической симптоматики по шкале EDSS в обследуемых группах до начала терапии, через 2 недели и 1 месяц после начала лечения. Степень инвалидизации по шкале EDSS на момент начала лечения обострения была выше во II группе по сравнению с I группой (среднее значение – 3,35 и 3,11 балла соответственно). Несмотря на случайное распределение пациентов по группам, группы были абсолютно сопоставимыми по полу и возрасту и к моменту окончания исследования; среднее EDSS практически не различалось (2,07 балла в I группе и 2,0 – во II). Однако наблюдалась значительно лучшая динамика уменьшения симптоматики по оценке общего балла по EDSS у пациентов II группы, получавших наряду с пульс-терапией метилпреднизолоном препараты АЛК. Динамика за время госпитализации (в среднем 14 дней) составила для I группы -0,91 балла по шкале EDSS, во II группе снижение составило -1,02 балла. Через месяц после выписки (через 6 недель от начала терапии): общая динамика по EDSS для I группы – -1,04 балла, для II группы – -1,35. При анализе динамики показателей отдельных функциональных систем статистически достоверных закономерностей выявить не удалось в связи с малой выборкой пациентов.
У пациентов I группы (22 человека) ожидаемый положительный результат (отсутствие новой клинической симптоматики по отношению к неврологическому статусу до обострения) наблюдали у 6 (27,27%) человек; вероятный неудовлетворительный исход (сохранение остаточной клинической симптоматики) – у 16 (72,73%).
У пациентов II группы (20 человек) ожидаемый положительный результат (отсутствие резидуальной клинической симптоматики по отношению к неврологическому статусу до обострения) наблюдали у 15 (75%) человек; вероятный неудовлетворительный исход (сохранение остаточной клинической симптоматики) – у 5 (25%).
ЧИЛ (частота исходов в экспериментальной группе)=А/(А+В)=5/20=0,25=25,0%.
ЧИК (частота исходов в группе сравнения)=С/(С+D)=16/22=0,727≈72,7%.
САР (снижение абсолютного риска)=/ЧИЛ-ЧИК/=/0,25-0,727/=0,477≈0,48≈48%.
СОР (снижение относительного риска)=/ЧИЛ-ЧИК/ЧИК≈ 0,477/0,727≈0,656≈65,6%.
ЧБНЛ (число больных, которых необходимо лечить определенным методом в течение заданного времени, чтобы предупредить наступление неблагоприятного исхода у одного больного)=1/САР=1/0,48≈1,92.
ОШ (отношение шансов)=(А/В)/(С/D)=(5/15)/(16/6)=0,33/2,67≈0,12.
Полученные показатели свидетельствуют о том, что схема терапии обострения РС сопровождается клинически значимым положительным эффектом, отражающимся в показателях СОР, составляющим 65,6%, ОШ, равным ≈ 0,12. Значение ЧБНЛ, равное в нашем исследовании 1,92, доказывает возможность предотвратить неблагоприятный исход (сохранения остаточной клинической симптоматики) не менее чем у каждого третьего пациента с РС при применении схемы лечения заболевания с применением АЛК.
Обсуждение
В настоящее время все шире обсуждается роль препаратов α-липоевой кислоты в лечении заболеваний нервной системы, в патогенезе которых активную роль играет оксидативный стресс. Одним из наиболее активно исследуемых направлений служит применение АЛК при рассеянном склерозе. Несколько проведенных исследований показали хорошую переносимость как пероральных, так и инъекционных форм препаратов АЛК и их эффективность в качестве средства симптоматической терапии сенсорных расстройств [10, 11]. Доказан эффект в плане значительного снижения в сыворотке маркеров оксидативного стресса, уменьшения проницаемости гематоэнцефалического барьера в эксперименте [10].
В проведенном нами небольшом проспективном исследовании проведена оценка переносимости и эффективности препаратов АЛК для пациентов с обострением РС и возможность улучшения прогноза. Выявлена более выраженная динамика снижения EDSS в группе пациентов, получавших препараты тиоктовой кислоты наряду с гормональной пульс-терапией. Причем эта динамика наблюдалась как в острый период – 14 дней с момента начала лечения, так и при продолжении приема препаратов тиоктовой кислоты в течение 4 недель после выписки из стационара. Результаты многих проведенных исследований дают надежду на эффективное применение препаратов АЛК в комплексной терапии РС, однако необходимы дальнейшие более крупные исследования.
Препараты АЛК продемонстрировали хорошую переносимость со стороны всех пациентов, ни одного случая отказа от терапии в связи с побочными эффектами зарегистрировано не было. С позиции классической доказательной медициной СОР, равное 65,6%, уровень ОШ – 0,12 и ЧБНЛ≈1,92 позволяют говорить о высокой степени эффективности α-липоевой кислоты в схеме терапии обострения РС. Однако с учетом малой выборки пациентов и неоднородности их по тяжести обострения и длительности заболевания необходимо проведение больших контролируемых исследований по всем правилам доказательной медицины для обоснования необходимости назначения исследуемого препарата в составе комплексной терапии обострения РС.
Фармакодинамика и фармакокинетика
Тиоктовая Кислота – кофермент окислительного декарбоксилирования пировиноградной кислоты и различных альфа-кетокислот. Вещество принимает участие в энергетическом, липидном и углеводном обмене, в метаболизме холестерина, связывает свободные радикалы. Под действием средства улучшается работа печени, активнее вырабатывается гликоген. Нейтрализуется действие экзогенных и эндогенных токсинов, алкоголя. По своей биохимической активности лекарство близко к витаминам группы В.
При добавлении альфа-липоевой кислоты в растворы для внутривенного введения (при совместимости растворов) уменьшается выраженность проявления побочных реакции от препаратов.
После перорального приема, желательно без пищи, вещество полно и быстро всасывается в пищеварительном тракте. Биодоступность достигает 30-60%, так как средство подвергается пресистемной биотрансформации. В тканях печени лекарство окисляется. Выводится с помощью почек. Период полувыведения составляет от 20 минут до часа.
Липоевая кислота 25 мг
Липоевая кислота
Регистрационный номер и дата: РN 001574/01 от 10.05.2007 г
Торговое название препарата: Липоевая кислота
Международное непатентованное название: тиоктовая кислота Лекарственная форма: таблетки, покрытые оболочкой
Состав:
Активное вещество:
Липоевая кислота (тиоктовая кислота) -12 мг и 25 мг
Вспомогательные вещества: сахар (сахароза), глюкоза (декстроза), крахмал картофельный, кальция стеарат 1-водный (кальция стеарата моногидрат), стеариновая кислота, тальк (магния гидросиликат).
Вспомогательные вещества оболочки: аэросил (кремния диоксид коллоидный), воск пчелиный, титана диоксид, магния карбонат основной (магния гидроксикарбонат), масло вазелиновое, поливинилпирролидон низкомолекулярный медицинский (повидон), сахар (сахароза), тальк (магния гидросиликат), краситель хинолиновый желтый Е-104.
Описание
Таблетки желтого или зеленовато-желтого цвета, покрытые оболочкой.
На поперечном разрезе видны два слоя.
Фармакотерапевтическая группа: метаболическое средство.
Код ATX: [A05BA].
Фармакологическое действие
Липоевая кислота является коферментом, участвующим в окислительном декарбоксилировании пировиноградной кислоты и альфа-кетокислот, играет важную роль в энергетическом балансе организма. По характеру биохимического действия тиоктовая кислота сходна с витаминами группы В. Участвует в регулировании липидного и углеводного обменов, оказывает липотропный эффект, влияет на обмен холестерина, улучшает функцию печени, оказывает дезинтоксикационное действие при отравлении солями тяжелых металлов и при других интоксикациях.
Показания к применению
Жировая дистрофия печени, цирроз печени, хронический гепатит, гепатит А, интоксикации (в т.ч. солями тяжелых металлов, бледной поганкой), гиперлипидемия.
Противопоказания
Гиперчувствительность, период лактации, детский возраст (до 6 лет).
С осторожностью — беременность
Способ применения и дозы
Внутрь после еды. Взрослые — по 50 мг 3-4 раза в сутки.
Дети старше 6 лет — по 12-24 мг 2-3 раза в сутки.
Длительность лечения — 20-30 дней. При необходимости по назначению врача проводится повторный курс лечения через 1 месяц.
Побочное действие
Диспепсия (в т.ч. тошнота, изжога, рвота, диарея, абдоминальные боли), аллергические реакции (в т.ч. крапивница, кожная сыпь, зуд и системные аллергические реакции вплоть до анафилактического шока), гипогликемия.
Взаимодействие с другими лекарственными препаратами
Усиливает противовоспалительное действие глюкокортикостероидов. Снижает эффективность цисплатина. Усиливает действие инсулина и пероральных гипогликемических средств. Связывает металлы, поэтому не следует принимать одновременно с препаратами, содержащими ионы металлов (препараты железа, магния кальция); интервал между приемом должен составлять не менее 2 часов. Этанол и его метаболиты ослабляют действие липоевой кислоты.
Особые указания
В период лечения необходим регулярный контроль концентрации глюкозы (особенно в начале терапии) у пациентов с сахарным диабетом; следует воздержаться от употребления алкоголя.
Форма выпуска
Таблетки, покрытые оболочкой 12 мг и 25 мг.
По 10 таблеток в контурную ячейковую упаковку.
По 50, 100 таблеток в банки из стекломассы или в банки из полимерного материала.
Каждую банку или 5 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку.
Условия отпуска из аптек
По рецепту.
Условия хранения:
В сухом, защищенном от света месте при температуре не выше 25°С.
Срок годности:
3 года. Не применять по истечении срока годности, указанного на упаковке.
Единицы измерения:
уп.
Побочные действия
Могут развиться следующие побочные действия:
- рвота, понос, тошнота, боли в животе, крапивница;
- зуд и сыпь, анафилактические реакции, гипогликемия;
- головные боли, гипогликемия;
- после быстрого внутривенного введения – задержка дыхания, рост внутричерепного давления, диплопия, судороги, кровотечения.
Тиоктовая кислота, инструкция по применению (Способ и дозировка)
При назначении препарата внутрь его используют в разовой дозировке 600 мг. Курс лечения длительный, в среднем – 3 месяца.
Инструкция на альфа-липоевую кислоту для инъекций
При тяжелой полиневропатии внутривенно вводят 600 мг средства, медленно, 50 мг в минуту. Концентрат разводят хлоридом натрия. Кратность введения – один раз в сутки. При необходимости дозу можно повысить до 1,2 г в сутки. Продолжительность лечения – до 4 недель.
Внутримышечно лекарство не рекомендуется вводить более 50 мг за раз. Необходимо периодически менять место инъекции.
Альфа-липоевая Эвалар принимается согласно инструкции производителя.
Эффективность препаратов тиоктовой кислоты в лечении диабетической полиневропатии
М.В. НЕСТЕРОВА1
, д.м.н.,
В.В. ГАЛКИН2
1
Уральский государственный медицинский университет, Свердловский областной клинический психоневрологический госпиталь для ветеранов войн, Екатеринбург
2
Демидовская городская больница, Нижний ТагилВ статье рассматриваются вопросы лечения диабетической полиневропатии — наиболее частой формы неврологического осложнения сахарного диабета. Представлен патогенез, особенности диагностики и лечения с современных позиций доказательной медицины. Проведен анализ существующих на российском фармацевтическом рынке препаратов тиоктовой кислоты для лечения диабетической полиневропатии с указанием наиболее предпочтительных для использования торговых названий. Приведены результаты собственного исследования по лечению болевой формы диабетической невропатии.
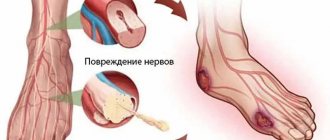
Проблема лечения диабетической полиневропатии (ДПН) — одной из самых частых форм неврологического осложнения сахарного диабета (СД) — продолжает оставаться актуальной вследствие широкого распространения и значимых материальных потерь, причиняемых обществу в результате ущерба, связанного с нетрудоспособностью. ДПН, наряду с диабетической ретинопатией и нефропатией, входит в классическую триаду поздних осложнений СД и приводит к ухудшению качества жизни, инвалидизации и смерти пациентов. С внедрением в практику новых инсулиновых препаратов значительно возросла продолжительность жизни больных сахарным диабетом, в связи с чем вырос процент поздних осложнений, в т. ч. ДПН. ДПН является междисциплинарным предметом внимания и встречается в практике не только неврологов и эндокринологов, но и терапевтов, дерматологов, хирургов-педиатров, реабилитологов и других специалистов.
Сахарный диабет — одно из самых распространенных заболеваний, охватившее до 10—15% населения развитых стран с удвоением числа больных каждые 10—15 лет [1]. В литературе, по данным разных исследователей, ДПН развивается в различные сроки практически у всех больных СД, частота варьирует в больших пределах и выявляется почти у 50% пациентов с СД и 30% среди всех случаев полиневропатии [2—11]. По данным Рочестерского исследования, распространенность ДПН в Северной Америке составляет около 50%, что соответствует распространенности ДПН в европейской популяции больных СД [5, 12-14]. Ряд авторов указывает на вероятность развития невропатии в зависимости от компенсации углеводного обмена, длительности СД, типа диабета и диагностируется у 7,5—10% пациентов с впервые выявленным СД 2-го типа [7—9]. Другие авторы отмечают одинаковую распространенность ДПН при СД 1-го и 2-го типов и зависимость от продолжительности диабета и от эффективности его лечения [15—19]. Частота ее выявления напрямую зависит от диагностических критериев, используемых в различных популяционных исследованиях. Отдельные исследователи указывают на частоту диагностируемой невропатии при проведении электронейромиографии до 90—100%. До 50% пациентов имеют бессимптомную форму, а болевой синдром при ДПН встречается примерно в 10—20% случаев и относится к наиболее мучительным для пациента проявлениям заболевания [3, 20, 21]. В 2006 г. M. Davies и соавт. опубликовали данные результатов исследования, в котором жалобы на болезненные ощущения предъявляли до 64% пациентов, при этом только у 19% была выявлена «истинная» болевая ДПН [22]. Отмечена четкая корреляция наличия и выраженности болевой невропатии с длительностью СД, уровнем гликозилированного гемоглобина (HbA1c) и тяжестью невропатии. В настоящее время признано, что частота развития ДПН связана с длительностью СД, уровнем и значительными колебаниями HbA1c, дислипидемией, высоким индексом массы тела, альбуминурией, гипертензией и курением [18, 19, 23].
На современном этапе развития диабетологии и неврологии существует большое количество различных теорий относительно причин и механизмов развития ДПН среди которых исследователи выделяют четыре основные: метаболическую, сосудистую, наследственную и дизиммунную теории [2, 24—27]. Несмотря на обилие концепций развития невропатии, ее основным установленным патогенетическим фактором является гипергликемия [28, 29]. Pfieffer и Schumer предположили, что во временном патогенезе ДПН можно выделить стадию функциональных и стадию анатомических нарушений [30]. Функциональные изменения развиваются на ранних стадиях невропатии и полностью или частично обратимы на фоне стабильного гликемического контроля, что подтверждается исследованиями DCCT и UKPDS, в которых у пациентов с длительным компенсированным СД удалось добиться снижения развития ДПН (на 64%) по сравнению с больными, имеющими декомпенсированный СД [10, 31]. Гипергликемия оказывает нейрональное повреждение, вызванное внутриклеточным увеличением глюкозы с избыточным метаболизмом и накоплением токсических продуктов, таких как сорбитол и фруктоза, повышением внутриклеточного осмотического давления, отеком нейронов. Отмечается, что гипергликемия с накоплением токсических метаболитов и конечных продуктов гликирования усиливает образование свободных радикалов с развитием «оксидантного стресса» и снижение уровня миоинозитола, что также оказывает повреждающее действие на нейроны. В настоящее время феномен «окислительного стресса» рассматривают в качестве основной причины поздних осложнений СД, в т. ч. генерализованного поражения периферических нервов. Снижение факторов роста нерва при ДПН ухудшает регенераторные возможности аксонов, что способствует прогрессированию аксональной дегенерации и сегментарной демиелинизации. По данным многочисленных крупных контролируемых исследований, таких как DCCT, UKPDS, Рочестерской когорты, VACSDM, Steno-2, определена четкая связь длительности СД и степени гипергликемии с тяжестью полиневропатии [5, 10, 31—35]. Сосудистая теория в равной степени с метаболической также считается одной из ведущих в патогенезе ДПН. Академик А.С. Ефимов в своих работах писал: «…диабет, начинаясь как болезнь обмена, становится преимущественно сосудистой патологией» [36, 37]. Вниманию уделяются микроангиопатии, развивающиеся также в результате гликирования эндотелиальных клеток, при которых поражаются vasa nervorum и нарушается эндоневральная циркуляция, с формированием перикапиллярного отека. Сосудистая теория объясняет также развитие диабетической ретинопатии и нефропатии [28, 29]. Эндоневральная гипоксия, метаболические изменения и нарушение выработки вазоактивных релаксирующих агентов (оксида азота) способствуют развитию ишемии нерва, в результате чего развиваются дегенеративные и апоптотические изменения в периферических нервах.
По определению ВОЗ, ДПН — это болезнь, характеризующаяся прогрессирующей гибелью нервных волокон, приводящей к потере чувствительности и развитию язв стопы [38, 39]. Из-за вариабельности клинических проявлений в литературе отсутствует универсальная классификация ДПН. Наиболее широко используется классификация P.K. Thomas (1997, 2003), согласно которой выделяют следующие клинические формы: обратимые (транзиторная гипергликемическая невропатия, острая сенсорная болевая невропатия, краниальные, множественные мононевропатии, радикулоплексопатии) и прогрессирующие (дистальная сенсомоторная полиневропатия, проксимальная моторная невропатия, вегетативная невропатия) [40, 41]. А.С. Ефимов и соавт. в 1981 г. предложили классификацию, рассматривающую доклиническую, начальную, явную и выраженную стадии ДПН [37]. Данная классификация близка к разделению невропатии на четыре стадии, предложенные P.J. Dyck et al. (1993, 1999, 2003): бессимптомная (N1a), легкая (N1b и N2a), умеренная (N2b) и тяжелая инвалидизирующая (N3) стадия ДПН [37, 42].
В настоящее время в литературе накоплен достаточный фактический материал по терапии диабетической невропатии. Основные направления в лечении — это воздействие на патогенез и назначение симптоматических средств.
Патогенетическое лечение диабетической невропатии включает компенсацию углеводного обмена с назначением средств нейрометаболического действия. Нормализация уровня сахара крови достоверно снижает риск развития полиневропатии. Исследование DCCT (Diabetes Control and Complications Trial) показало, что нормализация углеводного обмена и адекватный гликемический контроль в последующем уменьшают риск развития ДПН на 64% и частоту выявления нарушений проводимости по нервным волокнам у пациентов с СД 1-го типа – на 44%. Также было отмечено, что на фоне стабильного гликемического контроля у пациентов с недавно выявленной ДПН отмечался регресс клинических проявлений этого осложнения [31]. Подобные выводы были получены и в исследовании UKPDS, проведенном в Великобритании, где было показано, что пациенты с СД 2-го типа, получавшие интенсивную сахароснижающую терапию со снижением уровня HbA1c до 7,0%, имели достоверное уменьшение на 40% частоты развития полиневропатии по сравнению с пациентами на стандартной терапии [10]. Но оказалось, что интенсивная гипогликемическая терапия не в состоянии полностью исключить возникновение или ликвидировать клинические проявления ДПН и привести к ее серьезному регрессу. В связи с этим требуется дополнительное патогенетическое и симптоматическое лечение.
Для лечения диабетической невропатии в разные годы было предложено множество средств нейрометаболического действия. Основными препаратами, имеющими патогенетическое действие, являются антиоксиданты и жирорастворимые производные тиамина.
Антиоксидантные препараты уменьшают выраженность оксидантного стресса, действуя как ловушки свободных радикалов. Основной массив данных по эффективности антиоксидантов при ДПН в литературе представлен при применении α-липоевой (тиоктовой) кислоты [43—45]. Лечебный эффект α-липоевой (тиоктовой) кислоты заключается в ее мощном антиоксидантном действии. Под воздействием α-липоевой (тиоктовой) кислоты происходит синтез циклического аденозинмонофосфата посредством активации рецепторов, связанных с G-белком и аденилатциклазой, а также регенерация и восстановление других антиоксидантов в организме через воздействие на тканевой глутатион и убихинон [46]. Α-липоевая (тиоктовая) кислота также может выступать в качестве кофермента мультиферментных комплексов окислительного декарбоксилирования пировиноградной и альфа-кетокислот. Α-липоевая (тиоктовая) кислота способна предотвращать образование конечных продуктов гликирования, уменьшая тяжесть окислительного стресса [47]. Α-липоевая (тиоктовая) кислота — это универсальный «сборщик» свободных радикалов, который работает как внутри, так и вне клетки. Первое применение α-липоевой (тиоктовой) кислоты в клинике для лечения ДПН было проведено еще в 1959 г. Дальнейшие доклинические и клинические исследования показали, что она влияет на патогенез, факторы риска начала и прогрессирования ДПН [48]. Высокая эффективность α-липоевой (тиоктовой) кислоты подтверждена в нескольких рандомизированных двойных слепых плацебо-контролируемых исследованиях, таких как ALADIN, ALADIN II, ALADIN III, ORPIL, SYDNEY, DEKAN, NATHAN I и NATHAN II [49—54]. Проведенные контролируемые исследования показали, что применение препаратов α-липоевой (тиоктовой) кислоты уменьшает как субъективные (боль, жжение, онемение, парестезии), так и объективные проявления диабетической полиневропатии, кардиальной автономной ДН, в частности увеличивает вариабельность сердечного ритма по сравнению с плацебо [55]. Было показано, что длительная пероральная терапия α-липоевой (тиоктовой) кислотой позволяет не только контролировать симптомы периферической ДН, но и улучшать электрофизиологические показатели функции нервов [52]. Дозы 600 и 1 200 мг в день показали одинаковую эффективность, однако доза 1 200 мг ассоциировалась с большей частотой побочных эффектов. Кроме того, показана хорошая переносимость и безопасность лечения α-липоевой (тиоктовой) кислотой. Доза α-липоевой (тиоктовой) кислоты в 600 мг является наиболее оптимальной в отношении польза — риск [56]. В 2010 г. S. Salinthone и соавт. показали противовоспалительные эффекты α-липоевой (тиоктовой) кислоты. Так, α-липоевая (тиоктовая) кислота подавляет активность и цитотоксичность NK-клеток, уменьшает уровень интерлейкинов 6 и 17, пролиферацию Т-клеток [46]. В двух рандомизированных плацебо-контролируемых исследованиях показана способность α-липоевой (тиоктовой) кислоты повышать у больных СД, получавших α-липоевую (тиоктовую) кислоту, утилизацию глюкозы тканями и улучшать гликемический профиль [57—59]. В последнее время α-липоевая (тиоктовая) кислота применяется при лечении других осложнений СД, таких как нефропатии и ретинопатии [60—63].
В большом клиническом исследовании ESPALIPON II (1995) с участием 3 509 пациентов с ДПН были продемонстрированы высокая эффективность и хорошая переносимость препарата тиоктовой кислоты Эспа-Липон в различных лекарственных формах. Это касалось как раствора для инфузий, так и таблетированной формы препарата. Эффективность оценивалась как «очень хорошая» и «хорошая» 83% врачей и 80% пациентов, что было подтверждено клиническими показателями. Также высоко была оценена переносимость препарата Эспа-Липон — 95% врачей и больных высказались за «хорошую» и «очень хорошую» переносимость лекарственного препарата [68].
Препараты α-липоевой (тиоктовой) кислоты относятся к веществам с плохой растворимостью, следовательно, таблетированные препараты α-липоевой (тиоктовой) кислоты отличаются по степени высвобождения активного вещества (рис
.). Разница в биодоступности и высокая вариабельность концентрации в плазме крови пероральных препаратов α-липоевой (тиоктовой) кислоты не позволяют говорить об их взаимозаменяемости [48]. Рандомизированные контролируемые клинические исследования α-липоевой (тиоктовой) кислоты были проведены с использованием препарата «быстрого высвобождения», имеющего эталонный тест на растворимость и наименьшую интериндивидуальную вариабельность уровня в плазме крови. Препарат Эспа-Липон максимально приближен к препарату «быстрого высвобождения».
На современном рынке лекарственных препаратов представлено более 14 торговых наименований лекарственных средств с действующим веществом липоевая (тиоктовая) кислота, выпускающихся в различных формах. Препараты α-липоевой (тиоктовой) кислоты производятся как отечественными, так и зарубежными производителями. В нашей стране выпускается четыре наименования лекарственных средств. Препараты зарубежных компаний представлены пятью наименованиями и выпускаются в основном Германией и Украиной. В таблице
представлены основные лекарственные препараты α-липоевой (тиоктовой) кислоты.
| Таблица. Основные лекарственные препараты α-липоевой (тиоктовой) кислоты | ||||
| Торговое наименование | Фирма | Страна | Форма выпуска | Уп, шт. |
| Таблетированные и капсульные формы | ||||
| Берлитион 300 | «Берлин-Фарма» | Германия | Табл. п/о 300 мг | 30 |
| Нейролипон | «Фармак ПАО» | Украина | Капс. 300 мг | 30, 60 |
| Октолипен | «Фармстандарт-Лексредства» | Россия | Капс. 300 мг, табл. п/о 600 мг | 30 |
| Тиогамма | «Верваг Фарма ГмбХ и Ко. Кг» | Германия | Табл. п/о 600 мг | 30, 60 |
| Тиоктацид БВ | «Меда Фарма ГмбХ и Ко. Кг» | Германия | Табл. п/о 600 мг | 30, 60, 100 |
| Тиолепта | «Канонфарма продакшн» | Россия | Табл. п/о 300, 600 мг | 30 |
| Эспа-Липон | «Эспарма ГмбХ» | Германия | Табл. п/о 600 мг | 30 |
| Инфузионные формы | ||||
| Берлитион 300 Берлитион 600 | «Берлин-Фарма» | Германия | Амп. 25 мг/мл, 12, 24 мл | 5 |
| Липотиоксон | Фарм | Россия | Амп. 25 мг/мл, 12, 24 мл | 5 |
| Нейролипон | «Фармак ПАО» | Украина | Амп. 30 мг/мл, 10, 20 мл | 5 |
| Октолипен | «Фармстандарт-УфаВИТА» | Россия | Амп. 30 мг/мл, 5, 10 мл | 5, 10 |
| Тиогамма | «Верваг Фарма ГмбХ и Ко. Кг» | Германия | Амп. 12 мг/мл, 50 мл, 30 мг/мл, 20 мл | 5, 10 |
| Тиоктацид 600 Т | «Меда Фарма ГмбХ и Ко. Кг» | Германия | Амп. 25 мг/мл, 24 мл | 5 |
| Тиолипон | «Биосинтез» | Россия | Амп. 30 мг/мл, 10 мл | 10 |
| Эспа-Липон | «Эспарма ГмбХ» | Германия | Амп. 25 мг/мл, 12 мл | 10 |
| Эспа-Липон | «Эспарма ГмбХ» | Германия | Амп. 25 мг/мл, 24 мл | 5 |
Следует отметить, что лечение препаратом Эспа-Липон в суточной дозировке 600 мг по фармакоэкономическим показателям имеет преимущества по сравнению с терапией другими препаратами α-липоевой кислоты немецких производителей. Что же касается качества, то препарат Эспа-Липон намного превосходит аналоги российского и украинского производства.
Инфузионные препараты α-липоевой (тиоктовой) кислоты представлены тремя солями: этилендиаминовой (Эспа-Липон, Берлитион, Октолипен), трометамоловой (Тиоктацид) и меглюминовой (Тиогамма, Нейролипон). Считается, что меглюминовая и трометомоловая соли при внутривенном введении чаще, чем этилендиаминовая соль, вызывают местно-раздражающее действие на ткани и ощущение жжения, снижение артериального давления и головную боль. В России более 15 лет применяется препарат Эспа-Липон (Esparma GmbH). Препарат выпускается в виде концентрата этилендиаминовой соли α-липоевой (тиоктовой) кислоты для приготовления раствора в виде инфузий по 300 или 600 мг и таблеток 600 мг и отпускается по рецептам установленной формы. В клинических исследованиях препарат Эспа-Липон показал свою высокую эффективность [64]. В процессе лечения наблюдалось улучшение симптоматики диабетической невропатии. В 95% случаев лечащие врачи и в 95% — больные оценили переносимость препарата как «хорошую» или «очень хорошую». В качестве побочных эффектов отмечались слабая тошнота, головные боли, головокружение, диспепсия, а также чувство жжения и зуд после быстрого введения препарата. Режим дозирования Эспа-Липона: при тяжелых формах полиневропатии препарат назначают 1 раз в сутки (утром натощак за 30—40 мин до приема пищи) в виде в/в капельных инфузий. Взрослым для приготовления инфузионного раствора от 24 до 48 мл раствора разводят в 250 мл изотонического раствора натрия хлорида (что соответствует приему 600—1 200 мг тиоктовой кислоты в сутки) в зависимости от тяжести состояния и массы тела больного. Препарат рекомендуется применять в течение 2—4 нед. Возможно в/м введение препарата, но доза препарата при инъекции в одно и то же место не должна превышать 50 мг (2 мл).
Далее следует перейти на поддерживающую терапию в форме таблеток. Минимальный курс приема таблеток 3 мес. Средняя рекомендуемая доза составляет 400—600 мг/сут (1 таблетка по 600 мг или 2—3 таблетки по 200 мг). При необходимости возможен более длительный прием препарата.
Таблетки следует принимать за 30 мин до приема пищи, не разжевывая и запивая небольшим количеством жидкости.
При ДПН важно определить показания для симптоматической терапии. С этой целью ряд авторов рекомендует использовать визуальную аналоговую шкалу (ВАШ) (или шкала Lickert). Средства симптоматической терапии назначаются при показателе ВАШ > 40 мм, а также при нарушении сна из-за болей и снижение качества жизни [65—67]. Невропатическая боль в отличие от ноцицептивной плохо поддается лечению обычными аналгетиками и нестероидными противовоспалительными препаратами, и их применение — при наличии у пациентов диабетической нефропатии — может быть опасно. Боль при полиневропатии можно контролировать с помощью нескольких групп нейротропных средств, воздействующих на разные механизмы невропатической боли. К ним относятся антидепрессанты, антиконвульсанты, местные анестетики и опиоидные аналгетики.
Авторами на базе Демидовской городской больницы и Свердловского областного клинического психоневрологического госпиталя проведено исследование по лечению диабетической невропатии симптоматическими препаратами. Для этой цели использовались препараты дулоксетин и габапентин, которые назначались при болевой форме диабетической невропатии. Оба препарата достоверно уменьшают все проявления нейропатической боли при диабетической невропатии, однако имеют различия по выраженности анальгетического эффекта и в показателях биологического возраста в пользу дулоксетина, а также отличия в лечении объективных симптомов. Так, габапентин восстанавливал сухожильные рефлексы и вибрационную чувствительность, а дулоксетин улучшал показатели болевой, температурной и тактильной чувствительности.
Для лечения ДПН применяются физиотерапевтические методики, такие как магнитотерапия, чрескожная электрическая стимуляция нерва, лечебная гимнастика, бальнеотерапия, релаксационная терапия, акупунктура. Целью физиотерапии ДПН является оказание аналгетического, противовоспалительного действия, улучшение проведения импульсов по нервам, ускорение процессов регенерации нервных волокон, улучшение кровообращения в периневральных тканях.
Таким образом, диабет с развитием поздних осложнений в виде диабетической невропатии и синдрома диабетической стопы является глобальной эпидемией в связи с высокой распространенностью, имеющей ощутимые последствия для людей, социальной сферы и экономики. Это обуславливает актуальность проблемы поиска и разработки новых терапевтических приемов. Длительная терапия препаратом α-липоевой (тиоктовой) кислоты (Эспа-Липон) уменьшает неврологический дефицит и снижает риск развития синдрома «диабетической стопы» и ампутации конечности. Собранные к настоящему времени результаты позволяют считать антиоксидант Эспа-Липон как чрезвычайно перспективный препарат, обладающий протективным действием на механизмы развития невропатии и других осложнений диабета.
Литература
1. Дедов И.И. Сахарный диабет в Российской Федерации: проблемы и пути решения. Сахарный диабет, 1998, 1: 7-18. 2. Жулев Н.М. Невропатии: Руководство для врачей. СПб: Издательский дом СПбМАПО, 2005, 416. 3. Яхно Н.Н., Кукушкин М.Л., Давыдов О.С. и др. Результаты Российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу (EPIC Study). Боль, 2008, 3: 24-32. 4. Cabezas-Cerrato J. The prevalence of diabetic neuropathy in Spain: a study in primary care and hospital clinic groups. Diabetologia, 1998, 41: 1263-1269. 5. Dyck PJ, Katz KM, Karnes JL et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy and nephropathy in a population-based cohort: the Rochester Diabetic Neuropathy Study. Neurology. 1993, 43: 817-824. 6. Kumar S, Ashe HC, Parnell LN et al. The prevalence of foot ulceration and its correlates in type 2 diabetes: a population-based study. Diabe Med., 1994, 11: 480-484. 7. Melton LJ, Dyck PJ, Thomas PK. In Diabetic Neuropathy. Epidemiology, 1999: 239-278. 8. Partanen J, Niskanen L, Lehtinen J, Mervaala E et al. Natural history of peripheral neuropathy in patients with non-insulin dependent diabetes. New Engl J Med., 1995, 333: 39-84. 9. Pirart J. Diabetes mellitus and its degenerative complications: a prospective study of 4,400 patients observed between 1947 and 1973. Diabetes Care. 1978, 1: 168-188. 10. UKPDS: Intensive blood glucose with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes. Lancet. 1998, 352: 837—853. 11. Young MJ, Boulton AJM, MacLeod AF et al. A multicentre study of the prevalence of diabetic peripheral neuropathy in the United Kingdom hospital clinic population. Diabetologia. 1993, 36: 150—154. 12. Яхно Н.Н. Боль. Руководство для врачей и студентов. М., 2009. 304 с. 13. Bouhassira D, Lanteri-Minet M, Attal N et al. Prevalence of chronic pain with neuropathic characteristics in the general population. Pain. 2008, 136: 380—387. 14. Torrance N, Smith BH, Bennett MI et al. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. Pain. 2006, 7: 281-289. 15. Калинин А.П, Котов С.В, Рудакова И.Г. Неврологические расстройства при эндокринных заболеваниях: Руководство для врачей. М.: МИА, 2009, 488 с. 16. Franklin GM, Kahn LB, Baxter J et al. Sensory neuropathy in noninsulin-dependent diabetes mellitus. Am J Epidemiol. 1990: 633—643. 17. Prevalence of Diabetic Neuropathy and Foot Ulceration: Identification of Potential Risk Factors — A Population-Based Study. Manes Ch, Papazoglou N, Sossidou E et al. 14, 2002, Wounds, Т. 1: 11-15. 18. Epidemiological correlates of diabetic neuropathy: report from Pittsburgh Epidemiology of Diabetes Complications Study. Maser RE, Steenkiste AR, Dorman JS, Nielsen VK et al. 38, 1989, Diabetes: 1456—1461. 19. Tesfaye S, Chaturvedi N, Simon EM et al. Vascular Risk Factors and Diabetic Neuropathy. The New England Journal of Medicine. 2005, 4, 352: 341-350. 20. Sorensen L, Molyneaux L, Yue DK. Insensate versus painful diabetic neuropathy: the effects of height, gender, ethnicity and glycaemic control. Diabetes Res Clin Pract. 2002, 57: 45-51. 21. Ziegler D, Gries FA, Spuler M, Lessmann F. The epidemiology of diabetic neuropathy: DiaCAN Multicenter Study Group. Diabet Med. 1993, 10: 82-86. 22. Davies M, Brophy S, Williams R, Taylor A. The prevalence, severity, and impact of painful diabetic peripheral neuropathy in type 2 diabetes. Diabetes Care. 2006, 29: 1518-1522. 23. Franklin GM, Shetterly SM, Cohen JA, Baxter J, Hamman R.F. Risk factors for distal symmetric neuropathy in NIDDM. Diabetes Care. 1994, 17: 1172-1177. 24. Левин О.С. Полиневропатии. М.: МИА, 2011. 496 с. 25. Pittenger GL, Malik RA, Burcus N, Boulton AJ, Vinik A.I. Specific fiber deficits in sensorimotor diabetic polyneuropathy correspond to cytotoxicity against neuroblastoma cells of sera from patients with diabetes. Diabetes Care. 1999, 22: 18. 26. Srinivasan S, Stevens MJ, Sheng H, Hall KE, Wiley JW. Serum from patients with type 2 diabetes with neuropathy induces complement-independent, calcium-dependent apoptosis in cultured neuronal cells. J Clin Invest. 1998, 102: 1454-1462. 27. Strokov IA, Bursa TR, Drepa OI et al. Predisposing genetic factors for diabetic polyneuropathy in patients with type 1 diabetes: a population—based case—control study. Acta diabetologica. 2003, 2, 40: 375-379. 28. Brownlee M. Biochemistry and molecular cell biology of diabetic complications. Nature. 2001, 414: 813-820. 29. Brownlee M. The pathobiology of diabetic complications. A unifying mechanism. Diabetes. 2005, 54: 1615-1625. 30. Pfiefer MA, Schumer MP. Clinical trials of diabetic neuropathy: Past, present and future. Diabetes. 1995, 44: 1355-1361. 31. DCCT (The Diabetes Control and Complications Trial Research Group). The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 1993, 329: 977-986. 32. Azad N, Emanuele NV, Abraira C, Henderson WG et al. The effects of intensive glycemic control on neuropathy in the VA Cooperative Study on Type II Diabetes Mellitus (VACSDM). J Diabetes Compl. 1999, 13: 307-313. 33. Gaede P, Lund-Andersen H, Parving H-H, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med. 2008, 358: 580-591. 34. Gaede P, Vedel P, Larsen N, Jensen GV et al. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med. 2003, 348: 383—393. 35. Pitale SU, Abraira C, Emanuele NV et al. Two years of intensive glycemic control and left ventricular function in the Veterans Affairs Cooperative Study in Type 2 Diabetes Mellitus (VACSDM). Diabet Care. 2000, 23: 1316-1320. 36. Ефимов А., Зуева Н., Скробонская Н. Диабетические ангиопатии: этиология и патогенез. Ліки України. 2004, 11: 36-38. 37. Ефимов А.С. Диабетические ангиопатии. М., 1989. 38. Дедов И.И., Анциферов М.Б., Галстян Г.Р., Токмакова А.Ю. Синдром диабетической стопы: клиника, диагностика, лечение и профилактика. М., 1998: 138 с. 39. Carrington AL, Abbott CA, Shaw JE, Vileikyte L, Van Schie CHM, Boulton AJM. Can motor nerve conduction velocity predict foot problems in diabetic neuropathy over a 6-year outcome period? Diabetes Care. 2002, 25: 2010-2015. 40. Thomas PK. Classification of the diabetic neuropathies. [авт. книги] Cameron NE, Low PA, Ziegler D. Gries FA. Thomas PK.: ClassDiabetic Neuropathy. Stuttgart : Thieme, 2003: 175-177. 41. Thomas PK. Classification, differential diagnosis and staging of diabetic peripheral neuropathy. Diabetes. 1997, 46: 54-57. 42. Dyck PJ. Severity and staging of diabetic polyneuropathy. [авт. книги] Cameron NE, Low PA, Ziegler D. Gries FA. Diabetic Neuropathy. Stuttgart: Thieme, 2003: 170-175. 43. Северина Т.И., Тарасов А.В., Трельская Н.Ю., Шилова О.Л., Дрометр А.В. Результаты применения тиоктацида в лечении диабетической нейропатии у больных СД 1 типа. Сахарный диабет. 2000, 4: 33—35. 44. Строков И.А., Строков К.И., Ахмеджанова Л.Л., Албекова Ж.С. Тиоктацид в лечении диабетической полиневропатии. Трудный пациент. 2008, 12: 19-23. 45. Строков И.А., Козлова Н.А., Мозолевский Ю.В. и др. Эффективность внутривенного введения трометамоловой соли тиоктовой (-липоевой) кислоты при диабетической невропатии. Журнал неврология и психиатрия. 1999, 99, 6: 18-22. 46. Salinthone S, Yadav V, Schillace RV et al. Lipoic acid attenuates inflammation via cAMP and protein kinase A signaling. PLoS One. 2010, 9, 5: 13058. 47. Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. М.: Слово, 2006: 553. 48. Белоусов Ю.Б., Афанасьева Е.В., Белоусов Д.Ю., Зырянов С.К. Применение тиоктовой кислоты в терапии диабетической полиневропатии. Качественная клиническая практика. 2011, 1: 85-91. 49. Ametov AS, Barinov A, Dyck PJ et al. The Sensory Symptoms of Diabetic Polyneuropathy Are Improved With Lipoic Acid (The SYDNEY Trial). Diabetes Care. 2003, 26: 770-776. 50. Reljanovic M, Reichel G, Rett K et al. Treatment of diabetic polyneuropathy with the antioxidant thioctic acid (alpha-lipoic acid): a two year multicentre randomized double-blind placebo-controlled trial (ALADIN II). Free Radic Res. 1999, 31: 17. 51. Ziegler D, Hanefeld M, Ruhnau K et al. And the ALADIN Study group: treatment of symptomatic diabetic peripheral neuropathy with the antioxidant a-lipoid acid. Diabetologica. 1995, 38: 1425-1433. 52. Ziegler D, Hanefeld M, Ruhnau KJ et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicentre randomized controlled trial (ALADIN III Study). ALADIN III Study Group. Diabetes Care. 1999, 22: 1296-1301. 53. Ziegler D, Nowak H, Kemplert P et al. Treatment of symptomatic diabetic polyneuropathy with antioxidant a-lipoic acid: a meta-analysis. Diabetic Medicine 2004. Vol. 21. P. 114—21. Diabetic Medicine. 2004, 21: 114-121. 54. Ziegler D, Ametov A, Barinov A et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes Care. 2006, 29: 2365-2370. 55. Ziegler D, Gries FA. Alpha-lipoic acid in the treatment of diabetic peripheral and cardiac autonomic neuropathy. Diabetes. 1997, Т. 2, 46: 562-566. 56. Han T, Bai J, Liu W, Hu Y. A systematic review and meta-analysis of α-lipoic acid in the treatment of diabetic peri¬pheral neuropathy. Eur. J. Endocrinol. 2012, 167: 465-471. 57. Меньщикова Е.Г., Зенков Н.К., Ланкин В.З. и др. Окислительный стресс. Патологические состояния и заболевания. Новосибирск: АРТА, 2008. 284. 58. Ansar H, Mazloom Z, Kazemi F, Hejazi N. Effect of alpha-lipoic acid on blood glucose, insulin resistance and gluta-thione peroxidase of type 2 diabetic patients. Saudi. Med. J. 2011. 32. 6: 584—588. Saudi. Med. J. 2011, 6, 32: 584-588. 59. Porasuphatana S, Suddee S, Nartnampong A et al. Glycemic and oxidative status of patients with type 2 diabetes mellitus following oral administration of alpha-lipoic acid: a randomized double-blinded placebo-controlled study. Asia Pac. J. Clin. Nutr. 2012, 1, 21: 12-21. 60. Wang L, Wu CG, Fang CQ et al. The protective effect of α-Lipoic acid on mitochondria in the kidney of diabetic rats. Int. J. Clin. Exp. Med. 2013, 2, 6: 90-97. 61. Трахенберг Ю.А., Миленькая Т.М., Аметов А.С., Демидова Т.Ю. Изучение эффективности альфа-липоевой кислоты у пациентов с сахарным диабетом 2 типа и непролиферативной диабетической ретинопатией. Сахарный диабет. 2006, 3: 39—41. 62. Heinisch BB, Francesconi M, Mittermayer F et al. Alpha-lipoic acid improves vascular endothelial function in patients with type 2 diabetes: a placebo-controlled randomized trial. Eur. J. Clin. Invest. 2010, 2, 40: 148-154. 63. Haritoglou C, Gerss J, Hammes HP et al. Alpha-lipoic acid for the prevention of diabetic macular edema. Ophthalmologica. 2011, 3, 226: 127-137. 64. Недосугова Л.В. Альфа-липоевая кислота (Эспа-Липон) в комплексном лечении диабетической нейропатии. Международный эндокринологический журнал. 2007, 8, 2: 49-51. 65. Белова А.Н. Нейрореабилитация. М., 2003, 734. 66. Бреговский В.Б. Болевые формы диабетической полиневропатии нижних конечностей: современные представления и возможности лечения (обзор литературы). Боль. 2008, 1: 29-34. 67. Строков И.А., Баринов А.Н. Клиника, патогенез и лечение болевого синдрома при диабетической полиневропатии. Неврологический журнал. 2001, 6: 47-54. 68. Клиническое исследование Espalipon II. Дозировка 600 мг (№ исследования 616-14-94-002 02.05.1995). Источник:
Медицинский совет, № 5, 2015
Взаимодействие
Лекарство снижает эффективность цисплатина, усиливает эффект от применения оральных гипогликемических препаратов и инсулина.
Вещество нельзя смешивать в одной емкости с декстрозой, раствором Рингера, этанолом, и растворами, реагирующими в SH-группами и дисульфидными мостиками.
Средство усиливает эффект от приема карнитина.
Этанол и лекарства, содержащие этиловый спирт ослабляют эффект от приема кислоты.
Препараты, в которых содержится (Аналоги Тиоктовой Кислоты)
Совпадения по коду АТХ 4-го уровня:
Верона
Фибс
Гастрикумель
Фитогастрол
Тиреоидеа Композитум
Берлитион
Тиолепта
Желудочный сбор
Эспа-Липон
Пивные дрожжи
Липоевая кислота
Шиповника сироп
Октолипен
Тиоктацид
Тиогамма
Фигурин
Существует масса препаратов для перорального и инъекционного приема на основе Тиоктовой Кислоты.
Распространенные аналоги средства: Берлитион 300, Октолипен, Тиоктацид БВ, Тиолепта, Тиолипон, Липотиоксон, Тиоктовая кислота-Виал, Тиогамма, Эспа-Липон, Нейролипон и так далее.
В сочетании с кокарбоксилазой и рибофлавином вещество входит в состав препаратов Корилип-Нео и Корилип.
Многокомпонентные препараты: Турбослим, Био-Макс, Селмевит Интенсив, Компливит Триместрум (1 триместр , 2 триместр и 3 триместр).
Отзывы
Отзывы врачей об альфа-липоевой кислоте в основном положительные. Лекарство достаточно безопасно в применении, редко вызывает побочные реакции (при внутривенном применении больших доз), пациенты его хорошо переносят, часто средство назначают в рамках комплексного лечения в сочетании с прочими витаминами и препаратами.
Встречается масса отзывов о Тиоктовой Кислоте для похудения:
- “… Пропила курс препарата недавно. Соблюдала диету, занималась физическими упражнениями. Похудела, я всем очень довольна”;
- “… Мне еще в детстве эту кислоту назначал врач при лечении дискинезии, с тех пор проблем с желчным почти не было. Но иногда принимаю это вещество для профилактики. Отлично себя чувствую”;
- “… После курса всегда теряю пару килограмм, ощущается легкость такая в теле, больше не хочется есть жирное и сладкое”;
- “… Пропила полный курс, потратила деньги и время, ходила на шейпинг как обычно, но результата никого не увидела. Просто трата денег”;
- “… Хорошо, конечно, что лекарство недорогое и от него у меня не было побочных реакций, витамин все-таки. Но сказать, что я прямо похудела от него нельзя. Вес остался прежним”.
Купить Тиоктацид БВ таблетки покрытые оболочкой 600мг №30 в аптеках
Торговое название:
Тиоктацид ® БВ
МНН или группировочное название:
Тиоктовая кислота
Лекарственная форма:
Таблетки, покрытые пленочной оболочкой
Состав:
1 таблетка, покрытая пленочной оболочкой, содержит:
Активное вещество: тиоктовая кислота (α-липоевая кислота) – 600 мг Вспомогательные вещества: гипролоза низкозамещенная 157,00 мг, гипролоза 20,00 мг, магния стеарат 24,00 мг. Пленочная оболочка: гипромеллоза 15,80 мг, макрогол 6000 4,70 мг, титана диоксид 4,00 мг, тальк 2,02 мг, алюминиевый лак на основе красителя хинолиновый желтый 1,32 мг, алюминиевый лак на основе индигокармина 0,16 мг.
Описание:
двояковыпуклые продолговатые таблетки, покрытые пленочной оболочкой светло-зеленого цвета.
Фармакотерапевтическая группа:
Метаболическое средство.
Фармакологические свойства
Фармакодинамика
Тиоктовая кислота содержится в человеческом организме, где она выполня-ет функцию кофермента в реакциях окислительного фосфорилирования пировиноград-ной кислоты и альфа-кетокислот. Тиоктовая кислота является эндогенным антиоксидан-том, по биохимическому механизму действия она близка к витаминам группы В.
Тиоктовая кислота способствует защите клетки от токсического действия свободных ра-дикалов, возникающих в процессах обмена веществ; она также обезвреживает экзогенные токсичные соединения, проникшие в организм. Тиоктовая кислота повышает концентра-цию эндогенного антиоксиданта глютатиона, что приводит к уменьшению выраженности симптомов полинейропатии. Препарат оказывает гепатопротекторное, гиполипидемиче-ское, гипохолестеринемическое, гипогликемическое действие; улучшает трофику нейро-нов. Результатом синергического действия тиоктовой кислоты и инсулина является по-вышение утилизации глюкозы. Тиоктацид® БВ (быстрого высвобождения) представляет собой оптимизированную ле-карственную форму для перорального применения, которая позволяет избежать высокой вариабельности концентрации тиоктовой кислоты в плазме крови.
Фармакокинетика
При приеме препарата внутрь тиоктовая кислота быстро и полностью всасывается из же-лудочно-кишечного тракта. Прием препарата Тиоктацид® БВ одновременно с приемом пищи может снизить всасывание тиоктовой кислоты. Прием препарата согласно реко-мендациям за 30 мин до еды позволяет избежать нежелательного взаимодействия с пи-щей, т. к. всасывание тиоктовой кислоты на момент приема пищи уже завершено. Мак-симальная концентрация тиоктовой кислоты в плазме крови достигается через 30 минут после приема препарата и составляет 4 мкг/мл. Тиоктовая кислота обладает эффектом «первого прохождения» через печень. Абсолютная биодоступность тиоктовой кислоты составляет 20%. Основные пути метаболизма — окисление и конъюгация. Тиоктовая кис-лота и ее метаболиты выводятся почками (80-90%). Период полувыведения составляет 25 минут.
Показания к применению
Диабетическая и алкогольная полинейропатия.
Противопоказания
Повышенная чувствительность к тиоктовой кислоте или другим компонентам препа-рата.
Беременность, период грудного вскармливания (отсутствует достаточный опыт примене-ния препарата).
Клинические данные о применении Тиоктацида® 600 БВ у детей и подростков отсут-ствуют, в связи с этим детям и подросткам препарат назначать нельзя.
Способ применения и дозы
Препарат применяют внутрь. Рекомендуемая доза — 1 таблетка (600 мг) 1 раз в день. Пре-парат принимают натощак, за 30 минут до завтрака, не разжевывая, запивая водой.
В тяжелых случаях лечение начинают с назначения Тиоктацида® 600 Т раствора для внут-ривенного введения в течение 2-х – 4-х недель, затем пациента переводят на лечение Ти-октацидом® БВ.
Побочное действие
Частота развития побочных эффектов определена следующим образом:
Очень часто: > 1/10; Часто: 1/100; Нечасто: 1/1000; Редко: 1/10000; Очень редко:
Со стороны желудочно-кишечного тракта:
Часто – тошнота; очень редко – рвота, боль в области желудка и кишечника, диарея, изменение вкусовых ощущений.
Аллергические реакции: Очень редко – кожная сыпь, крапивница, зуд, анафилактический шок.
Со стороны нервной системы и органов чувств: Часто – головокружение.
Общего характера:
Очень редко – из-за улучшения утилизации глюкозы может снизиться уровень глюко-зы в крови и могут появиться симптомы гипогликемии (спутанность сознания, повы-шенное потоотделение, головная боль, расстройства зрения).
Передозировка
Симптомы:
В случае приема тиоктовой кислоты в дозах 10-40 г могут отмечаться серь-езные признаки интоксикации (генерализованные судорожные припадки; выраженные нарушения кислотно-щелочного баланса, ведущие к лактоацидозу; гипогликемическая кома; тяжелые нарушения свертываемости крови, приводящие иногда к фатальному ис-ходу).
При подозрении на существенную передозировку препарата (дозы, равнозначные более 10 таблеткам для взрослого или более 50 мг/кг массы тела для ребенка) необходима не-медленная госпитализация.
Лечение: симптоматическое, при необходимости — противосудорожная терапия, меры по поддержанию функций жизненно-важных органов.
Взаимодействие с другими лекарственными средствами
При одновременном назначении тиоктовой кислоты и цисплатина отмечается снижение эффективности цисплатина. Тиоктовая кислота связывает металлы, поэтому ее не следует назначать одновременно с препаратами, содержащими металлы (например, препараты железа, магния, кальция). Согласно рекомендуемому способу применения, таблетки Тио-ктацид® 600 БВ принимают за 30 минут до завтрака, тогда как препараты, содержащие металлы, следует принять в обед или вечером. По этой же причине в период лечения Ти-октацидом® 600 БВ рекомендуется употребление молочных продуктов только во второй половине дня.
При одновременном применении тиоктовой кислоты и инсулина или пероральных гипо-гликемических препаратов их действие может усиливаться, поэтому рекомендуется регу-лярный контроль уровня глюкозы в крови, особенно в начале терапии тиоктовой кисло-той. В отдельных случаях допустимо уменьшение дозы гипогликемических препаратов во избежание развития симптомов гипогликемии. Этанол и его метаболиты ослабляют действие тиоктовой кислоты.
Особые указания
Употребление алкоголя является фактором риска развития полинейропатии и может сни-зить эффективность Тиоктацида® БВ, поэтому пациентам следует воздерживаться от при-ема алкогольных напитков как во время лечения препаратом, так и в периоды вне лечения.
Лечение диабетической полинейропатии должно проводиться на фоне поддержания оп-тимальной концентрации глюкозы в крови.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 600 мг.
По 30, 60 или 100 таблеток во флакон коричневого стекла вместимостью 50.0, 75.0 или 125.0 мл соответственно с пластмассовой крышкой с контролем первого вскрытия.
По 1 флакону вместе с инструкцией по применению в картонную пачку.
Условия хранения
При температуре не выше 25° С, в недоступном для детей месте.
Срок годности
5 лет. Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.