Анна Солощенко, врач-кардиолог высшей категории Александровской больницы и автор блога «Ваш кардиолог», рассказала, что делать, если у ребенка поднялся уровень ацетона. А также составила список профилактических мер таких состояний.
Вы можете сразу перейти к информации специалиста, кликнув сюда, или углубиться в проблему всесторонне — переходите к теоретическо-практической части статьи.
Высокий ацетон у ребенка не является болезнью, напротив – это нормальный физиологический процесс обмена веществ, который заложен в организм как резервный вариант получения энергии. Однако, неправильное реагирование на ситуацию может иметь очень серьезные последствия. Чтобы понимать причины возникновения и правильный алгоритм действий при ацетоне у ребенка – дочитайте статью до конца. В материале доступным языком изложена теоретическая часть и даны конкретные практические рекомендации для решения проблемы.
Вся необходимая информация об ацетоне в организме:
- Что такое ацетон у детей
- Причины повышения ацетона
- Симптомы
- Как выявить ацетонемию?
- Группа риска
- Чем опасен ацетон у ребенка
- Как лечить ацетон у детей: основные принципы
- Как снизить ацетон у ребенка в домашних условиях
- Чем стоит кормить ребенка?
- Чего нельзя есть при ацетонемии?
- Профилактика ацетонемического синдрома
- Исчерпывающая информация по ацетону у детей от доктора Комаровского
Что такое ацетон у детей
Это временное или патологическое нарушение в обмене веществ, при котором появляется характерный запах изо рта и во время мочеиспускания (ацетонемия). Ацетон у ребенка не ограничивается неприятным запахом, содержание его в крови резко увеличивается до токсических показателей и приводит к отравлению организма в целом, вследствие интоксикации могут наблюдаться – приступы рвоты и боли в животе.
Главная опасность заключается в обезвоживании организма при приступах сильной рвоты, в это время ребенок теряет огромное количество жидкости и становиться невозможно восполнить запасы требуемой энергии и жидкости привычным способом. Получается замкнутый круг. Если ребенок отказывается от питья или сразу возникает рвотный рефлекс, необходимо немедленно вызывать скорую и быть готовым к госпитализации, в стационаре ребенку поставят капельницу для восполнения необходимых запасов энергии и жидкости.
Нужно понимать, что госпитализация в стационар и капельницы – это крайняя мера, есть более простые способы восстановить нормальный обмен веществ о которых мы расскажем ниже.
Вернуться к содержанию
Осложнения и последствия
Сахарный диабет первого типа часто возникает в детском возрасте и может осложняться эпизодами диабетического кетоацидоза – тяжелого состояния абсолютного или относительного дефицита инсулина, приводящего к гипергликемии, гиперацетонемии и системному воспалению. Возможные последствия и осложнения данного состояния у детей включают нарушение кислотно-щелочного гомеостаза: уровень кетонов возрастает и в моче (что определяется как кетонурия), а вместе с выведением их при мочеиспускании уменьшается уровень электролитов (ионов K и Na) в плазме. Также возможны отек головного мозга (около 1% случаев), острый ишемический или геморрагический инсульт, легочный интерстициальный отек и коагулопатии (из-за нарушения факторов свертывания крови). Кроме того, как при любом повышении кислотности крови, может страдать эндотелий кровеносных сосудов: перенасыщение крови кетоновыми телами усиливает негативное воздействие свободных радикалов на клетки и приводит к окислительному стрессу. Считается, что кетоны, точнее их повышенный уровень, имеют отношение к возникновению онколопатологий. При ацетонемическом синдроме существует вероятность увеличения печени и ее жировой инфильтрации, а при тяжелых ацетонемических кризах нельзя исключать риска коматозного состояния и летального исхода. [10], [11], [12]
Причины повышения ацетона
Доктор Комаровский о причинах появления ацетона у детей
Чтобы понять, от чего повышается ацетон в крови у ребенка, нужно изучить теоретическую часть. Ацетон – это распространенный медицинский жаргонизм, которым называются кетоновые тела (ацетоновые тела) – группа продуктов обмена веществ, образовавшиеся в печени, но только в случае недостатка глюкозы.
Глюкоза является основным источником энергии в организме ребенка (и взрослого человека). В случае резкого истощения всех запасов глюкозы (голодание организма, активные игры, занятия спортом, сильный стресс, высокая температура и т.д), организм начинает использовать запасенное на этот случай вещество для получения энергии – гликоген. Запас гликогена в организме взрослого человека достаточен на 1-2 суток нормального функционирования, примерно 500-700 г, а в организме ребенка запас гликогена очень низкий ~ 50-70 г, чего хватает на 1-2 часа.
В тот самый момент, когда организм израсходовал всю доступную ему глюкозу и гликоген, источником для получения энергии становится жир. Однако, при выработке энергии из жиров, синтезируется группа веществ под названием кетоновые тела:
- Пропанон (ацетон).
- Ацетоуксусная кислота (ацетоацетат).
- Бета-оксимасляная кислота (β-гидроксибутират).
Именно из-за вышеперечисленных 3‑х веществ и их высокой концентрации в организме, появляется запах ацетона изо рта и в моче у ребенка. При достижении критической
концентрации
в организме кетоновых тел наступает интоксикация, ацетон воздействует на рвотный центр в головном мозге.
При этом, как можно понять из теоретической части, такая реакция организма заложена на генетическом уровне и является физиологической нормой для получения энергии, так называемый план «Б», во время отсутствия глюкозы в организме.
Кетоновые тела также могут использоваться (расщепляться) организмом для получения энергии, но для этого необходимы определенные ферменты, которые находятся в достаточном количестве только у детей возрастом до 1 года, поэтому у грудничков не бывает ацетона. У детей от 1 года и взрослых необходимые ферменты также вырабатываются, но на 4-5 день после появления ацетона в крови, и симптомы интоксикации проходят сами по себе.
На практике причины ацетона у детей – это чаще всего:
- респираторные инфекции;
- высокая температура (часто);
- резкие эмоциональные перенапряжения, стресс;
- физическое истощение вследствие активных игр или физических нагрузок, но только при условии непривычных и больших нагрузках;
- сахарный диабет
; - неправильное питание (преобладание жирной пищи);
- недостаточное потребление жидкости, ацетон выводится из организма с мочеиспусканием, при малых дозах жидкости он не успевает вовремя выходить и концентрация растет.
Вернуться к содержанию
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
Часть 2. Начало статьи читайте в № 6, 2021 г.
Голодание
Голодание — это состояние организма, связанное с частичным или полным нарушением поступления пищи. В состоянии голодания резко снижаются источники энергии организма для важнейших структур организма. В условиях дефицита питательных веществ в организме образование энергии происходит за счет интенсификации глюкогенеза и синтеза кетоновых тел. Содержание глюкозы в крови уменьшается до нижних пределов нормы (3,5 ммоль/л) и на этом уровне поддерживается и в последующие периоды голодания. В печени при голодании глюкоза не в состоянии обеспечить должного количества оксалоацетата, поскольку ее просто нет в клетке. Поэтому при голодании жирные кислоты не «сгорают» в ЦТК, а превращаются в кетоновые тела.
Снижение запасов гликогена в печени сопровождается усиленным поступлением в нее свободных жирных кислот из адипоцитов. Концентрация жирных кислот в крови увеличивается в 3–4 раза по сравнению с постабсорбтивным состоянием. Уровень кетоновых тел в крови через неделю голодания повышается в 10–15 раз. В то же время дефицит углеводов тормозит окисление кетоновых тел, замедляя ресинтез их в высшие жирные кислоты [13].
Энергетические потребности мышц и большинства других органов удовлетворяются за счет жирных кислот и кетоновых тел. При низком уровне инсулина глюкоза в мышечные клетки не проникает, потребителями глюкозы являются инсулинонезависимые клетки и прежде всего клетки мозга, но и в этой ткани биоэнергетика частично обеспечивается кетоновыми телами. При такой концентрации ацетоуксусная кислота активно декарбоксилируется с образованием ацетона, который выводится с выдыхаемым воздухом и через кожу. Уже на 3–4 день изо рта и от кожи голодающего исходит запах ацетона.
Организм включает альтернативные способы выработки энергии — это глюконеогенез и синтез кетокислот, которые потребляются центральной нервной системой. При голодании повышается выброс глюкагона, который активирует липолиз в адипоцитах и окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль клетки, где опять превращается в оксалоацетат и используется в глюконеогенезе.
Глюконеогенез продолжается за счет распада тканевых белков. Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании. Пируват образуется в печени из лактата и аланина. Аланин и глутамин являются наиболее важными глюкогенными аминокислотами при голодании. Пируват и метаболиты ЦТК способны образовывать оксалоацетат и включаться в глюконеогенез.
При голодании подавляется использование ацетил-КоА в ЦТК, и он используется исключительно для синтеза оксиметилглутарил-КоА, что приводит к увеличению образования кетоновых тел. В этих условиях кетоновые тела являются альтернативным (глюкозе) энергетическим материалом для мозга и других тканей. 75% потребности мозга в энергии удовлетворяется за счет ацетил-КоА [4].
Если голодание продолжается дни, недели — включаются другие гомеостатические механизмы, которые обеспечивают сохранение белковой структуры организма, замедляя глюконеогенез и переключая мозг на утилизацию кетоновых молекул. Сигналом для использования кетонов служит повышение их концентрации в артериальной крови. При длительном голодании наблюдаются крайне низкие концентрации инсулина в крови. В этом случае интенсивный кетогенез представляет собой компенсаторно приспособительную реакцию.
Интенсивность обмена веществ в целом снижена: через неделю голодания потребление кислорода уменьшается примерно на 40%, происходят торможение окислительных процессов в митохондриях и угнетение окислительного фосфорилирования с образованием АТФ, т. е. развивается гипоэнергетическое состояние.
Накапливаясь в крови, кетоновые тела подавляют секрецию и активность глюкокортикоидов, тем самым препятствуя разрушению структурных белков организма и угнетая секрецию глюкагона [2]. Если в это время голодающему вводить аланин или другие гликогенные аминокислоты, уровень глюкозы в крови повышается, а концентрация кетоновых тел снижается.
При голодании кетоз опасности не представляет, так как не достигает степени кетоацидоза. Последний развивается при сопутствующих факторах — дегидратации, алкогольной интоксикации и других состояниях.
Алкогольная интоксикация
Гиперпродукция кетокислот и кетоацидоз после чрезмерного употребления спиртного частое наблюдаемое состояние. Катаболизм этилового спирта осуществляется главным образом в митохондриях печени. Здесь окисляется от 75% до 98% введенного в организм этанола. Окисление алкоголя — сложный биохимический процесс. Основную роль в метаболизме этанола играет никотинамидадениндинуклеотид (NAD). Этот фермент превращает этанол в токсический метаболит — ацетальдегид и восстановленный NADH, а последний соответствует синтезу ацетоацетата и β-оксибутирата.
Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD+ в клетке. Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегидоксидазы. В ходе реакции образуются уксусная кислота.
Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации оксалоацетата в митохондриях гепатоцитов, может «сгорать» в ЦТК или использоваться на синтез жирных кислот или кетоновых тел.
На начальных стадиях алкоголизма ацетил-КоА в ЦТК — основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот.
В период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идет на синтез кетоновых тел. Увеличение концентрации NADH по сравнению с NAD+ замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват. В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу. Повышение в крови содержания лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации [14].
Способствует усиленному кетогенезу при алкогольной интоксикации гипогликемические состояния, связанные с рвотой и голоданием. Известно также, что у таких пациентов уровень инсулина в крови снижен, тогда как содержание кортизола, гормона роста, глюкагона и адреналина повышено. Этанол тормозит глюконеогенез. Дегидратация в этих случаях способствует кетогенезу.
Кетоз при нарушении гормональной регуляции
На уровень глюкозы в крови влияет широкий спектр гормонов, при этом только инсулин вызывает гипогликемический эффект. Контринсулярным действием с повышением уровня глюкозы крови обладают все гормоны: глюкагон, адреналин, глюкокортикоиды, адренокортикотропный (АКТГ), соматотропный (СТГ), тиреотропный (ТТГ), тиреоидные.
Эффекты инсулина и контринсулярных гормонов в норме регулируют стабильный уровень глюкозы в крови. При низкой концентрации инсулина усиливаются гипергликемические эффекты других гормонов, таких как глюкагон, адреналин, глюкокортикоиды и гормон роста. Это происходит даже в том случае, если концентрация этих гормонов в крови не увеличивается.
Патогенез кетоза при избытке тироксина, глюкокортикоидов, соматотропина или/и других гормонов, в сущности, аналогичен уже рассмотренным механизмам гиперпродукции кетокислот вследствие избытка контринсулярных гормонов [6]. Известно, что в период усиленного роста, а также при гипертиреозе наступает значительное похудание.
Стресс
При стрессе активируется симпатическая нервная система и выброс контринсулярных гормонов, происходит истощение углеводных резервов организма, нарушается способность печени синтезировать и откладывать гликоген. Происходит избыточное поступление в печень неэтерифицированных жирных кислот. В результате повышенной продукции глюкокортикоидов идет распад белков и усиленное образование кетоновых тел из кетогенных аминокислот.
Гиперкортицизм
Ацетонемический синдром может быть первым клиническим проявлением гиперкортицизма, когда характерные признаки заболевания еще не сформировались.
Глюкокортикоиды способствуют усилению мобилизации нейтральных жиров из жировой ткани и тормозят липогенез. Но это действие в организме может перекрываться другими эффектами данных гормонов: способностью вызывать гипергликемию и стимулировать секрецию инсулина, накопление гликогена в печени, что приводит к торможению мобилизации жира и его отложению в жировой ткани; способностью в больших дозах задерживать жиромобилизующее и стимулирующее окисление жиров соматотропином.
Этим можно объяснить накопление жира в жировых депо при гиперкортицизме (болезни и синдроме Иценко–Кушинга). Кроме того, при этом состоянии увеличено образование дигидрокортизона, который стимулирует пентозный цикл и превращение углеводов в жиры. Кортикотропин, стимулируя секрецию глюкокортикоидов, может влиять на жировой обмен в том же направлении, но, помимо этого, обладает еще и экстраадреналовым жиромобилизующим действием [6].
Тиреотоксикоз
Избыток тиреоидных гормонов в крови может быть следствием заболеваний, проявляющихся гиперфункцией щитовидной железы. Тяжелым осложнением основного заболевания, сопровождающегося гиперфункцией щитовидной железы, является тиреотоксический криз, который представляет собой резкое обострение всех симптомов тиреотоксикоза. Чрезмерное поступление в кровь тироидных гормонов вызывает тяжелое токсическое поражение сердечно-сосудистой системы, печени, нервной системы и надпочечников. В клинической картине характерны резкое возбуждение (вплоть до психоза с бредом и галлюцинациями), которое затем сменяется адинамией, сонливостью, мышечной слабостью, апатией. Усиливаются диспепсические расстройства: жажда, тошнота, рвота, жидкий стул. Возможно увеличение печени. На этом фоне резко усиливаются процессы кетогенеза, что может спровоцировать симптомы ацетонемии.
Тироксин обладает жиромобилизующим эффектом. При гипертиреозе усилен обмен углеводов. Увеличена утилизация глюкозы тканями. Активируется фосфорилаза печени и мышц, следствием чего является усиление гликогенолиза и обеднение этих тканей гликогеном. Увеличивается активность гексокиназы и всасывание глюкозы в кишечнике, что может сопровождаться алиментарной гипергликемией. Активируется инсулиназа печени, что вместе с гипергликемией вызывает напряженное функционирование инсулярного аппарата и в случае его функциональной неполноценности может привести к развитию сахарного диабета. Усиление пентозного пути обмена углеводов способствует образованию НАДФ-Н2. В надпочечниках это вызывает повышение стероидогенеза и большее образование кортикостероидов [4].
Дефицит гормонов
Гипогликемия всегда встречается при пангипопитуитаризме — заболевании, характеризующемся снижением и выпадением функции передней доли гипофиза (секреции адренокортикотропина, пролактина, соматотропина, фоллитропина, лютропина, тиреотропина). В результате резко снижается функция периферических эндокринных желез. Однако гипогликемия встречается и при первичном поражении эндокринных органов (врожденная дисфункция коры надпочечников, болезнь Аддисона, гипотиреоз, гипофункция мозгового слоя надпочечников, дефиците глюкагона). При дефиците контринсулярных гормонов снижается скорость глюконеогенеза в печени (влияние на синтез ключевых ферментов), повышается утилизация глюкозы на периферии, снижается образование аминокислот в мышцах — субстрата для глюконеогенеза.
Дефицит глюкокортикоидов
Первичная надпочечниковая недостаточность является следствием уменьшения секреции гормонов коры надпочечников. Под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортицизма. Симптомы надпочечниковой недостаточности развиваются только после разрушения 90% объема ткани надпочечников.
Причины гипогликемии при надпочечниковой недостаточности схожи с причинами гипогликемии при гипопитуитаризме. Отличием является уровень возникновения блока — при гипопитуитаризме снижается секреция кортизола из-за дефицита АКТГ, а при надпочечниковой недостаточности из-за разрушения ткани самих надпочечников.
Гипогликемические состояния у больных с хронической надпочечниковой недостаточностью могут возникать как натощак, так и через 2–3 часа после приема пищи, богатой углеводами. Приступы сопровождаются слабостью, чувством голода, потливостью. Гипогликемия развивается в результате снижения секреции кортизола, уменьшения глюконеогенеза, запасов гликогена в печени.
Дефицит катехоламинов
Данное состояние может возникать при надпочечниковой недостаточности с поражением мозгового слоя надпочечников. Катехоламины, попадая в кровь, регулируют высвобождение и метаболизм инсулина, снижая его, а также увеличивают высвобождение глюкагона. При снижении секреции катехоламинов наблюдаются гипогликемические состояния, вызванные избыточной продукцией инсулина и пониженной активностью гликогенолиза.
Дефицит глюкагона
Глюкагон — гормон, являющийся физиологическим антагонистом инсулина. Он участвует в регуляции углеводного обмена, влияет на жировой обмен, активируя ферменты, расщепляющие жиры. Основное количество глюкагона синтезируется альфа-клетками островков поджелудочной железы. Однако установлено, что специальные клетки слизистой оболочки двенадцатиперстной кишки и слизистой оболочки желудка также синтезируют глюкагон. При поступлении в кровоток глюкагон вызывает повышение в крови концентрации глюкозы, вплоть до развития гипергликемии. В норме глюкагон предотвращает чрезмерное снижение концентрации глюкозы. Благодаря существованию глюкагона, препятствующего гипогликемическому действию инсулина, достигается тонкая регуляция обмена глюкозы в организме.
При дефиците вышеперечисленных гормонов содержание инсулина снижено, а экскреция кетоновых тел с мочой повышена [4].
Роль печени в нарушении энергетического обмена
Печень участвует в поддержании нормального уровня глюкозы в сыворотке крови путем гликогеногенеза, гликогенолиза и глюконеогенеза. В основе нарушений обмена углеводов при болезнях печени лежат повреждения митохондрий, которые ведут к снижению окислительного фосфорилирования. Вторично страдают функции печени. При тяжелом остром гепатите, как правило, отмечается гипогликемия, а при циррозах печени это наступает в конечной стадии — при печеночной недостаточности [15]. Гипогликемия объясняется снижением способности печени (из-за обширного поражения ее паренхимы) синтезировать гликоген и уменьшением выработки инсулиназы (фермента, разрушающего инсулин).
Дефицит углеводов приводит также к усилению анаэробного гликолиза, вследствие чего в клетках накапливаются кислые метаболиты, вызывающие снижение рН. При циррозе печени может повышаться и уровень лактата в сыворотке крови в связи со сниженной способностью печени утилизировать его для глюконеогенеза.
При заболеваниях печени увеличивается роль жиров в качестве источника энергии. В печени происходят синтез жирных кислот и их расщепление до ацетил-КоА, а также образование кетоновых тел, насыщение ненасыщенных жирных кислот и их включение в ресинтез нейтральных жиров и фосфолипидов. Катаболизм жирных кислот осуществляется путем β-окисления, основной реакцией которого является активирование жирной кислоты с участием кофермента ацетил-КоА и АТФ. Освобождающийся ацетил-КоА подвергается полному окислению в митохондриях, в результате чего клетки обеспечиваются энергией.
При ряде заболеваний печени снижается и синтез липопротеидов, что ведет к накоплению триацилглицеридов с последующей инфильтрацией и жировой дистрофией печени. Причинами возникновения этого состояния, в частности, является недостаток в пище липотропных веществ (холина — составной части лецитина, метионина). Увеличивается образование кетоновых тел [4].
Итак, клиническая картина вторичного ацетонемического синдрома включает в себя непосредственно явления кетоза, признаки основного заболевания, на фоне которого развился кетоз, а также проявления того состояния, которое запустило патологический процесс (стресс, чрезмерная физическая нагрузка, инфекция и т. д.).
Ацетонемическая циклическая рвота
В практике приходится сталкиваться с идиопатической ацетонемической рвотой, которая протекает с кетоацидозом (ацетонемическая рвота, недиабетический кетоацидоз). В англоязычной литературе она входит в синдром идиопатической циклической рвоты [16, 17].
Патогенез ацетонемической рвоты полностью не выяснен. Предполагается, что у детей после перенесенных инфекционных заболеваний, травм черепа, органических заболеваний центральной нервной системы в течение длительного времени в гипоталамо-диэнцефальной области остается доминантный очаг застойного возбуждения, индуцирующий нарушения жирового обмена (усиление кетогенеза, нарушение нормального использования кетоновых тел в связи с истощением углеводных запасов в организме). В патогенезе ацетонемической рвоты могут иметь значение аномалии конституции, относительная несостоятельность энзимных систем печени, нарушения эндокринной регуляции метаболизма.
Перспективными являются представления о синдроме циклической рвоты как о митохондриальной патологии [18, 19]. Поскольку митохондрии являются, образно выражаясь, энергетическими станциями клетки, при данном заболевании нарушается энергетический обмен. В условиях стресса и гипоксии энергетический обмен нарушается с преобладанием более быстрого анаэробного гликолиза, но при этом образуется только 2 молекулы АТФ, тогда как при аэробном — 38 [5]. Возникает дефицит энергии.
Такие нарушения тесно связаны с нарушениями пуринового обмена, поскольку энергия в организме хранится в виде нуклеотидов, среди которых аденин и гуанин являются пуриновыми, и они метаболизируются до мочевой кислоты, а тимин, цитозин и урацил являются пиримидиновыми и метаболизируются с образованием кетоновых тел, аммиака и β-изомасляной кислоты. Данные представления патогенетически сближают синдром циклической рвоты и синдром ацетонемической рвоты, а также объясняют необходимость и возможные пути метаболической коррекции.
Другие считают, что причиной резкого повышения кетоновых тел может быть недостаточное потребление детьми углеводов при избытке жиров и кетогенных аминокислот.
Кризы могут возникать внезапно с промежутками в несколько недель или месяцев. Провоцирующими факторами могут быть: нарушение диеты (жареные и печеные продукты), лихорадка, отказ от еды, физические и психические перегрузки.
Предвестниками синдрома циклической рвоты является анорексия, вялость или повышение возбудимости, тошнота, головные боли, абдоминальные боли, запах ацетона изо рта.
Затем появляется многократная или неукротимая рвота, которая может продолжаться от одного до пяти дней. Схваткообразные боли в животе усиливаются. Во время криза больной становится сонливым. В результате рвоты могут развиваться гемодинамические нарушения: тахикардия, мягкий пульс, приглушенность сердечных тонов, гипотония.
Печень умеренно увеличена. В некоторых случаях повышается температура. В выдыхаемом воздухе и рвотных массах ощущается запах прелых яблок. В моче высокая концентрация кетоновых тел. Приступы могут ликвидироваться спонтанно, без лечения.
Избыток кетоновых тел оказывает наркотическое действие на центральную нервную систему, что клинически проявляется вялостью, заторможенностью.
В биохимическом анализе крови обнаруживают нарушение липидного обмена (гиперхолестеринемию), тенденцию к гипогликемии, гиперкетонемию. В общем анализе крови: умеренный лейкоцитоз, нейтрофилез, ускоренная СОЭ.
В моче и выдыхаемом воздухе обнаруживается ацетон, в крови — повышенная концентрация кетоновых тел. На электроэнцефалограмме выявляются различные отклонения, не исчезающие полностью после прекращения приступа.
Этот синдром чаще встречается в дошкольном возрасте и сопровождается приступами многократной рвоты и кетонемии. У таких больных нередко выявляют повышенную возбудимость, мочекислую нефропатию, сахарный диабет, ожирение.
Кетоз при длительной рвоте, недоедании или голодании представляет классический компенсаторный процесс, призванный восполнить энергетический дефицит, точнее, недостаток углеводов, за счет альтернативных энергосубстратов кетокислот.
Диагноз синдрома ацетонемической рвоты можно подтвердить только после исключения других заболеваний, сопровождающихся рвотой: аппендицита и перитонита, энцефалитов, менингитов, начала отека головного мозга, отравления, токсикоза и инфекционных заболеваний и др. Но в первую очередь диабетического кетоацидоза.
Ацетонемические кризы у большинства детей прекращаются после 10–12 лет, но сохраняется большая вероятность развития таких патологических состояний, как подагрические кризы, вегетососудистые дистонии по гипертоническому типу, артериальная гипертензия.
Транзиторный кетоз у детей и подростков может выявляться при лихорадке, стрессах, инфекционных заболеваниях, голодании (во время болезни), употреблении богатой жирами пищи, напряженной физической активности. В этих случаях содержания кетоновых тел в моче не более 2+.
Лечение
Лечение и профилактика гиперкетонемии зависят от причины ее возникновения, но во всех случаях направлены на улучшение функции печени и нормализацию энергетического обмена. Это достигается ограничением содержания жира в пищевом рационе, назначением липотропных средств (метионина и др.), витаминов группы В, при необходимости — инсулина, кокарбоксилазы.
В период приступа синдрома циклической ацетонемической рвоты выраженная дегидратация, гиповолемия, метаболический ацидоз и электролитные нарушения — это основные факторы, которые определяют тяжесть состояния. Необходимо в первую очередь ликвидировать ацидоз: назначить промывание желудка и кишечника 1–2% раствором бикарбоната натрия. Антикетогенными свойствами обладает 5–10% раствор глюкозы, с добавлением необходимого количества инсулина, а также раствор Рингера [20].
Если питье не провоцирует рвоту, рекомендуется подслащенный чай, Регидрон, Оралит — частыми и небольшими объемами. После улучшения состояния и появления возможности приема жидкости назначается кормление ребенка. Диета должна содержать легкоусвояемые углеводы и ограниченное количество жиров (манная, овсяная, гречневая каши; картофельное пюре, печеные яблоки, сухари, сухое печенье).
Итак, выяснение механизмов развития кетонемического синдрома, выделение наиболее вероятных причин формирования кетоза дают возможность установить генез заболевания, а тем самым нормализовать состояние больного и предупреждать рецидивы кетонемии.
Литература
- Березов Т. Т., Коровкин Б. Ф. Биологическая химия. Учебник. 3-е изд. М.: Медицина, 2004. 704 с.
- Stryer, Lubert. Biochemistry (Fourth ed.). New York: W. H. Freeman and Company, 1995. P. 510–515, 581–613, 775–778.
- Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Пер. с англ. М.: Мир, 1993. Т. I. 381 с.
- Зайчик А. Ш., Чурилов Л. П. Основы патохимии. СПб: Элби-СПб, 2000. 687 с.
- Эндокринология и метаболизм. В 2 т. / Под ред. Фелинга Ф. и соавт. Пер. с англ. Кандрора В. И., Старковой Н. Т. М.: Медицина,1985. Т. 2. 416 с.
- Эндокринология: национальное руководство / Под ред. Дедова И. И., Мельниченко Г. А. М.: ГЭОТАР-Медиа, 2008.
- Лечение диабетической комы у детей. Методические рекомендации. М., 2006. 14 с.
- Brown L. M., Corrado M. M., van der Ende R. M. et al. Evaluation of glycogen storage disease as a cause of ketotic hypoglycemia in children // J Inherit Metab Dis. 2015, May; 38 (3): 489–493.
- Чибирас П. П. Гипогликемическая кетонемия как причина нейротоксикоза у детей // Вопросы охраны материнства и детства. 1982. № 2. С. 30–33.
- Генес С. Г. Гипогликемии. Гипогликемический симптомокомплекс. М.: Медицина, 1970. 236 с.
- Кроненберг Г. М. и соавт. Ожирение и нарушение липидного обмена. Пер. с англ. под ред. И. И. Дедова, Г. А. Мельниченко. М.: ООО «Рид Элсивер», 2010. 264 с.
- Лукьянчиков В. С. Кетоз и кетоацидоз. Патохимический и клинический аспект // РМЖ, 2004, т. 12, № 23, с. 1301.
- Масловская А. А. Механизм развития кетоза при сахарном диабете и голодании // Журнал Гродненского государственного медицинского университета. 2012, № 3 (39), 8–10.
- Неотложная медицинская помощь. Пер. с англ. / Под ред. Дж. Э. Тинтиналли, Р. Л. Кроума, Э. Руиза. М.: Медицина, 2001. 1000 c.
- Рябчук Ф. Н., Пирогова З. И. Коэнзимное ацетилирование и уровень свободных жирных кислот крови у детей с ацетонемией и билиарной недостаточностью // Лечащий Врач. 2012, № 8, с. 42–46.
- Li BUK: Cyclic vomiting: new understanding of an old disorder // Contemporary Ped. 1996, 13 (7): 48–62.
- Krakowczyk H., Machura E., Rusek-Zychma M., Chrobak E., Ziora K. Assessment of the natural history and clinical presentation of acetonemic vomiting. 2014, 71 (6): 323–327.
- Boles R. et al. Cyclic vomiting syndrome and mitochondrial DNA mutations // Lancet. 1997, 350: 1299–1300.
- Salpietro C. D., Briuglia S., Merlino M. V. et al. A mitochondrial DNA mutation (A3243 G mtDNA) in a family with cyclic vomiting // Am. J. Pediatr. 2003. 162. 727–728.
- Марушко Ю. В., Шев Г. Г., Полковниченко Л. Н., Мошкина Т. В. Терапевтические подходы при ацетонемическом синдроме у детей // Здоровье ребенка. 2012, № 1, с. 61–65.
В. В. Смирнов1, доктор медицинских наук, профессор А. В. Симаков
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
1 Контактная информация
Симптомы
К симптомам высокой концентрации ацетона в организме могут относиться:
- слабость, вялое, угнетенное состояние;
- отсутствие аппетита, отказ от приема пищи;
- характерный запах ацетона изо рта и при мочеиспускании;
- рвота с характерным запахом.
Высокая температура может являться следствием респираторного заболевания или воспаления и причиной повышения уровня кетоновых тел, но это не обязательный симптом.
Вернуться к содержанию
Что нельзя есть при ацетономии
Чтобы предупредить ухудшение общего состояния и не спровоцировать повторное повышение уровня ацетона, из диеты следует исключить:
- Жирные бульоны на кости или мясе (в том числе из птицы или рыбы)
- Жирные сорта мяса
- Субпродукты (печень, почки и пр.)
- Копчения
- Раки и некоторые сорта рыбы
- Жирный творог и сметану
- Некоторые виды овощей
Для получения развернутой консультации по режиму питания и создания сбалансированного рациона для ребенка с ацетонемией – запишитесь на консультацию к нашим опытным педиатрам.
Нужна консультация?
Записаться
Форма обратного вызова
Заявка отправлена, мы свяжемся с вами скоро
Как выявить ацетонемию?
В подавляющем большинстве случаев ацетонемия выявляется с помощью обоняния родителя. Если у ребенка ацетон, запах при дыхании достаточно резкий и его сложно с чем-то спутать.
В случае выявления кетоновых тел, на будущее, можно купить в аптеке специальные тесты, которые помогут определить ацетон в моче у детей. Принцип достаточно простой, ребенок должен сходить по малой нужде в чистый сосуд, и далее в мочу помещается тест-полоска, которая даст положительный результат при наличии ацетона, а также показывает примерную количественную концентрацию ацетона в организме.
При наличии запаха изо рта никакие тесты не нужны, вывод уже однозначный – ацетон есть и его количество в организме увеличивается, нужно принимать меры.
Вернуться к содержанию
Что делать?
Не паниковать! Ответственность за состояние ребёнка лежит только на вас!
Итак, ребёнок перенервничал, голоден, у него появился запах ацетона изо рта – напоите его сладким питьём, дайте сладости. Лучше всего кока-колу, потому что в этом напитке много сахара и ребёнок выпьет её с огромным удовольствием. Также в эту категорию относятся различные сладкие лимонады и газировки.
Не сажайте ребёнка на диету, особенно на голодную, тем более, где нет сладкого. Этим можно усугубить ситуацию. Не ограничивайте ребёнка в сладком! Необходимо следить за тем, чтобы расстояния между приёмами пищи у ребёнка были не менее 4 часов.
Также важно помнить, что стрессы в состоянии ацетонимии противопоказаны, точно, как и резкое повышение физических нагрузок. С собой всегда нужно носить 40% глюкозу и конфету.
Если же вы сомневаетесь в том, что у ребёнка ацетон, купите специальные тест-полоски для его определения в моче. Это бумажные полоски с реагентом, который меняет цвет в зависимости от содержания ацетона в моче.
Если же состояние ребёнка более тяжёлое, то необходимо начать отпаивать сладким питьём, солевые растворы в данном случае помогут только от обезвоживания, но не повлияют на самочувствие. А вот давать солевой раствор параллельно со сладким можно.
Иногда бывает такое, что при сильной рвоте дать ребёнку сладкое питьё невозможно. В этом случае глюкозу вводят внутривенно или делают укол противорвотного средства и пока он действует, это где-то 2-3 часа, нужно дать ребёнку выпить как можно больше сладкой жидкости.
Если состояние не улучшается, рвота не прекращается, появляются признаки обезвоживания – вызывайте скорую, так как в этом случае нужна инфузионная терапия. Как только ацетонемический кризис миновал, о нём нужно просто забыть. Не мучать ребёнка диетами, не искать причины, а просто жить и не запрещать ребёнку сладкого, потому что в 100% случаев дети перерастают это состояние.
Главное знать, как оказать первую помощь и не пугать ребёнка госпитализацией. Конечно, бывают ситуации, когда стационара не избежать, например, когда интоксикация и обезвоживание организма слишком сильные, тогда ввод глюкозы через вену неизбежен, но такие состояния очень редки и чаще всего удаётся справиться дома самим.
Стоит помнить, что данное состояние может развиться и у абсолютно здорового ребёнка, а также ацетономический синдром без других признаков чаще всего не означает наличие диабета. Но если ацетон появляется у ребёнка часто без причины и сопровождается резким похудением, ребёнок часто мочится и постоянно хочет пить, то стоит провериться на диабет 1 типа.
Готовим солевой раствор от обезвоживания
Метод лечения, направленный на поступление в организм жидкости, называется регидратационная терапия. Регидратация — это, собственно, и есть восполнение потерь жидкости. Существуют два главных способа регидратации — внутривенный, когда необходимые растворы вводят в вену посредством капельницы, и пероральный — когда необходимые растворы человек получает через рот.
Что это такое? Иногда — готовый раствор, но обычно это порошок, или таблетка, или гранулы, в состав которых входят необходимые организму натрий, калий, хлор и другие вещества в специально подобранных сочетаниях и концентрациях, эквивалентных патологическим потерям. Объясняю: потливость — это потеря не только жидкости, но и натрия, и хлора (пот ведь соленый, а школьную формулу NaCl — все помнят наверняка). Если восполнять потери жидкости, но не восполнять потери солей — это чревато серьезными проблемами. А сколько все-таки надо соли? Вот умные ученые и рассчитали оптимальное количество солей на определенный объем воды.
На этих расчетах и построены формулы регидратирующих средств. Помимо солей в состав препаратов часто входит глюкоза, иногда добавляются экстракты лекарственных растений (экстракт ромашки, например), отвары злаков (риса, пшеницы и др.).
Регидратирующие средства для перорального приема — идеальный вариант быстрого и эффективного восполнения физиологических и патологических потерь жидкости.
Именно поэтому регидратирующие средства для перорального приема являются безрецептурными лекарственными препаратами.
Именно поэтому регидратирующие средства для перорального приема должны быть обязательным компонентом домашней аптечки.
Группа риска
Наиболее подвержены ацетонемии дети от 1 до 7 лет. Если хотя бы раз в жизни вы ощущали запах ацетона от ребенка, то это может повторяться в будущем. Как правило, в подавляющем большинстве случаев это проходит после 7 лет. Если проблемы с ацетоном есть после 7 – необходимо медицинское обследование.
В редких случаях ацетон может быть симптомом сахарного диабета, при условии неправильного лечения.
Нет определенной группы риска у детей, кроме возрастной категории, все зависит от физиологических особенностей каждого организма. У одного ребенка может быть большое содержание ацетона, при этом он быстро выводится с мочой и не успевает накапливаться в критических концентрациях. У другого ребенка, момент от начала запаха до рвоты может быть очень непродолжительный, что и представляет опасность.
Вернуться к содержанию
Календарь событий:
- 19Ноя
Всероссийская конференция «Жизнь с сахарным диабетом от 0 до 100» дата окончания: 20 Ноября 2021 Место проведения: ОнлайнЧитайте также: Мне очень тяжело жить
- 30Ноя
Интеграционный саммит «Научные центры мирового уровня (НЦМУ) в сфере здравоохранения» дата окончания: 30 Ноября 2021 Место проведения: Москва, конгресс-центр Первого МГМУ им. И.М. Сеченова, ул. Трубецкая 8 - 30Ноя
Третья ежегодная конференция «Что происходит на рынке БАД?» дата окончания: 30 Ноября 2021 Место проведения: Москва, Hilton Moscow Leningradskaya/онлайн - 02Дек
Конгресс по молекулярной иммунологии и аллергологии IMAC 2021 дата окончания: 03 Ноября 2021 Место проведения: Москва/онлайн
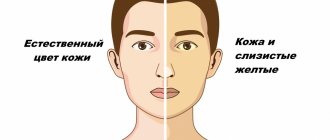
Чем опасен ацетон у ребенка
Важно не допустить появления кетонов (ацетона) в высокой концентрации! В случае накопления в организме кетоновых тел в критической концентрации, они начинают действовать на рвотный центр и центр аппетита в головном мозге, ребенок отказывается от еды, а при попытке приема жидкости мгновенно возникает рвота.
Детский ацетон не несет прямой угрозы здоровью и жизни, но последствия, в виде обезвоживания при постоянной рвоте и невозможность принимать жидкость внутрь – смертельно опасны для организма
!
В случае невозможности напоить ребенка водой и наличие непрекращающейся рвоты – стационар и капельницы.
Вернуться к содержанию
Запах ацетона как симптом заболеваний
Бывает, что ацетонемическая патология возникает внезапно, а может указывать на серьезную болезнь.
Читайте также: Грудничок отказывается от смеси
- Сахарный диабет;
- Аномалии щитовидной железы;
- Инфекционные заболевания;
- Неправильная работа печени или почек;
У детей в дошкольном возрасте этот синдром появляется особенно часто. Появляются приступы рвоты, болезненное состояние, потеря аппетита, сонливость, вялость. Повышается риск обезвоживания. Для первой помощи необходима глюкоза, которая восстанавливает энергетический баланс. Родителям нужно срочно обратиться к врачу.
При диабете в крови появляется глюкоза с избытком. Из-за инсулиновой недостаточности она не проникает в клетки, вызывая сильное нарушение в процессе обмена углеводов. Аномалии возникают по причине гиперфункции щитовидной железы, так как она вырабатывает чрезмерно много гормонов. При патологиях почек и печени очищающая функция частично блокируется, вредные вещества накапливаются, появляется ацетатный запах.
Как лечить ацетон у детей: основные принципы
Лечение ацетона у детей состоит не
в его нейтрализации, а в устранении причины интенсивного образования кетоновых тел!
Ребенку нужно дать глюкозу (сладости, глюкозосодержащие напитки)
. Этим вы восстановите нормальный процесс получения энергии из глюкозы, тем самым остановив расщепление жиров и образование новых молекул ацетона.
Если организм отказывается воспринимать сладкое и напитки, необходимо ставить капельницу с глюкозой для восполнения обычного обмена веществ и жидкости.
Основной принцип – вовремя сладкое – вылечивает ацетон у ребенка!
Вернуться к содержанию
Причины ацетона в крови
По причине развития выделяют первичный и вторичный ацетонемический синдром. Первичный часто развивается у детей с генетической особенностью обмена веществ, предрасположенных к нарушению обмена пуринов. Провоцирующим фактором развития первичного АС есть нарушение диеты. Согласно рекомендациям Medscape, самыми частыми продуктами-триггерами являются:
- Шоколад
- Желтый сыр
- Пищевая добавка глутамат натрия (Е 621)
Вторичный ацетонемический синдром возникает на фоне различных заболеваний:
- вирусных и бактериальных инфекций
- при повышении температуры
- на фоне другой рвоты
- в послеоперационный период и после травм
- после перенесенного стресса
- при чрезмерной физической активности
- на фоне голодания (что тоже можно отнести к нарушению диеты и режима питания)
Как снизить ацетон у ребенка в домашних условиях
Что делать при ацетоне дома? Все механизмы для этого есть в организме, не нужно ничего изобретать. Необходимо дать ребенку глюкозу для восстановления нормального обмена веществ и обильное питье для скорейшего выведения ацетоновых тел из организма.
Теоретически, щелочная вода может нейтрализовать ацетон на химическом уровне, но медицински это не доказано как эффективное средство при ацетонемии. Гораздо эффективнее будут действовать сладкие компоты, сладкий чай, вода с медом или сахаром и напитки с высоким содержанием глюкозы (Coca-cola, Pepsi, Fanta и т.д.).
Чем стоит кормить ребенка?
Доктор Комаровский – чем стоит поить ребенка при ацетонемии
Если ацетон уже проявил себя, то о том, чтобы накормить ребенка силой, не стоит даже думать. Чтобы переварить пищу, организму требуется энергия, а значит будут расщепляться жиры и будет образовываться ацетоновые тела в еще больших количествах. Ребенка сперва нужно напоить напитками, сладкой водой или в идеале концентрированным раствором глюкозы, который можно купить в любой аптеке.
Если получилось дать глюкозосодержащую жидкость – хорошо, через время можно начать давать фрукты. Идеально – изюм, свежий виноград, курага, чернослив, персики, бананы, яблоки, обязательно сладости – конфеты, шоколад, варенье и т.д. Если есть улучшения – каши и любые продукты с высоким содержанием углеводов. Это и есть диета при ацетоне у детей.
Вернуться к содержанию
Факторы риска
Отмечают такие факторы риска появления ацетонового запаха, как инфекционные заболевания со значительным повышением температуры, персистирующие инфекции, глистная инвазия, стрессовые состояния. В младшем возрасте фактором риска также является недостаточное питание детей с отсутствием необходимого количества углеводов. Кетоз может быть спровоцирован и употреблением большого количества жиров, а также физическими перегрузками. Следует иметь в виду, что триггером развития аутоиммунного сахарного диабета у детей может стать частое применение кортикостероидов (негативно влияющих на кору надпочечников) и противовирусных средств, содержащих рекомбинантный интерферон альфа-2b. [5], [6], [7]
О профилактике
У ребенка стресс – сладкое, активные игры – сладкое, физические нагрузки – сладкое, простуда – сладкое, высокая температура – сладкое. Важно не закармливать сладостями, что может привести к ожирению, а именно – не дать израсходовать всю глюкозу и очень небольшие объемы гликогена, если это произойдет – неизбежно запускается процесс синтеза ацетоновых тел (выработка ацетона).
Если первое проявление ацетона у ребенка произошло в возрасте после 4-х лет или периодически продолжается после 7 лет – это повод для углубленного медицинского обследования, так быть не должно!
Диагностика синдрома
Для постановки правильного диагноза важное значение имеют данные анамнеза, жалобы больного, клинические проявления и результаты дополнительного обследования.
Лабораторные исследования включают в себя биохимический анализ крови и общий анализ мочи. Заметьте, что норма ацетона у детей, не страдающих данным заболеванием, не превышает 0,01 грамма.
Инструментальная диагностика – это эхокардиоскопия, с помощью которой можно увидеть показатели центральной гемодинамики. Для ацетонемического синдрома характерно снижение диастолического объема левого желудочка и уменьшение венозного давления. На этом фоне сердечный индекс увеличен из-за тахикардии.
В последнее время провести анализ мочи на ацетон можно даже в домашних условиях. С этой целью используются специальные индикаторные тест-полоски.
На нашем сайте вы сможете ознакомиться с квалификацией специалистов, консультирующих по данному вопросу, и узнать, как проверить уровень ацетона у детей.