Опубликовано: 17.06.2021 12:50:00 Обновлено: 17.06.2021
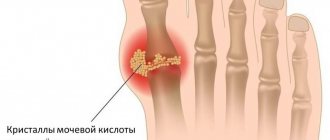
Подагра – системное заболевание, характеризующееся нарушением обмена пуринов в организме и отложением кристаллов урата в суставах. Основным проявлением расстройства считаются повторяющиеся приступы артрита с интенсивной болью в суставах и возникновением тофусов – подагрических узелков. Также при этом заболевании возможно накопление солей в почках с развитием мочекаменной болезни и почечной недостаточности.
Распространенность заболевания среди взрослого населения в Европе составляет от 0,9 до 2,5%, а в США достигает 3,9%. Наиболее часто подагру выявляют у мужчин старше 40 лет. Среди женщин патология встречается в 6-7 раз реже.
Классификация
По этиологии выделяют 2 основных вида гиперурикемии:
- Первичный
– возникает вследствие генетически детерминированного дефекта ферментов, участвующих в метаболизме мочевой кислоты. - Вторичный
– развивается на фоне некоторых заболеваний, действия токсинов, лекарственных препаратов и т.д.
По патогенезу различают 3 типа гиперурикемии:
- Метаболический (гиперпродуктивный
) – связан с усилением образования мочевой кислоты. - Почечный (гипоэкскреторный
) – обусловлен замедлением выделения мочевой кислоты из организма с мочой. - Смешанный.
По клиническим проявлениям выделяют:
- бессимптомную гиперурикемию;
- острый/интермиттирующий артрит;
- межприступный период;
- хроническую тофусную подагру.
Лечение подагры
Основной принцип лечения заболевания – уменьшение гиперурикемии. Этому способствуют изменение образа жизни пациента и пересмотр рациона питания. Рекомендуются коррекция гиперлипидемии, артериальной гипертензии, гипергликемии, снижение веса и отказ от курения. Диета при подагре предполагает исключение продуктов, богатых пуринами или задерживающих их в организме:
- сладких газированных напитков;
- морепродуктов;
- мяса;
- пряной, острой и копченой пищи;
- шоколада, мороженого;
- соленых сыров;
- кофеина, какао, крепкого чая;
- алкоголя.
Эндогенные пурины повышаются при употреблении большого количества белка животного происхождения, поэтому его суточной нормой для больного подагрой считается не более 1,5 г на 1 кг веса тела пациента. Молочные же продукты с невысокой жирностью, такие как кефир, творог, простокваша, способствуют выведению мочевой кислоты из организма. Сходным действием обладают полиненасыщенные жирные кислоты, например, в составе оливкового масла. Также при подагре необходимо соблюдать питьевой режим – не менее 2,5 литров воды в сутки.
Медикаментозное лечение подагры желательно начинать в первые сутки возникновения острого артрита. Для купирования приступа местно или системно используют нестероидные противовоспалительные средства, колхицин и глюкокортикостероидные препараты. Гипоурикемическая терапия назначается после лабораторного и инструментального подтверждения диагноза. Она направлена на:
- снижение мочевой кислоты до целевого уровня – 0,36 ммоль/л;
- уменьшение очагов накопления уратов в организме;
- снижение размеров тофусов;
- сокращение частоты приступов подагрического артрита.
Препаратом выбора для этого считается Аллопуринол. При его непереносимости возможно применение селективного ингибитора ксантиноксидазы – фебуксостата. Умеренное урикозурическое действие оказывают также Лозартан, Амлодипин и Фенофибрат. Диуретики используются с большой осторожностью, только по жизненным показаниям. Хирургическое удаление тофусов проводится лишь при появлении тяжелых осложнений, например, туннельного синдрома, спинномозговой компрессии.
Причины
Физиологические причины
У здоровых людей может встречаться кратковременное или незначительное повышение концентрации мочевой кислоты (МК) без каких-либо клинических симптомов. Наиболее часто гиперурикемия наблюдается при употреблении мясной пищи, так как мясные продукты богаты пуриновыми основаниями (аденин, гуанин), которые являются субстратом для синтеза МК. Также гиперурикемия встречается при обезвоживании, интенсивной физической нагрузке, приеме алкоголя.
Подагра
Данное ревматологическое заболевание можно считать клинической манифестацией гиперурикемии. Подагра развивается вследствие генетически обусловленного дефекта ферментов, регулирующих обмен МК. К таким дефектам относятся дефицит гипоксантин-гуанинфосфорибозилтрансферазы, повышение активности 5-фосфорибозил-1-синтетазы. Нарушение функциональной активности этих ферментов приводит к усилению синтеза МК.
В периферических тканях, особенно в суставных сумках, хрящах, происходит кристаллизация солей мочевой кислоты и их отложение. В результате появляются следующие симптомы: острая, интенсивная боль в суставах (чаще в I плюснефаланговом суставе), припухлость сустава с покраснением кожных покровов. Достаточно специфичным симптомом подагры считается образование узелков – тофусов, локализующихся в основном на ушных раковинах, задней поверхности локтевых суставов. Также подагра может развиться на фоне заболеваний, влияющих на пуриновый метаболизм.
Гиперурикемия
Гиперпродукция мочевой кислоты
При интенсивном разрушении клеток и их ядер происходит высвобождение нуклеотидов, из которых в последующем образуется большое количество МК, что приводит к возрастанию уровня МК. Наличие клинических симптомов возникшей гиперурикемии определяется степенью разрушения тканей. Усиленный катаболизм наблюдается при следующих заболеваниях и патологических состояниях:
- Миелопролиферативные и лимфопролиферативные заболевания (лейкозы, лимфомы).
- Синдром лизиса опухоли после курсов химиотерапии.
- Врожденные и приобретенные гемолитические анемии.
- Тяжелый генерализованный псориаз.
- Болезни накопления: болезнь Гоше, гликогенозы.
Медленное выведение мочевой кислоты
Примерно 2/3 от общего количества МК выводится с мочой. Поэтому любое нарушение выделительной функции почек вследствие их органического поражения может привести к гиперурикемии. То же нередко происходит при снижении эффективного объема крови, из-за чего нарушается кровоснабжение почек. Ниже приведены основные причины подавления клиренса МК:
- Гломерулонефрит.
- Интерстициальный нефрит.
- Хроническая почечная недостаточность.
- Массивное кровотечение.
- Застойная сердечная недостаточность.
- Отравление свинцом (свинцовая нефропатия).
- Прием тиазидных диуретиков.
Другие причины
- Эндокринные расстройства: гипопаратиреоз, гипотиреоз.
- Диабетический кетоацидоз.
- Лактатацидоз.
- Преэклампсия.
- Саркоидоз.
- Прием лекарственных препаратов: ацетилсалициловая кислота, цитотоксические препараты (циклоспорин, микофенолат натрия), противотуберкулезные ЛС (этамбутол, пиразинамид), никотиновая кислота.
Диагностика
При обнаружении гиперурикемии необходимо обратиться к врачу-терапевту для выяснения причины ее возникновения. На приеме уточняется наличие симптомов, характерных для данного состояния. Внимательно осматриваются беспокоящие больного суставы на предмет отека или покраснения. Выясняется, имеются ли у пациента какие-либо хронические заболевания, состоит ли он на диспансерном учете, какие лекарственные средства принимает. Назначается дополнительное обследование, включающее:
- Анализы крови.
В период подагрического приступа с выраженными симптомами в общем анализе крови отмечается увеличение СОЭ, нейтрофильный лейкоцитоз. В биохимическом анализе, помимо гиперурикемии, обнаруживаются воспалительные маркеры (увеличение С-реактивного белка, ферритина), у больных с почечной патологией выявляются повышение концентрации креатинина, мочевой кислоты. - Общий анализ мочи.
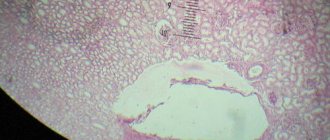
При микроскопическом исследовании осадка мочи находят большое количество кристаллов МК (уратов). У нефрологических пациентов при химическом анализе мочи могут обнаруживаться белок, эритроциты, изменение ее относительной плотности. - Исследование суставной жидкости.
Для получения синовиальной жидкости выполняют пункцию пораженного сустава. В нативном неокрашенном препарате методом поляризационной микроскопии выявляются игольчатой формы кристаллы моноурата натрия. Это «золотой стандарт» диагностики подагры. Эти кристаллы также можно обнаружить в содержимом тофусов. - Рентген суставов.
Рентгенологические изменения у больных подагрой появляются лишь через несколько лет от начала заболевания. Типичные рентгенологические признаки включают четко очерченные дефекты костной ткани в эпифизах костей стоп и кистей.
Диета при гиперурикемии
Бессимптомная гиперурикемия – польза или вред?
В настоящее время все более актуальным становится вопрос: насколько «безвредна» бессимптомная ГУ [32]? По мнению некоторых исследователей, повышение МК может благоприятно влиять на организм. Например, Orowan E. утверждает, что по своей химической структуре МК сходна с триметилированным ксантин кофеином и поэтому способна повышать умственную и физическую работоспособность [33]. Многочисленные исследования в 1960–70–х годах подтверждали, что люди с ГУ отличаются более высоким интеллектом и быстротой реакции [34–36]. Однако в большинстве работ показан сравнительно небольшой биологический эффект, к тому же возможное влияние оказал социо–экономический статус участников. Тем не менее эти исследования являются некоторым подтверждением умеренного нейростимулирующего действия МК. Другим полезным свойством МК считается ее способность действовать в качестве антиоксиданта, блокирующего супероксид, пероксинитрит и катализируемые железом окислительные реакции [37]. Ряд авторов свидетельствуют, что повышенная МК может быть одним из ключевых антиоксидантов плазмы и предотвращать связанный со старением окислительный стресс, тем самым способствуя продлению жизни [37]. Как показали исследования, инфузия МК людям повышает антиоксидантную активность сыворотки и улучшает функцию эндотелия [38]. Способность ГУ уменьшать пероксинитрит–опосредованное образование нитротирозина свидетельствует о нейропротекторных свойствах МК, что особенно важно при рассеянном склерозе, болезни Паркинсона, инсульте и других неврологических заболеваниях. По данным эпидемиологических исследований, лица с ГУ значительно реже страдают рассеянным склерозом, болезнью Паркинсона и Альцгеймера, а инфузия МК может уменьшать неврологические проявления, полученные экспериментальным путем (например, при экспериментальном аллергическом энцефаломиелите) [39]. Недавние исследования показали, что благоприятный эффект МК при этих состояниях связан, скорее, не с ее нитротирозин–подавляющим антиоксидантным действием, а со способностью блокировать гемато–энцефалический барьер или с воздействием на астроглиальные клетки [40,41]. Наряду с данными о некотором положительном влиянии МК, большинство работ связывают ГУ с развитием кардиоваскулярных заболеваний (КВЗ) и поражением почек [42]. Так, повышение МК ассоциировано с артериальной гипертензией, повышенной реабсорбцией натрия в проксимальных почечных канальцах, микроальбуминурией, протеинурией, поражением почек, ожирением, гипертриглицеридемией, низким содержанием холестерина липопротеидов высокой плотности, гиперинсулинемией, гиперлептинемией, гипоадипонектинемией, поражением периферических, сонных и коронарных артерий, эндотелиальной дисфункцией, окислительным стрессом, увеличением концентрации ренина, эндотелина и С–реактивного белка. Уровень МК выше у постменопаузальных женщин по сравнению с женщинами в пременопаузе и у городских жителей по сравнению с сельскими [31,43,44]. Связь между ГУ и риском развития КВЗ установлена в ходе крупных эпидемиологических исследований [45–48]. Доказана взаимосвязь ГУ с артериальной гипертензией, сахарным диабетом, инсулинорезистентностью, ожирением и обусловленными атеросклерозом сердечно–сосудистыми заболеваниями [45–49]. Однако остается неясным, является ли ГУ причиной или следствием кардиоваскулярной патологии, отражая наличие других факторов риска, таких как артериальная гипертензия, дислипидемия и диабет [50]. В исследовании NHANES I (the National Health and Nutrition Examination Survey) выявлена независимая связь между ГУ и ростом сердечно–сосудистой летальности. С повышением уровня МК риск смерти от ИБС возрастал на 77% у мужчин и на 300% у женщин. Увеличение концентрации МК на 1 мг/дл (59,5 мкмоль/л) ассоциировалось со значительным увеличением летальности от КВЗ как среди мужчин, так и среди женщин [10]. 12–летнее исследование (PIUMA), в котором участвовало более 1500 ранее не леченных пациентов с АГ, также продемонстрировало, что уровень МК сыворотки – сильный предиктор кардиоваскулярной заболеваемости и смертности [51]. У пациентов с сердечной недостаточностью повышение уровня МК рассматривается как показатель плохого прогноза и свидетельствует о необходимости трансплантации сердца [52]. Изучение больных сахарным диабетом 2 типа показало значительное повышение частоты инсульта при росте уровня МК. При этом связь оставалась значимой даже после исключения других кардиоваскулярных факторов риска [53]. Между тем результаты Фрамингемского исследования не выявили значительной связи между уровнем МК и кардиоваскулярной заболеваемостью [50]. Изучалась ассоциация уровня МК с поражением органов–мишеней у пациентов с АГ. Полученные результаты также неоднозначны. В ряде исследований получена взаимосвязь ГУ с массой миокарда левого желудочка и другими маркерами органного поражения [54–57]. Другие авторы не выявили значимой ассоциации МК с массой ЛЖ, поражением сонных артерий или микроальбуминурией [58]. В отличие от популяционных данных, результаты которых в отношении независимого значения МК, как фактора риска, противоречивы; в группах больных, собранных по нозологическому принципу, установленa значимость ГУ в качестве фактора риска развития КВЗ и связанных с ними осложнений. Это касается больных подагрой, а также пациентов с ревматоидным артритом [59] и системной склеродермией [60]. При этом показано, что не только кристаллы моноурата натрия, но и растворимая мочевая кислота при бессимптомной ГУ может приводить к увеличению уровня воспалительных медиаторов и индуцировать пролиферацию сосудистых гладкомышечных клеток in vitro [43,61–65]. Многие из этих «провоспалительных» медиаторов имеют фундаментальное значение в патогенезе атеросклеротического поражения сосудов и его осложнений [64,65]. В настоящее время предложено несколько механизмов, с помощью которых МК может участвовать в развитии КВЗ. Так, Johnson R.J. и соавт. в серии экспериментов на животных показали, что умеренное повышение МК может вызывать едва заметные гломерулотубулярные повреждения, способствующие активации ренин–ангиотензиновой системы (РАС) и повышению АД, при этом все изменения претерпевали обратное развитие после устранения ГУ [43, 66]. Sanchez–Lozada L.G. и соавт., изучая афферентные артериолы на крысиных моделях подагры, нашли, что высокие цифры МК могут индуцировать сосудистое повреждение, прекращавшееся при использовании аллопуринола [67]. Также показано, что ГУ вызывает констрикцию почечных сосудов, коррелирует с активностью РАС [67–69], участвует в развитии дисфункции эндотелия [70]. Имеются данные о том, что МК индуцирует пролиферацию сосудистых гладкомышечных клеток in vitro [62], активируя факторы транскрипции и сигнальные молекулы, вызывая гиперэкспрессию циклооксигеназы, тромбоцитарного фактора роста и моноцитарного хемоаттрактантного белка. МК и фермент ксантиноксидаза часто выявляются в атеросклеротических бляшках [71,72]. Свободные радикалы, встречающиеся при ГУ, стимулируют перекисное окисление липидов, ответственное за утолщение комплекса интима–медиа сонных артерий [62,68]. Другие потенциальные механизмы, с помощью которых ГУ и/или повышенная активность ксантиноксидазы могут способствовать сосудистому повреждению, включают адгезию тромбоцитов, пролиферацию гладкомышечных клеток сосудов и стимуляцию воспалительного ответа. Таким образом, ГУ может реализовывать свое патологическое влияние на сосуды различными путями [42]. У крыс не развивается ГУ за счет наличия у них фермента уриказы, превращающего МК в аллантоин. Интересно, что подавление уриказы у крыс приводит к возникновению гипертензии, опосредованной эндотелиальной дисфункцией и активацией ренин–ангиотензиновой системы, со временем переходящей в нефрогенную в связи с развитием у них артериолосклеротического повреждения сосудов [73,74]. С этим согласуются данные других исследований, в которых ГУ предшествовала возникновению АГ [75,76]. ГУ была обнаружена у почти 90% подростков с впервые диагностированной АГ [77]. В пилотных исследованиях уменьшению уровня МК аллопуринолом сопутствовало снижение АД [78]. Результаты исследований свидетельствуют, что коррекция ГУ может предотвращать развитие сердечно–сосудистых катастроф. Исследование LIFE впервые показало, что у больных с АГ и гипертрофией левого желудочка медикаментозное снижение МК может уменьшать кардиоваскулярный риск [79,80]. Таким образом, значение ГУ в развитии КВЗ вызывает много вопросов. Так, если острое повышение МК оказывает антиоксидантное действие и благоприятно влияет на функцию эндотелия, то хроническая ГУ, напротив, способствует развитию окислительного стресса и эндотелиальной дисфункции. Возможно, это связано с различными внутриклеточным и внутрисосудистым влияниями острой и хронической ГУ [81, 82]. Клинические исследования показали, что блокатор ксантиноксидазы аллопуринол может улучшать функцию эндотелия, снижать кардиоваскулярные осложнения у пациентов, перенесших аорто–коронарное шунтирование, и улучшать кардиальную функцию у пациентов с дилатационной кардиомиопатией и застойной сердечной недостаточностью [83–86]. Однако другие уратснижающие агенты не продемонстрировали подобных результатов [87,88]. Нельзя исключить, что эти эффекты обусловлены ингибированием ксантиноксидазы и не связаны со снижением МК или ингибиторы ксантиноксидазы преимущественно влияют на внутриклеточную МК, с которой связывают большинство кардиоренальных эффектов [89]. Если ГУ действительно влияет на клинические исходы, то диетарные и фармакологические вмешательства, направленные на снижение МК, могут стать новым методом профилактики сердечно–сосудистых заболеваний. Будем надеяться, что дальнейшие исследования в скором времени подскажут ответы на эти вопросы. Литература 1. Ревматология: национальное руководство, 2008. 2. W Zhang, M Doherty, E Pascual, T Bardin, V Barskova, P Conaghan, J Gerster, J Jacobs, B Leeb, F Liote?, G McCarthy, P Netter, G Nuki, F Perez–Ruiz, A Pignone, J Pimenta?o, L Punzi, E Roddy, T Uhlig, I Zimmermann–Go`rska. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT). Ann Rheum Dis 2006; 65:1301–1311. 3. Campion E.W.; Glynn R.J.; DeLabry L.O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med. 1987; 82(3):421–6. 4. Choi H.K., Atkinson K., Karlson E.W., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the Health Professionals Follow–up Study // Arch Intern Med.– 2005.– № 165.– р. 742–748. 5. Dessein P.H., Shipton E.A., Stanwix A.E., Joffe B.I., Ramokgadi J. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study // Ann Rheum Dis.– 2000.– № 59.– р. 539–543. 6. Fam A.G. Gout, diet, and the insulin resistance syndrome // J Rheumatol.– 2002.– № 29.– р. 1350–5. 7. Lin K.C., Lin H.Y., Chou P. Community based epidemiological study on hyperuricemia and gout in Kin–Hu, Kinmen // J Rheum.– 2000.– № 27.– р. 1045–50. 8. Alper A.B. Jr, Chen W., Yau L., Srinivasan S.R., Berenson G.S., Hamm L.L. Childhood uric acid predicts adult blood pressure: the Bogalusa Heart Study // Hypertension. – 2005.– №45.– р. 34–38. 9. Grodzicki T., Palmer A., Bulpitt C.J., Incidence of diabetes and gout in hypertensive patients during 8 year of follow–up // J Hum Hypertens.– 1997.– № 11.– р. 583–585. 10. Fang J., Alderman M. Serum uric acid and cardiovascular mortality: The NHANES I epidemiologic follow–up study, 1971–1992. National Health and Nutrition Examination Survey // JAMA.– 2000.– № 238.– р. 2404–10. 11. Johnson R.J., Kang D.H., Feig D., et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? // Hypertension.– 2003.– № 41.– р. 1183–90. 12. Mazzali M., Hughes J., Kim Y.G., et al. Elevated uric acid increases blood pressure in the rat by a novel crystal–independent mechanism // Hypertension.– 2001.– № 38.– р. 1101–6. 13. Tykarski A. Evaluation of renal handling of uric acid in essential hypertension: hyperuricemia related to decreased urate secretion // Nephron.– 1991.– № 59.– р. 364–368. 14. Breckenridge A. Hypertension and hyperuricaemia // Lancet.– 1966.–№ 1. р. 15–18. 15. Aronoff A. Acute gouty arthritis precipitated by chlorotiazide // N Engl J Med.– 1960.– № 262.– р. 767–769. 16. Campion E.W., Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study // Am J Med.– 1987.–№ 82.– р. 421–426. 17. Grodzicki T., Palmer A., Bulpitt C.J., Incidence of diabetes and gout in hypertensive patients during 8 year of follow–up // J Hum Hypertens.– 1997.– № 11.– р. 583–585. 18. Lane P. Drug–induced gout // Br. Med J.– 1960.– № 2.– р. 1383–4. 19. Laragh J.H., Heinemann H.O. Demartini F.F. Effect of chlorothiazide on electrolyte transport in man; its use in the treatment of edema of congestive heart failure, nephrosis, and cirrhosis // JAMA.– 1958.– № 166.– р. 145–152. 20. Lin K.C., Lin H.Y., Chou P. Community based epidemiological study on hyperuricemia and gout in Kin–Hu, Kinmen // J Rheum.– 2000.– № 27.– р. 1045–50. 21. Oren B.G., Rich M., Belle M.S. Chlorothiazide (Diuril) as a hyperuricacidemic agent // JAMA.– 1958.– № 168.– р. 2128–9. 22. Drum D.E., Goldman P.A., Jankowski C.B. Elevation of serum uric acid as a clue to alcohol abuse // Arch Intern Med.– 1981.– № 141.– р. 477–479. 23. Sharpe C.R. A case–control study of alcohol consumption and drinking behavior on patients with acute gout // Can Med Assoc J.– 1984.– № 131.– р. 563–567. 24. Arromdee E., Michet C.J., Crowson C.S. et al. Epidemiology of Gout: Is the Incidence Rising? //J Rheumatol.– 2002.– № 29.– р. 2403–6. 25. Adams P.F., Hendershot G.E., Marano M.A. Current estimates from the National Health Interview Survey, 1996.– Vital Health Stat 10.– 1999.– 200р. 26. Fam A.G. Gout in the elderly: clinical presentation and treatment // Drug Aging.– 1998.– № 13.– р. 229–243. 27. Troen B.R. The biology of aging // Mt Sinai J Med.– 2003.– № 70.– р. 3–22. 28. US Renal Data System. USRDS 1999 annual data report. Bethesda (MD): National Institute of Health (US), National Institute of diabetes and Digestive and Kidney Diseases.– 1999. 29. Ahn K.J., Kim Y.S., Lee H.C., Park K., Huh K.B. Cyclosporine–induced hyperuricemia after renal transplant: clinical characteristics and mechanisms // Transplant Proc.– 1992.– № 24.– р. 1391–2. 30. Saag K.G., Choi H. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther. 2006; 8 (suppl 1): S2. 31. Johnson RJ, Titte S, Cade JR, Rideout BA, Oliver WJ. Uric acid, evolution and primitive cultures. Semin Nephrol 2005;25:3–8. 32. Neogi T. Asymptomatic Hyperuricemia: Perhaps Not So Benign? The J of Rheumatol. 2008, 5, 734–737. 33. Orowan E. The origin of man. Nature 1955;175:683–4. 34. Bloch S, Brackenridge CJ. Psychological, performance and biochemical factors in medical students under examination stress. J Psychosom Res 1972;16:25–33. 35. Brooks GW, Mueller E. Serum urate concentrations among university professors; relation to drive, achievement, and leadership. JAMA 1966;195:415–8. 36. Stetten D Jr, Hearon JZ. Intellectual level measured by army classification battery and serum uric acid concentration. Science 1959;129:1737. 37. Ames BN, Cathcart R, Schwiers E, Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant– and radical–caused aging and cancer: a hypothesis. Proc Natl Acad Sci USA 1981;78:6858–62. 38. Waring WS, McKnight JA, Webb DJ, Maxwell SR. Uric acid restores endothelial function in patients with type 1 diabetes and regular smokers. Diabetes 2006;55:3127–32. 39. Kutzing MK, Firestein BL. Altered uric acid levels and disease states. J Pharmacol Exp Ther 2008;324:1–7. 40. Du Y, Chen CP, Tseng CY, Eisenberg Y, Firestein BL. Astroglia–mediated effects of uric acid to protect spinal cord neurons from glutamate toxicity. Glia 2007;55:463–72. 41. Spitsin SV, Scott GS, Mikheeva T, et al. Comparison of uric acid and ascorbic acid in protection against EAE. Free Radic Biol Med 2002;33:1363–71. 42. Baker JF, Krishnan E, Chen L, Schumacher HR. Serum uric acid and cardiovascular disease: recent developments, and where do they leave us? Am J Med 2005;118:816–26. 43. Johnson RJ, Kang DH, Feig D, et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003;41:1183–90. 44. Nakanishi N, Okamoto M, Yoshida H, Matsuo Y, Suzuki K, Tatara K. Serum uric acid and risk for development of hypertension and impaired fasting glucose or Type II diabetes in Japanese male office workers. Eur J Epidemiol 2003;18:523–30. 45. Fang J., Alderman M. Serum uric acid and cardiovascular mortality: The NHANES I epidemiologic follow–up study, 1971–1992. National Health and Nutrition Examination Survey // JAMA.– 2000.– № 238.– р. 2404–10. 46. Freedman D.S, Willamson D.F., Gunter E.W., Byers T. Relation of serum uric acid to mortality and ishemic heart disease. The NHANES 1 Epidemiologic Follow–up Study // Am. J. Epidemiol.– 1995.– № 141(7).–р. 637–644. 47. Brand F.N., McGee D.L., Kannel W.B. et al. Hyperuricemia as a risk factor of coronary heart disease: The Framingham Study // Am. J. Epidemiol.– 1985. Vol. 121. P.11. 48. Niskanen L.K., Laaksonen D.E., Nyyssonen K. et al. Uric acid level as a risk factor for cardiovascular and all–cause mortality in middle–aged men: a prospective cohort study // Arch. Intern. Med.–2004.–Vol.164, p. 1546. 49. Барскова В.Г., Ильиных Е.В., Елисеев М.С., Зилов А.В., Насонов Е.Л. Кардиоваскулярный риск у больных подагрой. Ожирение и метаболизм. 2006, 3(8), 40–44. 50. Culleton B.F., Larson M. G., Kannel W.B., D. Levy. Serum Uric Acid and Risk for Cardiovascular Disease and Death: The Framingham Heart Study // Ann. Intern. Med.– 1999.– № 131.– р. 7–13. 51. Verdecchia P., Schillaci G., Reboldi G. et al. Relation between serum uric acid and risk of cardiovascular disease in essential hypertension. The PUIMA study. Hypertension 2000; 36: 1072–8. 52. Anker S.D., Doehner W., Rauchhaus M. et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging. Circulation 2003; 107: 1991–7. 53. Lehto S., Niskanen L., Ronnemaa T. et al. Serum uric acid is a strong predictor of stroke in patients with non–insulin–independent diabetes mellitus. Stroke 1998; 29: 635–9. 54. Alderman M.N., Cohen H., Madhvan S. et al. Serum uric acid and cardiovascular events in successfully treated hypertensive patients. Hypertension. 1999; 34: 144–150. 55. Campo C., Ruilope L.M., Segura J. Et al. Hyperuricemia, low urine urate excretion and target organ damage in arterial hypertension. Blood press. 2003; 12: 277–283. 56. Viazzi F., Parodi D., Leoncini G. Et al. Serum uric acid and target organ damage in primary hypertension. Hypertension. 2005; 45: 991–996. 57. Iribarren C., Folsom A.R., Eckfeldt J.H. et al. Correlates of uric acid and its association with asymptomatic carotid atherosclerosis: the ARIC study. Ann Epidemiol. 1996; 6: 331–340. 58. Cuspidi C., Valerio C., Sala C. Et al. Lack of association between serum uric acid and organ damage in a never–treated essential hypertensive population at low prevalence of hyperuricemia. Am J Hypertens. 2007; 20: 678–685. 59. Panoulas V.F., Milionis H.J., Douglas K.M. et al. Association of serum uric acid with cardiovascular disease in rheumatoid arthritis. Rheumatology (Oxford). – 2007; 46 (9): 1466–1470. 60. Chen C.H., Chen H.A., Wang H.P. et al. Pulmonary arterial hypertension in autoimmune diseases: an analysis of 19 cases from a medical center in northern Taiwan. J Micribiol Immunol Infect.–2006; 39 (2): p. 162–168. 61. Leyva F., Anker S., Godsland I.F. et al. Uric acid in chronic heart failure: a marker of chronic inflammation // Eur. Heart. J. – 1998. Vol.19.– P.1814 –1822. 62. Rao G.N., Corson M.A., Berk B.C. Uric acid stimulates vascular smooth muscle cell proliferation by increasing platelet–derived growth factor A–chain expression // J.Biol.Chem.–1991.–Vol. 266.–P.8604–8608. 63. Schumacher H.R. Jr. Crystal–induced arthritis: an overview // Am J Med.– 1996.– № 100.– р. 46S–52S. 64. Насонов Е.Л. Проблема атеротромбоза в ревматологии. Вестник РАМН, 2003; 7: 6–10. 65. Насонов Е.Л., Насонова В.А., Барскова В.Г. Механизмы развития подагрического воспаления. Тер арх. 2006, 6 (78), 77–84. 66. Johnson R.J., Rodriguez–Iturbe B., Kang D.H. et al. A unifying pathway for essential hypertension. Am J Hypertens. 2005; 18: 431–440. 67. Sanchez–Lozada L.G., Tapia E., Avila–Casado C. Et al. Mild hyperuricemia induces glomerular hypertension in normal rats. Am J Physiol. 2002; 283:F1105–F1110. 68. Mazzali M., Kanellis J., Han L. Et al. Hyperuricemia induces a primary arteriolopathy in rats by a blood pressure–independent mechanism. Am J Physiol. 2002; 282:F 991–F997. 69. Saito I., Saruta T., Kondon K. Et al. Serum uric acid and the renin–angiotensin system in hypertension. J Am Geriatr Soc. 1978; 26: 241–247. 70. Waring W.S., Webb D.J., Maxwell S.R.J. et al. Effect of local hyperucemia on endothelial function in the human forearm vascular bed. Br J Clin Pharmacol. 2000; 49:511. 71. Suarna C., Dean R.T., May J. et al. Human atherosclerotic plaque contains both oxidized lipids and relatively large amounts of alpha–tocopherol and ascorbate. Artherioscler Thromb Vasc Biol. 1995; 15: 1616–1624. 72. Iribarren C., Folsom A.R., Eckfeldt J.H. et al. Correlates of uric acid and its association with asymptomatic carotid atherosclerosis: the ARIC Study: Atherosclerosis Risk in Communities. Stroke. 1999; 29:635–639. 73. Mazzali M, Hughes J, Kim YG, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal–independent mechanism. Hypertension 2001;38:1101–6. 74. Watanabe S, Kang DH, Feng L, et al. Uric acid, hominoid evolution, and the pathogenesis of salt–sensitivity. Hypertension 2002;40:355–60. 75. Masuo K, Kawaguchi H, Mikami H, Ogihara T, Tuck ML. Serum uric acid and plasma norepinephrine concentrations predict subsequent weight gain and blood pressure elevation. Hypertension 2003;42:474–80. 76. Sundstrom J, Sullivan L, D’Agostino RB, Levy D, Kannel WB, Vasan RS. Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension 2005;45:28–33. 77. Feig DI, Johnson RJ. Hyperuricemia in childhood primary hypertension. Hypertension 2003;42:247–52. 78. Feig DI, Nakagawa T, Karumanchi SA, et al. Hypothesis: Uric acid, nephron number, and the pathogenesis of essential hypertension. Kidney Int 2004;66:281–7. 79. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002; 359: 995–1003. 80. Hoieggen A., Alderman M.H., Kjeldsen S.E. et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004; 65: 1041–1049. 81. Santos CX, Anjos EI, Augusto O. Uric acid oxidation by peroxynitrite: multiple reactions, free radical formation, and amplification of lipid oxidation. Arch Biochem Biophys 1999;372:285–94. 82. Sautin YY, Nakagawa T, Zharikov S, Johnson RJ. Adverse effects of the classical antioxidant uric acid in adipocytes: NADPH oxidase–mediated oxidative/nitrosative stress. Am J Physiol Cell Physiol 2007;293:C584–96. 83. Doehner V., Schoene N., Rauchhaus M. Et al. Effects of xantine oxidase inhibition with allopurinol on endothelial function and peripheral blood flow in hyperuricemic patients with chronic heart failure: results from 2 placebo–controlled studies. Circulation 2002; 105: 2619–2624. 84. Coghlan J.G., Flitter W.D., Clutton S.M. et al. Allopurinol pretreatment improves postoperative recovery and reduces lipid peroxidation in patients undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg. 1994; 107: 248–256. 85. Weimert N.A., Tanke W.F., Sims JJ. Allopurinol as a cardioprotective during coronary artery bypass graft surgery. Ann Pharmacother 2003; 37: 1708–1711. 86. Cappola T.P., Kass D.A., Nelson G.S. et al. Allopurinol improves myocardial effeciency in patients with idiopathic dilated cardiomyopathy. Circulation 2001; 104: 2407–2411. 87. George J, Carr E, Davies J, Belch JJ, Struthers A. High–dose allopurinol improves endothelial function by profoundly reducing vascular oxidative stress and not by lowering uric acid. Circulation 2006;114:2508–16. 88. Waring WS, McKnight JA, Webb DJ, Maxwell SR. Lowering serum urate does not improve endothelial function in patients with type 2 diabetes. Diabetologia 2007;50:2572–9. 89. Kang DH, Park SK, Lee IK, Johnson RJ. Uric acid–induced C–reactive protein expression: implication on cell proliferation and nitric oxide production of human vascular cells. J Am Soc Nephrol 2005;16:3553–62.
Коррекция
Медикаментозное лечение
Чтобы скорректировать гиперурикемию, необходимо устранение этиологического фактора. Если в процессе сбора анамнеза выясняется, что больной принимает ЛС, вызывающее гиперурикемию, нужно рассмотреть вопрос либо о снижении дозировки, либо о замене препарата на альтернативный, но не имеющий такого побочного действия. Тактика лечения во многом определяется наличием клинических симптомов, а также их выраженностью.
- Диета.
Людям, страдающим подагрой, нужно обязательно отказаться от приема алкоголя и исключить из рациона питания высокопуриновые продукты (красное мясо, печень, копчености), так как они способны провоцировать усиление симптомов. - Колхициновые алкалоиды.
Основная группа препаратов для купирования острого подагрического приступа. Уменьшение симптомов наступает в течение 12 часов после первого приема. - НПВС.
Назначаются в дополнение к колхициновым алкалоидам с целью облегчения симптомов артрита. Предпочтение отдается ЛС с наиболее выраженным анальгетическим и противовоспалительным эффектом. - Глюкокортикостероиды.
Гормональные средства применяют для устранения симптомов в случае индивидуальной непереносимости колхицина и НПВС или при наличии у пациента строгих противопоказаний к их приему. - Урикодепрессоры.
Препараты данной группы снижают содержание МК за счет подавления активности фермента, участвующего в синтезе МК (ксантиноксидаза). Длительный прием способствует снижению частоты возникновения симптомов подагры, замедлению отложения кристаллов и формирования тофусов. - Селективные ингибиторы ксантиноксидазы.
Основное отличие от урикодепрессоров – более низкая частота возникновения нежелательных побочных реакций, таких как инфекции верхних и нижних дыхательных путей, гепатотоксичность, реакции гиперчувствительности. - Урикозурические ЛС.
Эти средства тормозят реабсорбцию МК в канальцах почек, тем самым увеличивая экскрецию МК. - Антиподагрические ЛС смешанного действия.
Также существуют комбинированные лекарственные препараты, одновременно действующие на 2 звена метаболизма МК. Они содержат урикодепрессивный компонент и урикозурическое средство. - Ощелачивающие препараты.
Для профилактики развития уратной нефропатии и отложения уратных камней основная уратснижающая терапия должна дополняться приемом ЛС для ощелачивания мочи – цитрат натрия, гидрокарбонат натрия.
Экспериментальная терапия
Продолжаются разработки и клинические исследования новых лекарственных средств для борьбы с гиперурикемией. Расбуриказа – препарат, содержащий рекомбинантную уриказу (фермент, разрушающий мочевую кислоту), показал высокую эффективность в лечении синдрома лизиса опухоли. Также данное ЛС отличается возможностью резорбции отложенных кристаллов моноурата натрия.
Перспективным является использование генно-инженерных биологических препаратов – антагониста рецепторов интерлейкина-1 (анакинра), полностью гуманизированных моноклональных антител к ИЛ-1-бета (канакинумаб), растворимого белка ИЛ-1 (рилонацепт). Их применение продемонстрировало достаточную эффективность в профилактике обострений симптомов хронического подагрического артрита.