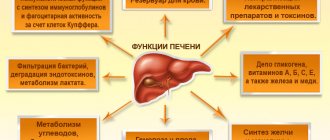
Печеночная энцефалопатия (ПЭ) – это обратимые изменения нейропсихической сферы, проявляющиеся заторможенностью, снижением концентрации внимания, расстройствами когнитивных функций, инверсией сна, интенционным тремором конечностей, обусловленные метаболическими расстройствами при циррозе печени (ЦП). ПЭ является следствием печеночноклеточной недостаточности, развивающейся практически при всех известных заболеваниях печени (вирусных и токсических гепатитах, аутоиммунной болезни печени, болезни Вильсона и др.), связана с уменьшением объема функционирующей паренхимы печени и неспособностью гепатоцитов поддерживать гомеостаз и осуществлять детоксицирующую функцию [2, 3, 5].
Крайней степенью ПЭ является печеночная кома с развитием необратимых структурных изменений нервной системы, которым часто предшествует генерализованный судорожный синдром. Печеночная кома – это итог длительно существующей ПЭ или фульминантного печеночного процесса, который часто заканчивается летально [3].
Механизм развития ПЭ
Патогенез ПЭ до настоящего времени находится на стадии изучения. Существует несколько концепций развития этого синдрома.
1. Наиболее обоснованной является теория нарушения энергетических процессов в нейронах, согласно которой неионизированный аммиак легко проникает через гематоэнцефалический барьер (ГЭБ) и мембраны нейронов. При этом происходит снижение скорости окисления глюкозы, что ведет к энергетическому голоданию клеток мозга [2].
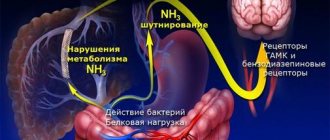
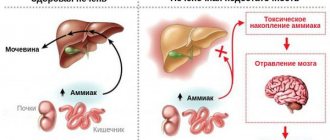
Аммиак, в норме образующийся в толстой кишке, поступает по воротной вене в печень, где большая его часть включается в орнитиновый цикл, конечным продуктом которого является мочевина. Синтезированная в печени мочевина попадает в кровь, затем фильтруется в просвет проксимальных канальцев почек и в итоге выводится с мочой. Не включившийся в орнитиновый цикл аммиак захватывается небольшой популяцией перивенозных гепатоцитов, где под влиянием глутаминсинтетазы образуется глутамин. Указанные механизмы способствуют предотвращению попадания токсических продуктов в системный кровоток. При печеночноклеточной недостаточности происходит снижение скорости метаболизма аммиака и других токсинов в печени. Кроме того, токсические продукты могут попадать в общий кровоток, минуя печень, по портокавальным анастомозам. Уровень гипераммониемии у 90 % больных ЦП достоверно коррелирует с развитием и степенью тяжести ПЭ.
Таким образом, производные аммиака через ГЭБ могут поступать из крови в ткани головного мозга и оказывать выраженное токсическое действие на ЦНС, механизм которого в настоящее время находится на стадии активного изучения.
2. Согласно теории (ложных) нейротрансмиттеров, у больных с заболеваниями печени при повышенном катаболизме белка в кровь поступает значительное количество ароматических аминокислот (тирозин, фенилаланин, триптафан) и одновременно снижается содержание аминокислот с разветвленной цепью (валин, лейцин, изолейцин). Аминокислотный дисбаланс приводит к проникновению через ГЭБ массы ароматических аминокислот, что способствует снижению синтеза дофамина и образованию ложных нейротрансмиттеров (октопамин, фенилэтаноламин). Происходит торможение ферментной системы и образование норадреналина, нарушается передача импульсов в катехоламиновых и дофаминовых синапсах головного мозга, что приводит к угнетению нервной системы, истощению мозга и развитию энцефалопатии [1, 3].
Помимо этого снижение инактивирующей функции печени приводит к дисбалансу между синтезом и распадом γ-аминомасляной кислоты (ГАМК), которая является основным тормозным нейротрансмиттером в головном мозге. Указанная гипотеза подтверждается наличием у больных ПЭ высокого содержания в плазме крови и ликворе ГАМК и ГАМК-подобных субстанций [1].
3. Синдром избыточного бактериального роста приводит больных ЦП к развитию эндотоксемии, транслокации продуктов распада кишечных бактерий и их токсинов в систему воротной вены с формированием системных проявлений, в т. ч. ПЭ. Выделяют несколько причин, способствующих избыточному росту грамотрицательной и анаэробной микрофлоры кишечника и эндотоксемии при ЦП: синдром нарушенного пищеварения и всасывания, связанные с ним изменение состава микроорганизмов, гипомоторика тонкой и толстой кишки, повышенная проницаемость стенки кишечника. Кроме того, изменение состава флоры кишечника ассоциируется с увеличением количества внутриэпителиальных лимфоцитов, снижением их пролиферативной активности и способности продуцировать интерферон, что приводит к нарушению местного иммунитета [4, 5, 9].
На основании всего вышеизложенного можно заключить, что при ПЭ нарушены метаболические процессы в клетках головного мозга, однако на сегодняшний день единого объяснения развития этого патологического состояния не существует. Внешние факторы, способствующие развитию ПЭ при ЦП, приведены в табл. 1.
Описание и причины энцефалопатии
Печеночная энцефалопатия — тяжелое заболевание
Термином «энцефалопатия» в медицине обозначается расстройство деятельности головного мозга в результате процессов невоспалительного характера.
При этом нарушение функции появляется вследствие дистрофических изменений структуры в тканях и клетках мозга.
Одним из факторов, вызывающих данную патологию, являются серьезные заболевания печени:
- цирроз;
- рак;
- алкогольный гепатит;
- острый вирусный гепатит.
Все эти болезни вызывают острую печеночную недостаточность. Кроме того, существуют другие причины печеночной энцефалопатии, развивающейся в результате заражения кровь кишечными нейротоксинами:
- избыток белка в организме вследствие неправильного питания;
- лекарственные интоксикации;
- злоупотребление алкоголем;
- кровотечения в желудке, отделах кишечника;
- операционное вмешательство;
- частые запоры;
- асцит (скопление жидкости в брюшине) и последующий перитонит (острое воспаление).
Печеночная недостаточность сопровождается рядом серьезных нарушений в организме. Меняется гемостаз, гидростатическое и онкотическое давление, водно-электролитный и кислотно-щелочной состав крови. От этих изменений страдают клетки астроциты, из которых на треть состоит головной мозг.
В норме они должны обеспечивать достаточную проницаемость тканей мозга для крови, обезвреживать токсины, снабжать клетки электролитами и нейротрансмиттерами.
При печеночной энцефалопатии поражается центральная нервная система. Астроциты теряют свои функции под воздействием аммиака, жирных кислот, магния, ложных трансмиттеров, аминокислот, вследствие чего увеличивается внутричерепное давление и развивается отек головного мозга.
Клиническая картина
В настоящее время выделяют три клинических варианта ПЭ [2, 3]:
1. Субклиническая энцефалопатия
Субклиническая ПЭ характеризуется отсутствием клинических симптомов, однако при дополнительных исследованиях выявляется ряд нервно-психических нарушений (ухудшение познавательных способностей, утрата тонких моторных навыков, устанавливаемых только при помощи психометрических тестов). Согласно литературным данным, у больных ЦП субклиническая ПЭ выявляется в 50–70 % случаев. У больных ЦП с портосистемным шунтированием ПЭ может быть эпизодической со спонтанным разрешением или интермиттирующей, длящейся многие месяцы и даже годы.
2. Хроническая энцефалопатия
Эта форма ПЭ делится на три стадии (табл. 2). При I стадии клинически наблюдаются малозаметное изменение личности, рассеянность, сниженное внимание, неспособность сосредоточиться, легкая атаксия, нарушения сна.
Стадия II проявляется усталостью, сонливостью, апатией, монотонной речью, неадекватным поведением с заметными изменениями в “структуре” личности, нарушениями ориентации во времени, наличием интенционного тремора, рефлексов орального автоматизма, атаксией.
Для III стадии ПЭ характерны выраженная дезориентация во времени и пространстве, бессвязная речь, агрессия, гипо- или гиперрефлексия, патологические рефлексы (Гордона, Жуковского), выраженный интенционный тремор, ригидность мышц. При неадекватном лечении ПЭ возможно наступление печеночной комы, которая характеризуется отсутствием сознания, исчезновением реакций на болевые раздражители. Отмечается ригидность мышц конечностей и затылка, маскообразное лицо, патологические рефлексы (Бабинского, Гордона, Жуковского). Иногда выявляются хватательный и хоботковый рефлексы [5].
Помимо психоневрологических симптомов для комы характерны клинические проявления печеночно-клеточной недостаточности – желтуха, печеночный запах, асцит, геморрагические симптомы. Причинами летальных исходов являются отек мозга, отек легких, гепаторенальный синдром, инфекционно-токсический или гиповолемический шок.
3. Острая ПЭ
Может развиться у пациентов с тяжелой желтухой на фоне асцита при выраженных некротических процессах в печени, а также у больных фульминантной печеночной недостаточностью. Острая ПЭ может сопровождаться развитием печеночной комы.
Диагностические процедуры
Для диагностики достаточно сдать анализ крови и сделать УЗИ
Диагноз печеночной энцефалопатии включает установление клинических симптомов, оценку стадии развития и степени тяжести протекания заболевания.
В первую очередь значительное внимание нужно уделить сбору анамнеза – злоупотребление медикаментами и алкоголем, перенесение острого вирусного гепатита или хирургического вмешательства, наличие запоров.
Далее пациент должен сдать:
- Общий анализ крови. На наличие патологии указывает анемия, низкая концентрация тромбоцитов, увеличение содержания лейкоцитов крови (лейкоцитоз) с токсической зернистостью нейтрофилов.
- Печеночные пробы. При этом выявляется повышение билирубина и активности трансаминаз, активность ферментов печени – гамма-глютамилтрансферазы и щелочной фосфатазы.
- Коагулограмму. При этом отмечается изменение гемостаза, снижение фибриногена и повышение тромбопластина.
При необходимости назначаются другие лабораторные исследования, которые позволят выявить полиорганную недостаточность.
Уточнение диагноза и оценка степени тяжести печеночной энцефалопатии проводится на основе следующих процедур:
- Биопсия печени методом пункции.
- Магнитно-резонансная томография печени и желчевыводящих путей.
- Ультразвуковое исследование печени и желчного пузыря.
- Компьютерная томография желчевыводящих путей.
- Электроэнцефалография.
Для того чтобы выявить влияние на развитие энцефалопатии заболеваний других органов пациента, проводят дифференциальную диагностику.
Данные исследования применяют в случаях метаболических расстройств, инфекционных заболеваний ЦНС, геморрагического инсульта, кровоизлияния в мозг, повышения содержания азота в крови вследствие злоупотребления алкоголем или медицинскими препаратами.
Диагностика
Диагностика ПЭ осуществляется на основании данных анамнеза, жалоб больного, соответствующих симптомов (табл. 2) и выявленных при клинико-инструментальном исследовании нарушений со стороны ЦНС, характерных для ЦП различной этиологии.
Наиболее простым и объективным в клинической практике является использование психометрических тестов [2, 5, 7]: Тест связи чисел: при выполнении данного теста задача больного – соединить между собой группу чисел от 1 до 25 как можно быстрее. Время, превышающее 30 секунд, рассматривается как патология.
Тест линий: сущность теста линий состоит в том, чтобы больной провел линию в ограниченном с двух сторон коридоре, не касаясь внешних границ. Полученные параметры сравниваются с нормальными значениями для данной возрастной группы.
Указанные тесты позволяют диагностировать в т. ч. и субклиническую ПЭ. Для ПЭ нет ни одной патогномоничной особенности, диагностическое значение имеют совокупность клинических данных и опыт врача.
Важно решить вопрос об этиологии заболевания печени, которое лежит в основе ПЭ, т. к. только квалифицированная тактика врача-гепатолога может обеспечить благоприятный прогноз заболевания.
Симптомы
Печеночная энцефалопатия протекает в несколько стадий, на которых выраженность клинических проявлений различается. В целом заболевание сопровождается широким набором психических и неврологических нарушений. Основные из них описаны ниже.
Расстройства сна
. У больных печеночной энцефалопатией вначале появляется сонливость. В дальнейшем происходит инверсия (радикальное изменение) нормального ритма бодрствования и сна.
Нарушения сознания
. При данном заболевании обычно отмечается снижение количества спонтанных действий. Больной редко фиксирует взгляд, у него наблюдаются апатия и заторможенность, на вопросы отвечает кратко. При дальнейшем ухудшении состояния человек, страдающий печеночной энцефалопатией, реагирует только на интенсивные стимулы.
Изменения личности
. У больных может наблюдаться потеря интереса к семье, ребячливость. Причем эти изменения нередко сохраняются даже в период ремиссии, что свидетельствует о вовлечении лобных долей мозга в патологический процесс. При печеночной энцефалопатии больные могут пребывать в состоянии эйфории или игривом настроении.
Расстройства интеллекта
. Нарушения когнитивных функций (памяти, внимания и т. д.) могут быть легкими и сильно выраженными. В тяжелых случаях наблюдается спутанность сознания.
Нарушения речи
. У больных печеночной энцефалопатией голос становится монотонным, а речь – невнятной, медленной. В дальнейшем нарушения речи могут стать еще более тяжелыми (дисфазия).
Хлопающий тремор
. При данном заболевании наблюдается характерное хлопающее (сгибательно-разгибательное) движение кисти при вытянутых руках и широко расставленных пальцах.
Кома
. Вначале может напоминать обычный сон, но в дальнейшем больной перестает реагировать на внешние раздражители полностью.
Патогенез печеночной энцефалопатии: основные положения
Традиционно ПЭ подразделяется на явную (с неврологическими и/или психиатрическими отклонениями, которые могут быть обнаружены клинически) и скрытую (с отклонениями, которые выявляются с помощью нейропсихических или нейрофизиологических тестов).
Считается, что в основе патогенеза ПЭ лежат следующие основные факторы: 1) повышение содержания аммиака в крови (гипераммониемия) в связи с избыточным поступлением в кровь азотсодержащих веществ, синтезируемых кишечными бактериями и недостаточной обезвреживающей функцией гепатоцитов, 2) портосистемное шунтирование крови. Серьезную роль в патогенезе ПЭ играют тяжесть повреждения печени, степень выраженности воспаления и/или оксидативного стресса, возраст, ассоциированные заболевания (сахарный диабет, почечная недостаточность), тяжесть и характер провоцирующего ПЭ фактора.
Астроциты поглощают аммиак, участвующий в реакции превращения глутамата в глутамин; избыток последнего при гипераммониемии приводит к разбуханию астроцитов и тканевому отеку. Уменьшение содержания глутамата в астроцитах сопровождается нарушением его нейротрансмиссии с участием NMDA-рецепторов, а также повышением активности ГАМКергических процессов. Вероятнее всего, эти события лежат в основе когнитивного дефицита, судорожных пароксизмов и других клинических проявлений ПЭ [5, 6].
Несмотря на длительный период изучения ПЭ, по-прежнему остаются вопросы, требующие внесения ясности: корректная диагностика как клинически выраженной, так и скрытой ПЭ; роль определенных факторов ее патогенеза и, соответственно, диагностических инструментов, выбор оптимальных лечебных мер. Отдельные вопросы: тактика ведения пациентов с минимальной ПЭ и амбулаторный режим, а именно контроль за уровнем сознания, эффективностью лечения ПЭ в домашних условиях.
Введение
Печеночная энцефалопатия (ПЭ) остается одним из наиболее серьезных осложнений цирроза печени. Разнообразие ее клинических проявлений создает определенные сложности в оптимально быстрой и правильной диагностике прямо у постели больного. В международном сообществе основным направляющим деятельность врачей документом в условиях повседневной практики служат клинические рекомендации. Относительно ПЭ они были созданы Американской и Европейской ассоциациями по изучению печени [1]. Положения этого документа учтены в российских рекомендациях по ведению пациентов с циррозом печени [2]. Однако с момента их написания прошло много лет, накоплены новые знания и опыт. Эти новые знания и положения обобщены в нескольких работах, ориентированных на оптимизацию именно клинической работы с пациентами, страдающими ПЭ: 1) консенсус международного общества по изучению ПЭ и метаболизма азота (ISHEN: The International Society for Hepatic Encephalopathy and Nitrogen Metabolism) от 2021 г. [3]; 2) обзорная статья мировых экспертов в вопросах ПЭ «Новый взгляд на классификацию, патофизиологию и терапию ПЭ» [4]; положения консенсуса экспертов в ведении пациентов с декомпенсированным циррозом печени, подготовленные Европейской ассоциацией по изучению печени и опубликованные в J. Hepatology
в 2021 г. [5]. Они положены в основу новых дополненных рекомендаций по ведению пациентов с циррозом печени Российского общества по изучению печени, которые сейчас готовятся к публикации и принятию МЗ РФ.
Данный обзор представляет новые знания и положения последних лет по вопросу клинической работы с пациентами, страдающими ПЭ на фоне цирроза печени.
Принципы лечения печеночной энцефалопатии
Доминирующая роль аммиака в патогенезе ПЭ при циррозе печени определяет основное направление лечения – уменьшение его концентрации, что достигается за счет снижения его продукции в кишечнике и увеличения элиминации гепатоцитами. Соответственно, в целях уменьшения продукции аммиака в кишечнике применяются следующие основные препараты: невсасывающийся антибиотик рифаксимин и осмотическое слабительное лактулоза (лактитол). Для стимуляции клиренса аммиака гепатоцитами (через образование мочевины и синтез глутамина) и/или мышечными клетками применяется L-орнитин-L-аспартат. Подробные схемы назначения этих препаратов указаны в клинических рекомендациях Российского общества по изучению печени по лечению пациентов с циррозом печени в разделе «лечение печеночной энцефалопатии» [2]. В отличие от европейских и американских рекомендаций в РФ любой из вышеперечисленных препаратов может быть использован в качестве терапии первой линии по усмотрению лечащего врача и анализа особенностей заболевания у конкретного пациента.
Лактулоза (лактитол) – слабительное средство, которое оказывает незначительное влияние на состав или функции кишечной микробиоты, ее эффект реализуется, вероятно, за счет ускорения кишечного транзита и подкисления кишечной среды. Вследствие этого продукция аммиака в кишечнике снижается, а его экскреция с калом увеличивается. Большое количество рандомизированных клинических испытаний, а также обсервационных исследований показали преимущество лактулозы в лечении ПЭ в сравнении с отсутствием терапии, хотя настоящих двойных слепых исследований нет, т.к. очень трудно «ослепить» слабительный эффект и типичный сладкий вкус данного препарата. Ограничением для клинического применения лактулозы служат ее побочные действия: диарея, тошнота и вздутие живота. Диарея может привести к нарушению электролитного баланса и даже к обострению ПЭ. Соответственно, прием лактулозы нужно начинать с 15–20 мл каждые 12 ч и постепенно индивидуально увеличить дозу для достижения цели: мягкий стул 2 раза в день.
Противомикробные агенты. Рифаксимин – невсасывающийся антибиотик, который вводится перорально и практически не приводит к развитию резистентности бактерий. Рифаксимин оказывает позитивное влияние на микробный состав кишки, что приводит к уменьшению продукции аммиака. Препарат имеет хороший профиль безопасности, может применяться длительно и не требует коррекции дозы у пациентов с печеночной и/или почечной недостаточностью. Лечение рифаксимином приводит к разрешению ПЭ и уменьшает летальность от данного осложнения. Комбинация рифаксимина с лактулозой эффективнее применения лактулозы в качестве монотерапии [4].
L-орнитин-L-аспартат (LOLA) изучался в большом количестве рандомизированных клинических исследований. В 2021 г. был опубликован обзор рандомизированных клинических исследований и метаанализов, в которых проанализирована эффективность LOLA у пациентов с циррозом печени в сравнении с плацебо, отсутствием какихлибо вмешательств, другими препаратами для лечения ПЭ (лактулозой, рифаксимином и т. д.). Внутривенное введение LOLA в дозе 20–40 мг в сутки в течение 7 дней в 3,22 раза, по сравнению с плацебо, улучшало психический статус пациентов с ЦП классов А и В по шкале Чайлд – Пью, уменьшало проявления ПЭ и снижало постпрандиальный уровень аммиака. Это свойство внутривенной формы препарата с успехом может использоваться в дифференциальном диагнозе ПЭ при циррозе печени с другими состояниями, которые влияют на психический статус пациентов, например синдром отмены алкоголя. Это особенно актуально в отделениях интенсивной терапии. В этой ситуации правильный диагноз строится по принципу “ex juvantibus”, поскольку гипераммониемия – ключевой фактор патогенеза ПЭ, а не синдрома отмены.
Объединенный анализ всех исследований демонстрирует эффект как внутривенной, так и пероральной формы LOLA на течение как клинически выраженной, так и скрытой ПЭ, и на уровень аммиака в крови в сравнении с плацебо/отсутствием лечения. LOLA не уступает в эффективности лечения невсасывающемуся антибиотику рифаксимину и осмотическому слабительному лактулозе [11].
В программу лечения осложнений цирроза печени входит человеческий альбумин, его способность удалять токсические соединения из циркуляции актуальна в лечении ПЭ.
Печеночная энцефалопатия (ПЭ), или портосистемная энцефалопатия, — это потенциально обратимый синдром нарушения функций головного мозга у больных с прогрессирующей печеночной недостаточностью. Однако П.Э. не является единой категорией и может отражать клинические проявления обратимой метаболической энцефалопатии, атрофии головного мозга в результате гепатоцеребральной дистрофии, отека мозга, либо любую комбинацию этих состояний. Механизмы, нарушающие функции головного мозга при печеночной недостаточности, до сих пор полностью не изучены, однако ясно, что они напрямую связаны с печеночной недостаточностью и нарушением обмена аммиака. Если основное заболевание печени не поддается лечению, ПЭ ассоциируется с плохой выживаемостью и высоким риском рецидива [1, 2]. Даже в самой мягкой форме ПЭ снижает качество жизни, обусловленное состоянием здоровья, и является фактором риска эпизодов тяжелой ПЭ [3, 4].
Патогенез
Несмотря на более чем 100-летниюю историю исследований, патогенез ПЭ до сих пор не совсем ясен. В основном это связано с трудностями изучения головного мозга пациентов с ПЭ in vivo
. Большинство опубликованных данных получены из экспериментальных моделей ПЭ, которые далеки от совершенства. Наиболее распространенные гипотезы патогенеза отражают роль нейротоксинов, нарушение нейротрансмиссии вследствие метаболических нарушений при печеночной недостаточности, изменение энергетического метаболизма мозга, аминокислотный дисбаланс, системный воспалительный ответ и нарушения проницаемости гематоэнцефалического барьера [5—7]. Различные гипотезы патогенеза ПЭ не являются взаимоисключающими. Вероятно, что многие из описанных нарушений могут воздействовать одновременно и в конечном итоге приводить к развитию ПЭ.
Нейротоксины.
Наиболее изученным нейротоксином, связанным с ПЭ, является аммиак, который образуется главным образом в желудочно-кишечном тракте и по воротной вене поступает в печень. Здоровая печень обезвреживает поступающий в нее аммиак путем преобразования в глутамин, тем самым предотвращая его проникновение в системный кровоток. При прогрессирующих заболеваниях печени увеличение концентрации аммиака в крови происходит как вследствие нарушения его преобразования печенью в глутамин, так и в результате порто-системного шунтирования, при котором кровь, минуя печень, поступает в системный кровоток [3].
При повышении концентрации аммиака в крови он проникает через гематоэнцефалический барьер и оказывает нейротоксический эффект прежде всего на астроциты, наиболее многочисленные клетки головного мозга, тесно связанные с функционированием нейронов. Ключевым механизмом развития ПЭ является отек астроцитов вследствие гипераммониемии [8—11].
Избыток аммиака приводит к накоплению образующегося в астроцитах глутамина, что сопровождается увеличением внутриклеточной осмолярности и в больших концентрациях вызывает отек мозга [12].
Нарушение нейротрансмиссии.
В патогенезе ПЭ важную роль играют нарушения функционирования нейротрансмиттеров коры головного мозга и их рецепторов. В экспериментальных моделях печеночной недостаточности изучались нарушения нескольких нейромедиаторных систем. В большинстве этих работ описаны изменения в ГАМКергической нейромедиаторной системе, допаминергических, серотонинергических и глутаматергических нейротрансмиттерных системах [13, 14]. В частности, роль ГАМКергических влияний в развитии ПЭ может быть связана с активацией бензодиазепиновых рецепторов головного мозга и связанным с этим увеличением синтеза нейростероидов [15].
Аминокислотный дисбаланс.
Важную роль в патогенезе ПЭ играет аминокислотный дисбаланс в виде увеличения уровня ароматических аминокислот (тирозина, фенилаланина, триптофана), являющихся предшественниками ложных нейротрансмиттеров, и снижением содержания аминокислот с разветвленной цепью (валина, лейцина, изолейцина). В этих условиях происходит избыточное поступление в головной мозг ароматических аминокислот, которые служат исходным продуктом для синтеза ложных нейротрансмиттеров. Эти сдвиги в составе аминокислот также сопровождаются снижением синтеза допамина, что также способствует образованию ложных нейротрансмиттеров [16].
Клиника
Клиническая картина при ПЭ представляет собой широкий спектр неспецифических неврологических и психических нарушений [17]. Признаки энцефалопатии у пациентов с хроническими заболеваниями печени зависят от этиологии основного заболевания, характера и тяжести патогенных факторов.
Выраженность ПЭ варьирует от латентной (0 стадия) и легкой степени (I стадия) до комы (IV стадия). При минимальной ПЭ она проявляется преимущественно нарушениями абстрактного мышления и общим негрубым снижением когнитивных функций без нарушений памяти, интеллекта, речи, способности к обучению, которые остаются сохранными в течение длительного времени [18, 19]. У некоторых больных с печеночной недостаточностью в течение ряда лет выявляют лишь нарушения высших функций мозга без какой-либо иной неврологической симптоматики [20].
По мере прогрессирования ПЭ нарастают изменения личности, такие как апатия, раздражительность и снижение контроля над поведением, а также появляются явные изменения в сознании и двигательной функции [21]. Часто наблюдаются нарушения цикла сна и бодрствования с чрезмерной сонливостью в дневное время, хотя полное нарушение цикла сна и бодрствования обычно отсутствует [22—24]. С нарастанием печеночной недостаточности развивается прогрессирующая дезориентация во времени и пространстве, нарушение поведения, возникают эпизоды спутанности сознания с возбуждением или сонливостью, ступор и, наконец, кома [25]. В консенсусе Международного общества по печеночной энцефалопатии и азотистому обмену (International Society for Hepatic Encephalopathy and Nitrogen Metabolism — ISHEN) появление дезориентации или астериксиса («хлопающего» тремора) рассматривают как начальные признаки явной ПЭ [26].
У некоматозных пациентов с ПЭ наблюдают нарушение двигательных функций, такие как мышечную гипертонию, гиперрефлексию и положительный рефлекс Бабинского. С развитием комы глубокие сухожильные рефлексы обычно уменьшаются [27] и даже исчезают, хотя пирамидные знаки могут сохраняться. Иногда может возникать очаговый неврологический дефицит [28]. Судороги при ПЭ наблюдаются очень редко [29—31].
Частыми проявлениями заболевания являются экстрапирамидные нарушения в виде гипомимии лица, ригидности мышц, брадикинезии, гипокинезии, монотонности и замедления речи, паркинсоноподобного тремора и дискинезия с ограничением произвольных движений [27].
Астериксис («хлопающий тремор») часто отмечают в начальных и средних стадиях ПЭ, которые предшествуют ступору или коме. В действительности он является не тремором, а отрицательным миоклонусом и вызывается гиперэкстензией запястья пациента с разведенными пальцами. Примечательно, что психические и моторные нарушения при ПЭ могут быть выражены незначительно или не прогрессируют одинаково у разных пациентов, что приводит к трудностям в определении стадии ПЭ.
Классификация
Согласно практическим рекомендациям Американской ассоциации изучения болезней печени и Европейской ассоциации по изучению печени [32] ПЭ классифицируют по четырем признакам: в зависимости от причин, которые привели к ее развитию; по длительности и характеру течения; по тяжести течения (стадиям) и в зависимости от наличия провоцирующих (триггерных) факторов.
А — печеночная энцефалопатия в результате острой печеночной недостаточности;
В — портосистемное шунтирование в отсутствие цирроза печени (ЦП);
С — печеночная энцефалопатия у больных, страдающих циррозом.
Классификация ПЭ по длительности и характеру течения:
1) эпизодическая ПЭ;
2) рецидивирующая ПЭ — это приступы ПЭ, которые происходят с временным интервалом 6 мес или меньше;
3) персистирующая ПЭ представляет поведенческие нарушения, которые присутствуют постоянно и перемежаются с рецидивами явной ПЭ.
Классификация тяжести течения ПЭ по стадиям (шкала West Haven)
I. Минимальная (латентная) стадия: отчетливая клиническая симптоматика отсутствует, но отмечается нарушение стандартизированных психомоторных тестов (теста связи чисел, теста линии).
II. Первая (легкая) стадия: апатия, возбуждение, раздражительность, беспокойство, эйфория, быстрая утомляемость, нарушения ритма сна и бодрствования, легкий тремор, нарушение координации движений, астериксис.
III. Вторая (средняя) стадия: сонливость, летаргия, дезориентация во времени и пространстве, неадекватность поведения, астериксис, дизартрия, атаксия.
IV. Третья (тяжелая) стадия: сопор, выраженная дезориентация, нечеткая речь, гиперрефлексия, наличие патологических рефлексов (Гордона, Жуковского), миоклония, гипервентиляция.
V. Четвертая стадия: печеночная кома, децеребрационная ригидность, окулоцефалический феномен, отсутствие ответа на любые раздражители.
В зависимости от наличия провоцирующих (триггерных) факторов ПЭ подразделяют на непровоцируемую и провоцируемую (в данном случае должен быть указан провоцирующий фактор). Провоцирующие факторы (инфекции, желудочно-кишечное кровотечение, передозировка диуретиков, электролитные нарушения, запор) целесообразно выявлять для всех эпизодов ПЭ типа С и устранять в случае их наличия.
Диагностика
Диагностика явной ПЭ
Диагноз явной ПЭ основан на объективном клиническом обследовании. Оно предусматривает оценку симптомов ПЭ, а также исключение других причин нарушения функции головного мозга. В клинической картине у пациентов с явной ПЭ имеются симптомы заболеваний гепатобилиарной системы, например у большинства больных развитию ПЭ предшествует желтуха. Часто у пациентов с энцефалопатией можно выявить «печеночный» запах и гипервентиляцию [33]. Также диагноз ПЭ подтверждается выявлением провоцирующих факторов (инфекции, кровотечения и запоры и т. д.).
«Золотым стандартом» диагностики явной ПЭ являются критерии West-Haven, однако они имеют ограниченную диагностическую ценность из-за субъективности оценок, особенно при ПЭ I стадии, так как легкая гипокинезия, психомоторная заторможенность и рассеянность могут быть пропущены при клиническом осмотре. Ведущими диагностическими симптомами явной ПЭ является наличие у пациента дезориентации и астериксиса [32].
Для описания состояния пациентов со значительно измененным сознанием рекомендуется использовать шкалу оценки глубины комы Глазго (Glasgow Coma Scale — GCS). Шкала Глазго предусматривает подсчет баллов, отражающих выраженность реакции больного на раздражители. Определяют способность к открыванию глаз, характер двигательной и вербальной реакций на простые стимулы (голосовое обращение и боль). Коме предшествуют менее глубокие формы угнетения сознания: спутанность сознания, сопор и ступор.
Диагностика минимальной ПЭ
Минимальная ПЭ определяется как нарушения функций головного мозга, выявляемое с помощью тестов у пациентов с хроническим заболеванием печени, у которых нет дезориентации или не развился астериксис. Обследование таких пациентов может включать два основных вида тестов: психометрические и нейрофизиологические. ISHEN рекомендует использовать по крайней мере два теста, в зависимости от их доступности и местных условий. Важность тестирования на наличие минимальной ПЭ заключается в том, что это позволяет прогнозировать развитие явной ПЭ.
Для диагностики минимальной ПЭ рекомендуется проведение нейрофизиологических и психометрических тестов, среди которых наибольшую значимость имеют как простые, выполняемые на бумаге при помощи ручки (психометрическая шкала ПЭ), так и компьютеризированные (тест задержки времени реакции, тест Струпа, тест ингибиторного контроля и SCAN-тест) и нейрофизиологические (тест критической частоты слияния мельканий) тесты [32]. Электроэнцефалография позволяет выявлять изменения в корковой активности мозга при ПЭ, однако этот метод недостаточно специфичен, так как на него могут влиять сопутствующие метаболические нарушения и прием лекарственных средств.
Лабораторные тесты.
У пациентов с ПЭ выявляются сывороточно-биохимические печеночные синдромы различной степени выраженности в зависимости от преимущественной направленности патологических процессов в печени [34].
Синдром цитолиза, или синдром повреждения гепатоцитов (нарушение целостности, некроз гепатоцитов), характеризуется прежде всего повышением аминотрансфераз (аспартат- и аланинаминотрансфераза), а также других ферментов — лактатдегидрогеназы-5, альдолазы, орнитинкарбамилтрансферазы, сорбитдегидрогеназы, глутаматдегидрогеназы.
Синдром холестаза характеризуется повышением билирубина, главным образом, конъюгированного (прямого), щелочной фосфатазы, гамма-глутамилтранспептидазы, 5-нуклеотидазы, холестерина и желчных кислот.
Синдром воспаления характеризуется повышенным содержанием различных фракций глобулинов, диспротеинемией, повышением содержания сывороточных иммуноглобулинов.
В рекомендациях AASLD/EASL [32] отмечается, что у пациентов с хроническим заболеванием печени диагностическую или прогностическую ценность имеет только высокий уровень аммиака в крови. Однако если содержание аммиака находится в пределах нормальных значений, диагноз ПЭ вызывает сомнения. Повторные измерения уровня аммиака могут применяться для оценки эффективности лечения в случаях приема пациентами лекарств, снижающих уровень аммиака.
Компьютерная или магнитно-резонансная томография и другие методы визуальной диагностики не дают полной диагностической информации и имеют ограниченную ценность. В основном они используются для исключения структурных повреждений головного мозга у больных ЦП.
Дифференциальный диагноз
Рекомендации AASLD/EASL указывают на необходимость исключения других заболеваний, которые могут напоминать ПЭ [32]:
1) сахарный диабет (гипогликемическая, гипергликемическая и гиперосмолярная комы, лактатацидоз);
2) злоупотребление алкоголем (интоксикация, синдром отмены, синдром Вернике);
3) передозировка лекарственных препаратов (бензо-диазепинов, нейролептиков, опиоидов);
4) нейроинфекции и электролитные нарушения (гипонатриемия, гиперкальциемия);
5) бессудорожная эпилепсия, психические заболевания;
6) внутримозговое кровоизлияние и ишемический инсульт;
7) деменция (первичная и вторичная);
 повреждение головного мозга (травматическое, неопластическое, нормотензивная гидроцефалия, синдром обструктивного апноэ сна).
повреждение головного мозга (травматическое, неопластическое, нормотензивная гидроцефалия, синдром обструктивного апноэ сна).
Лечение
Лечение ПЭ включает устранение провоцирующих факторов, диетические мероприятия и медикаментозную терапию. Устранение провоцирующих факторов является первоочередной задачей в лечении явной ПЭ, поскольку у 90% пациентов этого оказывается достаточно для улучшения состояния [32].
Диета
Коррекция нарушений белково-азотистого обмена имеет решающее значение в лечении всех степеней ПЭ, так как у 75% пациентов с ПЭ имеется белково-калорийная недостаточность средней или тяжелой степени, сопровождающаяся потерей мышечной массы. Длительное ограничение потребления белка вредно для больных ПЭ, так как потребность в белке у этих пациентов относительно выше, чем у здоровых лиц.
Поэтому, согласно рекомендациям AASLD/EASL, суточное потребление энергии следует поддерживать на уровне 35—40 ккал на 1 кг массы тела, а ежедневное потребление белка — в пределах 1,2—1,5 г/кг [32]. Ограничение потребления белка рекомендуется только в течение первых нескольких дней с момента развития ПЭ, но потом от этой меры следует отказаться. Белки животного происхождения следует замещать молочным и растительным белком, а также потреблять пищу, обогащенную аминокислотами с разветвленной боковой цепью.
Медикаментозная терапия
Медикаментозная терапия является важной частью лечения явной П.Э. При минимальной ПЭ в отсутствие ее клинических проявлений фармакотерапия, как правило, не применяется. В то же время она может назначаться этой категории пациентов в случаях заметного влияния минимальной ПЭ на качество жизни. Для коррекции ПЭ могут использоваться различные лекарственные средства (невсасывающиеся дисахариды, антибиотики, аминокислоты с разветвленной боковой цепью, L-орнитин- L-аспартат) с разным уровнем доказательств эффективности.
Невсасывающиеся дисахариды.
Лактулоза — синтетический дисахарид, который препятствует образованию аммиака. Лактулоза является препаратом первого выбора в лечении явной П.Э. Сироп лактулозы назначают по 25 мл каждые 1—2 ч до появления по крайней мере 2 дефекаций мягким или неоформленным стулом на протяжении суток. В дальнейшем доза препарата титруется индивидуально для поддержания 2- или 3-кратного опорожнения кишечника в течение суток [35]. Прием чрезмерно высоких доз лактулозы может привести к таким осложнениям, как аспирация, дегидратация, гипернатриемия, раздражение перианальных кожных покровов, а в некоторых случаях даже усугубить течение ПЭ [36].
Антибиотики.
Рифаксимин — невсасывающийся антибиотик, угнетающий аммониегенную протеолитическую бактериальную микрофлору кишечника [37]. Результаты ряда исследований показали эффективность рифаксимина в лечении П.Э. Согласно рекомендациям AASLD/EASL [32], рифаксимин является эффективным дополнением к лактулозе для профилактики рецидива явной ПЭ. В сравнительных исследованиях 3—6-месячная терапия рифаксимином способствовала улучшению когнитивных функций и снижению уровня аммониемии у пациентов с ПЭ [38]. Рифаксимин назначают в дозе 200—400 мг 2—3 раза/сут (1200 мг/сут) в течение 5—7 (до 14) дней.
Из других антибиотиков для лечения ПЭ по-прежнему применяется неомицин, для краткосрочной терапии может использоваться метронидазол, однако из-за побочных эффектов долгосрочное применение этих препаратов ограничено [39, 40].
Аминокислоты с разветвленными цепями.
В ряде исследований показана эффективность лечебного питания с потреблением пищи, обогащенной аминокислотами с разветвленной боковой цепью [15]. Благодаря преимущественному усвоению этих аминокислот, уменьшается относительное содержание ароматических аминокислот, служащих предшественниками ложных нейромедиаторов. Кроме того, аминокислоты с разветвленной боковой цепью способствуют увеличению мышечной массы, в результате чего усиливается детоксикация аммиака, которая частично происходит в скелетной мускулатуре. Рекомендации AASLD/EASL предусматривают только пероральный прием аминокислот с разветвленными цепями в качестве альтернативного или дополнительного средства лечения пациентов, не ответивших на традиционную терапию [41, 42].
L-орнитин-L-аспартат (LOLA).
Так как орнитин и аспартат играют основную роль в превращении аммиака в мочевину, прием LOLA способствует уменьшению клинических проявлении ПЭ. В течение последних 10 лет проведено несколько рандомизированных исследований, результаты которых показали высокую эффективность и безопасность применения этого препарата в лечении ПЭ [43]. LOLA выпускается в виде раствора для внутривенной инфузии и в форме гранулята для перорального приема. Стандартная схема применения предусматривает внутривенное капельное введение 20—30 г препарата в течение 7—14 дней с последующим переходом на пероральный прием 9—18 г/сут. Для достижения более быстрого и стойкого результата возможна комбинация внутривенного и перорального способов введения.
Флумазенил
— антагонист бензодиазепиновых рецепторов, непосредственно воздействующий на функции центральной нервной системы. Флумазенил применяется довольно редко, так как давая кратковременный эффект восстановления сознания, способствует лишь транзиторному улучшению психического состояния, но не влияет на выздоровление и показатели выживаемости [15].
Эффективность проводимой терапии определяется по обратному развитию клинической симптоматики.
При острой печеночной недостаточности с развитием печеночной комы и отека мозга лечение проводят в отделении интенсивной терапии с использованием тех же фармакопрепаратов, что и при хронической печеночной недостаточности, но в более высоких дозах.
Трансплантация печени при циррозе с рецидивирующей, плохо поддающейся консервативной терапии ПЭ позволяет увеличить продолжительность жизни больных. Средняя 5-летняя выживаемость больных после трансплантации превышает 72% [15].
Авторы заявляют об отсутствии конфликта интересов.
Прогноз и профилактика болезни
Прогноз развития заболевания хоть и зависит от целого комплекса факторов, но практически всегда негативный. Выживаемость пациентов выше, если заболевание развилось на фоне хронических патологий печени. При циррозе прогноз серьезно ухудшается в случае наличия желтухи и асцита.
При острой печеночной недостаточности прогноз развития заболевания ухудшается у детей до 10 лет и взрослых после 40 лет на фоне вирусного заражения. Смертность на первых двух стадиях достигает 30%, а на последних превышает 80%.
Профилактика сводится к нормализации образа жизни, отказа от избыточного приема лекарственных средств и своевременного лечения заболеваний, провоцирующих развитие энцефалопатии.
В связи с тем, что летальность заболевания напрямую зависит от стадии его развития, огромное значение достигает своевременное выявление заболевания. Для этого важно при малейших подозрениях на наличие болезни обратиться за консультацией к специалисту, а также сделать КТ и МРТ. Пройти диагностику можно в одной из клиник, размещенных в базе сервиса . Сайт собрал в себе информацию о сотнях диагностических клиник. Консультант готов по телефону помочь с выбором клиники и записать на удобную дату.