Оценка эффективности даларгина в лечении постгастрорезекционного панкреатита
УДК 616.3-089-06:616.37-002-08:615.243
Изучена эффективность даларгина в комплексной терапии хронического панкреатита, развившегося после резекции желудка у больных язвенной болезнью. Показано положительное влияние даларгина на клиническое течение заболевания и функциональное состояние поджелудочной железы. Авторы связывают это с восстановлением микроциркуляции и антиоксидантным действием препарата. Согласно данным отдаленных наблюдений, эффект терапии сохранялся в течение года.
Evaluation of dalargin effectiveness in the treatment of postgastroresectional pancreatitis
The efficacy of dalargin in the treatment of chronic pancreatitis, which developed after stomach resection in patients with peptic ulcer disease, was investigated. The positive effect of dalargin on the clinical course of disease and the functional state of the pancreas was found. The authors attribute this to the restoration of microcirculation and antioxidant action of the drug. According to long-term observations the effect of therapy was maintained throughout the year.
Резекция желудка остается в числе основных оперативных вмешательств при осложненной язвенной болезни желудка и двенадцатиперстной кишки [1]. Однако после резекции желудка у 14,3-24,1% больных развивается постгастрорезекционный панкреатит (ПП) [2, 3]. Это может быть следствием выключения антральной гормональной зоны и двенадцатиперстной кишки, играющих важную роль в координации деятельности пищеварительной системы [4, 5], а также результатом высокой нагрузки на поджелудочную железу (ПЖ) в связи с ее компенсаторно-приспособительной функцией после резекции желудка. Длительный болевой синдром и развитие внешнесекреторной панкреатической недостаточности существенно снижают качество жизни пациентов, требуют серьезной медикаментозной терапии.
В последние годы в коррекции различных патологических процессов, в том числе в ПЖ, рекомендуются природные пептиды и их синтетические аналоги. Одним из таких регуляторных пептидов является аналог лей-энкефалина даларгин [6, 7]. Проведенные в стационарных условиях клинические испытания даларгина продемонстрировали его высокую активность в лечении обострений язвенной болезни желудка и двенадцатиперстной кишки [8]. Положительный терапевтический эффект препарата отмечен у больных острым панкреатитом [6, 7].
Цель нашей работы — изучение особенностей изменений функционального состояния ПЖ после резекции желудка и обоснование использования даларгина в лечении больных ХП.
Материалы и методы. Под наблюдением находилось 50 больных язвенной болезнью желудка и двенадцатиперстной кишки после резекции желудка с развившимся впоследствии ПП, из них у 27 больных проведена резекция — по Бильроту-1 и у 23 — по Бильрот-2. Исследование больных проводилось в сроки от 1 до 31 года после оперативного вмешательства. Больные были в возрасте от 26 до 71 года. Мужчин было 45 (90%), женщин — 5 (10%). Длительность заболевания язвенной болезнью до операции составила от 1 до 39 лет.
Пациенты были разделены на 2 группы, сопоставимые по возрасту, тяжести течения, выраженности болевого синдрома, длительности течения панкреатита, по частоте сопутствующей патологии: 25 больных группы наблюдения получали в комплексной терапии даларгин ежедневно в дозе 1 мг внутримышечно 2 раза в день, курсовая доза даларгина составляла 20-30 мг; 25 больных группы сравнения получали традиционную терапию, включающую спазмолитики, М-холинолитики, ингибиторы протонной помпы, ферментные препараты.
Диагноз ставился на основании анамнестических, объективных и лабораторных данных, данных ультрасонографии, фиброгастродуоденоскопии, интрагастральной рН-метрии и компьютерной томографии. Экзокринную функцию ПЖ оценивали по уровню амилазы, липазы и трипсина в сыворотке крови, диастазы мочи; эндокринную функцию — по уровню инсулина и С-пептида в сыворотке крови. Амилазу в сыворотке крови и диастазу в моче определяли методом Каравея, липаза определялась унифицированным методом. Трипсин, инсулин и С-пептид, а также ТТГ, Т3, Т4, кортизол и гастрин в сыворотке крови определялись радиоиммунологическим методом. Активность процессов перекисного окисления липидов определяли по уровню малонового диальдегида (МДА) в сыворотке крови. Состояние микроциркуляции оценивали с помощью конъюнктивальной биомикроскопии на щелевой лампе ЩЛ 2Б БП по методу В.С. Волкова (1977).
Результаты лабораторно-инструментальных исследований больных сравнивали с данными 15 практически здоровых лиц. Данные обрабатывались методом вариационной статистики, для оценки межгрупповых различий применяли t-критерий Стьюдента, для выявления зависимости между показателями — метод корреляционного анализа.
Результаты и их обсуждение
В процессе комплексной терапии с применением даларгина полностью удалось снять болевые ощущения у 21 (84%) из 25 больных. Уменьшение болевого синдрома отмечено в основном к 3–4-му дню терапии, а исчезновение — на 5–6-й день. При традиционной терапии удалось снять полностью болевой синдром у 72% больных, уменьшение болевого синдрома происходило в основном к 5–7-му дню лечения.
Комплексная терапия с применением даларгина способствовала уменьшению или устранению диспепсических жалоб. Наиболее быстро в группе наблюдения исчезали тошнота, чувство тяжести и распирания в подложечной области. Несколько медленнее проходила отрыжка. Улучшение аппетита отмечено у 80% обследуемых группы наблюдения. Даларгин способствовал нормализации стула у больных: запоры прошли у всех больных, кашицеобразный стул стал оформленным. В группе сравнения тошнота, вздутие живота проходили или уменьшались медленнее.
Применение даларгина отчетливо снимало болезненность при пальпации брюшной стенки у 84% больных, в частности, в области проекции ПЖ, в зоне Шоффара, Губергрица — Скульского, но несколько позже обратного развития спонтанного болевого синдрома.
У больных группы наблюдения базальный уровень амилазы крови был повышенным в 17,85% случаев, пониженным — в 21,4% случаев. В группе сравнения повышенный уровень амилазы в сыворотке крови выявлен в 37,5% случаев, пониженный — в 37,5%. У всех больных с недостаточной секреторной функцией ПЖ при ультразвуковом исследовании выявлено повышение эхогенности структуры органа, что указывает на развитие склеротических процессов в ткани железы как результат ранее перенесенных обострений заболевания.
В процессе лечения мы наблюдали разнонаправленную динамику уровней ферментов крови (рис. 1, 2).
Рисунок 1. Динамика содержания амилазы с исходно повышенным уровнем в процессе терапии даларгином (I) и традиционным лечением (II)
Примечание: * — достоверность по отношению к исходному уровню;
**— достоверность по отношению к здоровым (p<0,05)
Рисунок 2. Динамика амилазы с исходно пониженным уровнем в процессе терапии даларгином (I) и традиционным лечением (II)
Примечание: * — достоверность по отношению к исходному уровню;
**— достоверность по отношению к здоровым (p<0,05)
У больных с повышенным содержанием амилазы в крови уровень ее достоверно снизился в процессе лечения в обеих группах, у больных с пониженным базальным уровнем амилазы крови отмечено его повышение в процессе курсового лечения даларгином, изменение уровня амилазы в группе сравнения было несущественным (рис. 2).
Повышение уровня амилазы можно объяснить стимулирующим действием даларгина на клетки ПЖ. Даларгин стимулирует процессы клеточного деления и синтеза ДНК, устраняет развитие эритростазов и микротромбозов, улучшает микроциркуляцию в ПЖ, предупреждает развитие межацинарного и внутриклеточного отека в неповрежденном сегменте железы [9-11].
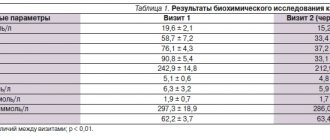
При исследовании трипсина в сыворотке крови выявлено повышение его у всех обследованных больных ПП. В ходе терапии концентрация трипсина в крови в обеих группах достоверно снижалась (табл.1). Активность липазы у обследованных больных исходно была повышена и в процессе лечения уменьшилась в обеих группах пациентов.
Таблица 1.
Динамика уровня липазы и трипсина в крови больных ПП в процессе терапии
| Обследованные группы | Период исследования | Липаза (ед.) | Трипсин (нг/мл) |
| Группа сравнения | до лечения | 1,24±0,11* (n=11) | 620,2±9,8* (n=10) |
| после лечения | 0,64±0,09** (n=10) | 510,9±11,6** (n=11) | |
| Группа наблюдения | до лечения | 1,27±0,12* (n=9) | 840,6±9,8* (n=10) |
| после лечения | 0,5±0,07** (n=8) | 380,8±11,1** (n=9) | |
| Здоровые | 0,78±0,14 (n=10) | 225,6±17,2 (n=10) | |
Примечание: n — количество обследованных;
* — достоверность по отношению к здоровым (p<0,05),
** — достоверность по отношению к исходному уровню
По данным копрологических исследований, у 23 больных (46%) отмечена амилорея, у 12 (24%) — креаторея и у 7 (14%) — стеаторея. В процессе терапии отмечается положительная динамика копрограммы: в группе сравнения количество больных с креатореей уменьшилось на 50%, с амилореей — с 13 до 7 человек, со стеатореей — с 4 до 2 человек; в группе наблюдения количество больных с креатореей уменьшилось с 6 до 2 человек, с амилореей с 10 до 4 человек и со стеатореей — с 3 до 1 человека.
Как показывают данные табл. 2, у 55,8% больных содержание инсулина в крови было повышено в сравнении со здоровыми лицами, а у 33,2% больных отмечено снижение его уровня. Снижение базального уровня инсулина было отмечено у больных со склеротическими изменениями ПЖ, установленными при эхографии. Секреция инсулина как с исходным низким, так и с исходно повышенным его уровнем незначительно увеличивалась в обеих группах больных в ходе лечения.
Таблица 2.
Динамика уровня инсулина в крови больных ПП в процессе терапии (мкед/мл)
| Группа обследованных | Уровень инсулина | До лечения | После лечения |
| Группа сравнения | Исходно снижен | 6,02±0,86 (n=8) | 6,92±0,41 (n=9) |
| Исходно повышен | 16,25±1,25* (n=12) | 17,73±1,0 (n=10) | |
| Группа наблюдения | Исходно снижен | 5,93±0,56* (n=7) | 6,46±0,41 (n=8) |
| Исходно повышен | 12,88±1,06* (n=13) | 14,52±0,96 (n=11) | |
| Здоровые | 8,83±0,96 (n=10) | ||
Примечание: n — количество обследованных;
* — достоверность по отношению к здоровым (p<0,05)
Способность ПЖ вырабатывать инсулин в полной мере отражает определение концентрации С-пептида в сыворотке крови [12]. Нами не выявлено существенных отличий уровня С-пептида у обследованных больных от здоровых лиц: в контрольной группе он составил 0,3±0,09 пмоль/мл, в группах наблюдения и сравнения — 0,37±0,06 пмоль/мл и 0,34±0,03 пмоль/мл соответственно. В ходе терапии в обеих группах отмечена тенденция к росту концентрации С-пептида в сыворотке крови. Повышение уровней инсулина и С-пептида можно связать со стимулирующим действием терапии на островковую ткань, улучшением метаболизма ткани ПЖ, восстановлением микроциркуляции. Так, по данным биомикроскопии конъюнктивы, в группе наблюдения конъюнктивальный индекс достоверно уменьшился с 6,23±0,68 до 4,21±0,28 (у здоровых он был 1,88±0,23) и в группе сравнения имел тенденцию к снижению (с 6,26±0,66 до 5,33±0,44).
Уровень гастрина у обследованных нами больных был достоверно выше в сравнении со здоровыми лицами (табл. 3). Повышение содержания гастрина в крови возможно обусловлено не только атрофическими поражениями слизистой культи желудка, сопровождающимися низкой концентрацией соляной кислоты, но и высоким содержанием трипсина в крови, способствующего образованию активного гастрина [13]. Установлена зависимость изменений уровня гастрина от вида проводимой терапии. Так, в группе сравнения отмечалась тенденция к повышению его уровня, а в ходе лечения даларгином — тенденция к его снижению.
Таблица 3.
Динамика уровня гормонов в крови больных постгастрорезекционным панкреатитом в процессе терапии
| Группа обследованных | Период исследования | Кортизол (нмоль/л) | Гастрин (нг/л) | Т3 (нмоль/л) | Т4 нмоль/л) | ТТГ (мед/л) |
| Группа сравнения | до лечения | 483,6±19,7* (n=12) | 66,86±7,5 (n=9) | 1,58±0,13 (n=11) | 118,2±9,8 (n=10) | 1,81±0,32 (n=8) |
| после лечения | 398,9±23,8 (n=9) | 71,95±4,9 * (n=10) | 1,81±0,17 (n=10) | 99,9±11,6 (n=11) | 1,7±0,29 (n=7) | |
| Группа наблюдения | до лечения | 480,3±21,7* (n=10) | 76,3±3,8* (n=7) | 1,8±0,09 (n=9) | 120,6±9,8 (n=10) | 2,31±0,41 (n=7) |
| после лечения | 461,2±18,0* (n=11) | 61,2±5,7 (n=13) | 2,01±0,2 (n=8) | 118,8±11,1 (n=9) | 2,1±0,34 (n=6) | |
| Здоровые | 364,75±22,3 (n=15) | 52,8±3,91 (n=15) | 1,82 ±0,14 (n=10) | 124,68±17,2 (n=10) | 2,19±0,47 (n=10) | |
Примечание: n — число наблюдений;
* — достоверность по отношению к здоровым (р<0,05)
По нашим данным, базальный уровень кортизола у больных был выше, чем у здоровых (табл. 3). В процессе лечения в обеих группах больных наблюдалась тенденция к снижению уровня кортизола в крови. Учитывая, что кортизол является одним из стрессовых гормонов [12, 14, 15], мы склонны считать, что гиперкортизолемия у больных в большей мере имела стрессовое происхождение и уменьшалась с купированием болевого синдрома.
У больных базальный уровень Т3 был ниже, а в содержании Т4 существенных изменений не отмечено (табл. 3). В процессе лечения в обеих группах больных наблюдалось увеличение уровня Т3. Уровень ТТГ у больных ПП практически не отличался от здоровых лиц. Проводимая терапия в обеих группах больных приводила к снижению его концентрации в крови.
Содержание МДА в крови, указывающего на активность процессов перекисного окисления липидов, в обеих группах больных было повышено по сравнению со здоровыми. После проведенного курса терапии даларгином количество его в крови уменьшилось с 9,05±0,51 до 6,48±0,44 ммоль/л (р<0,05), в то время как в группе больных, получавших традиционную терапию оно изменялось несущественно. Это мы связываем с выраженным антиоксидантным действием даларгина.
Для оценки эффективности терапии, по данным отдаленных результатов, нами проведено наблюдение за 31 больным в течение двух лет после курса терапии, при этом 15 больных были из группы наблюдения, а 16 пациентов — из группы сравнения. После стационарного лечения больные находились на диспансерном учете. Рецидивы заболевания наступили в течение двух лет в группе сравнения у 9 (56,3%), а у больных группы наблюдения обострение заболевания отмечено у 6 (40%). При этом рецидивы заболевания в группе сравнения чаще наступали в первые месяцы после выписки из стационара и в целом в течение года частота их составила 43,8%. В группе наблюдения рецидивы заболевания возникали на 2-м году после стационарного лечения.
Причиной наступления рецидива заболевания большинство больных (39,5%) отметило нарушение режима питания, физические нагрузки и нервно-психическое перенапряжение. В группе сравнения из 9 больных с обострением ПП 7 больным (77,8%) было проведено стационарное лечение, тогда как в группе наблюдения стационарно пролечено 3 (50%) из 6 больных.
Выводы
1. При включении даларгина в состав комплексной терапии у больных ПП ликвидируются или уменьшаются болевой синдром и диспепсические явления, одновременно отмечается ряд положительных изменений и со стороны функционального состояния ПЖ.
2. В ходе терапии происходит снижение повышенного уровня гастрина и кортизола в периферической крови.
3. Выявлена выраженная антиоксидантная активность даларгина, что может являться одним из патогенетических механизмов его лечебного действия.
4. Применение даларгина при ПП по данным ближайших и отдаленных наблюдений превосходило по эффективности традиционную терапию.
Я.И. Григус, О.Д. Михайлова, В.Ф. Булычев, А.Ю. Горбунов
Ижевская государственная медицинская академия
Григус Ян Ильич — кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней с курсом сестринского дела
Литература:
1. Жижин Ф.С., Капустин Б.Б. Однорядный антирефлюксный анастомоз при трубчатой резекции желудка // Материалы конфер. «Актуальные аспекты госпитальной хирургии». — Ижевск, 2000. — С. 21-24.
2. Помелов В.С., Барамидзе Г.Г. Диагностика, профилактика и лечение постгастрорезекционного рефлюкс-гастрита // Хирургия. — 1994.— № 5. — С. 32-35.
3. Вахрушев Я.М., Иванов Л.А. Постгастрорезекционные синдромы. — Ижевск, «Экспертиза», 1998. — 139 с.
4. Уголев А.М. Энтериновая (кишечная гормональная) система. — Наука, Л., 1978, 315 с.
5. Вахрушев Я.М. Новые подходы к изучению функциональных связей желудочно-кишечного тракта с железами внутренней секреции // Тер. архив. — 1985. — № 9. — С. 98-102.
6. Георгадзе А.К., Бузенков С.В., Джакия А.К. и др. Особенности диагностики и лечения жирового панкреонекроза // Хирургия. — 1991. — № 4. — С. 11-14.
7. Пенин В.А., Титов М.И., Титов В.Н. и др. Механизм действия и перспективы применения нового отечественного аналога энкефалина — даларгина в комплексном лечении острого панкреатита // Сб. науч. трудов «Острый панкреатит». — Москва, ММСИ, 1986. — С. 20-25.
8. Алексеенко С.А., Тимошин С.С. Влияние блокаторов Н2-рецепторов гистамина и даларгина на репаративные процессы слизистой оболочки гастродуоденальной системы у больных язвенной болезнью двенадцатиперстной кишки // Клин. мед. — 1996. — № 9. — С. 52-54.
9. Титов М.И., Виноградов В.А., Беспалов Т.Д. и др. Даларгин — пептидный препарат с цитопротективным действием // Бюлл. ВКНЦ АМН СССР. — 1985. — № 2 — С. 72-76.
10. Виноградов В.А., Полонский В.М. Даларгин — наиболее активный синтетический аналог эндогенных опиоидов для лечения язвенной болезни (итоги пятилетнего поиска) // Бюлл. ВКНЦ АМН СССР. — 1986. — № 2. — С. 62-63.
11. Иваников И.О., Виноградов В.А. Результаты применения даларгина при панкреатите // Матер. конф. ВНОГ. — Смоленск, 1991. — С. 224-226.
12. Вахрушев Я.М., Трусов В.В., Виноградов Н.А. Печень и гормоны. — Ижевск, 1992. — 112 с.
13. Trefflot M.J., Laugier R., Brethols A. et al. Increased gastrin release in chronic calcifying pancreatitis and in chronic alcoholism // Horm. Metab. Res. — 1980. — № 12. — Р. 240.
14. Клиническая эндокринология (Руководство для врачей) / под ред. Н.Т. Старковой. — М.: Медицина, 1991. — 512 с.
15. Михайлова О.Д. Эндогенная интоксикация при хроническом панкреатите // Рос. журнал гастроэнтерологии, гепатологии и колопроктологии. — 2010. — № 5. — С. 65.
Новые возможности в противоболевой и заместительной терапии хронического панкреатита.
Елена Александровна Полуэктова, врач, кандидат медицинских наук:
– Мы возвращаемся к гастроэнтерологии, и сообщение сделает доктор медицинских наук, профессор Олег Самуилович Шифрин «Новые возможности в противоболевой и заместительной терапии хронического панкреатита».
Олег Самуилович Шифрин, профессор, доктор медицинских наук:
– Глубокоуважаемые коллеги, рабочей группой Российской гастроэнтерологической ассоциации были разработаны рекомендации по ведению пациентов с хроническим панкреатитом. Обратите внимание, красным цветом обозначены очень важные принципиальные положения, которые должен учитывать врач в ведении подобного рода пациентов. Это определение причины боли, абдоминальной боли при хроническом панкреатите и ее лечение. Вторым важным направлением выступает лечение внешнесекреторной недостаточности поджелудочной железы. Вот эти вопросы и положены в основу моего сообщения.
Итак, при дебюте хронического панкреатита абдоминальная боль занимает очень важное место, это кардинальный признак. Она встречается гораздо чаще, чем проявления внешнесекреторной недостаточности, симптомы панкреатогенного диабета, желтуха и прочее. Почти у 90% больных при различных формах панкреатита, независимо от этиологии, боль занимает центральное ведущее место при дебюте заболевания. При развернутой стадии заболевания на первый план может выступать внешнесекреторная недостаточность, и это важно учитывать.
Клинический пример. К нам в клинику обратился мужчина 54 лет с жалобой на выраженные абдоминальные боли в верхних отделах живота полуопоясывающего характера, чаще возникающие где-то через 30-40 минут после еды, на выраженное мучительное вздутие живота и на появившуюся диарею (неоформленный стул где-то 2-3 раза в день). Следует отметить, что пациент в течение 2-3 десятков лет злоупотреблял алкоголем, выпивал где-то 2-3 бутылки крепких спиртных напитков в неделю, много курил. Индекс курильщика 240 баллов. Мы остановимся чуть позже на взаимодействии этих двух крайне важных панкреотоксических факторов: алкоголь и курение.
Итак, в анализах мочи у пациента выявлялся 2-3-кратный уровень гиперамилазурии. Терапия дротаверином, блокаторами секреции, фесталом оказалась неэффективна.
Какие вопросы следует поставить, берясь лечить данного пациента? Во-первых, следует уточнить диагноз: панкреатит ли это. Не секрет, что панкреатит, к сожалению, очень часто как недодиагностируется, так и гипердиагностируется. Далее, при подтверждении диагноза надо поставить вопрос: какой это панкреатит? Очень важно определить этиологию и морфологическую форму заболевания. Необходимо выявить, выделить основные клинические синдромы заболевания. И, наконец, при наличии абдоминальной боли, а у нашего пациента выраженная абдоминальная боль, следует установить ее характер. Это принципиально важно в дальнейшем при назначении оптимальной терапии.
Следует сказать, что по Хайдельбергской классификации, так называемой классификации M-ANNHEIM, немецкие коллеги выделяют полиэтиологичную чаще всего причину развития панкреатита. То есть различные факторы сочетаются в разной пропорции, и очень редко мы сталкиваемся с моноэтиологичной формой заболевания.
У нашего пациента четко (уже при расспросе его) выделяются два панкреотоксических фактора: это злоупотребление алкоголем и курение. При взаимодействии эти факторы взаимно усиливают друг друга, вызывают быстрое развитие и прогрессирование заболевания.
При объективном статусе отмечалась болезненность в проекции поджелудочной железы, вздутие живота. В остальном каких-то выраженных изменений найдено не было. В анализах обращало внимание двукратное повышение уровня амилазы мочи. Обратите внимание, что, несмотря на явные проявления внешнесекреторной недостаточности, фекальная эластаза в пределах нормы.
При компьютерной томографии обращает внимание неоднородная структура поджелудочной железы, но каких-то выраженных локальных изменений типа псевдокист выявлено не было.
Говоря о причинах боли у пациента, следует выделить боль, связанную с собственно воспалением ткани поджелудочной железы, неважно преобладают ли процессы экссудации, когда воспалительный отек сдавливает нервные ганглии, или при преобладании в воспалительном субстрате альтеративных процессов, когда биологически активные вещества воздействуют на оболочку нервных ганглиев и разрушают ее. В этих случаях ведущее значение в генезе боли имеет собственно воспаление. Это боль типа А, на ней мы остановимся чуть позже.
В случае же осложнений собственно воспаления ткани поджелудочной железы при развитии псевдокист, в которых агрессивный панкреатический сок воздействует на обнаженные нервные окончания, при сдавлении увеличенной вследствие воспаления головкой поджелудочной железы желчных протоков или 12-перстной кишки или вследствие сдавления вирсунгового протока участками фиброза, возникает боль В-типа.
В чем же их отличие? Боль А-типа, то есть боль, вызванная собственно воспалением ткани поджелудочной железы, отличает относительно недлительная продолжительность, обычно где-то менее двух недель, длительные светлые промежутки по нескольку месяцев. И эффект наступает от консервативной терапии, неважно, будь то назначение нескольких таблеток парацетамола или госпитализация пациента в отделении интенсивной терапии с проведением комплекса мероприятий по лечению тяжелого обострения панкреатита. Но исцеление, улучшение состояния в данном случае приносит консервативная тактика, то есть такие пациенты находятся в ведении гастроэнтерологов и терапевтов.
Боль В-типа. Клинически ее отличает длительный период обострения, обычно не менее двух месяцев, короткие светлые промежутки и эффект наступает или от хирургических, или эндоскопических методов лечения.
Иной механизм абдоминальной боли при хроническом панкреатите. Уже на относительно ранних этапах заболевания уменьшается выработка поджелудочной железой (поджелудочная железа, напомню, весит где-то всего лишь 60-80 грамм) раствора бикарбоната. А здоровая поджелудочная железа производит в сутки полтора-два литра раствора бикарбоната. Вследствие уменьшения выработки раствора бикарбоната происходит ацидификация начальных отделов 12-перстной кишки, вследствие закисления среды в кишке инактивируются ферменты, возникают проявления экзокринной недостаточности. И все это сопровождается тяжелыми нарушениями моторики и развития метеоризма, которые подчас пациенты не могут отличить от чувства абдоминальной боли. Напомню, что у нашего пациента выраженный метеоризм, резко снижающий качество его жизни.
Итак, какие основные направления лечения боли, консервативные направления? Я подчеркиваю, это лечение боли А-типа. Отказ от курения и употребления алкоголя при любой форме панкреатита, не обязательно при токсических формах, и при билиарном, и при наследственном, при любом панкреатите следует отказаться от дополнительных панкреотоксических факторов, удалить их. Первым этапом назначаются легкие анальгетики, далее могут назначаться «легкие» опиоиды типа трамадола, но это редко бывает, и еще реже в исключительных случаях при панкреатите, в отличие от рака поджелудочной железы, назначаются уже классические наркотические препараты. Это крайнее средство, каждый раз данный подход требует очень тщательного обсуждения и оценки всей глубины ситуации в отношении конкретного пациента. Трициклические антидепрессанты – так называемая лекарственная денервация поджелудочной железы – эффективный метод лечения абдоминальной боли А-типа.
Вот обратите внимание, ингибиторы секреции, которые мы очень часто используем в лечении абдоминальной боли при хроническом панкреатите, а также сандостатин, не показывают свою эффективность при лечении болевого панкреатита при контролируемых исследованиях. Очевидно, это связано с тем, что в исследуемую группу попадают пациенты как с А-болью, так и с В-болью, то есть происходит смешение разных типов боли. И соответственно при обработке статистических данных не удается получить достоверных результатов. Хотя все мы, клиницисты, прекрасно знаем, что лечить абдоминальную боль мы начинаем, прежде всего, комбинацией ферментных препаратов и ингибиторов секреции.
Итак, остановимся на ферментных препаратах. Классическими работами конца прошлого века было показано, что традиционные таблетки панкреатина обладают большей эффективностью в лечении абдоминальной боли А-типа при хроническом панкреатите, а также они достоверно снижают давление в протоках поджелудочной железы. В то же время капсулированные, микрогранулированные препараты панкреатина не уменьшают достоверно уровень абдоминальной боли А-типа и не уменьшают достоверно повышенное давление в протоковой системе панкреас.
За неимением времени я не буду останавливаться на патогенезе действия таблетированных и микрогранулированных препаратов. Но суть в том, что таблетированные препараты в большей степени задействуют рилизинг-систему, механизм обратной связи, потому что панкреатин, который содержится в таблетках, протеазы начинают действовать раньше в начальных отделах 12-перстной кишки, где, собственно, и осуществляется механизм обратной связи, где функционирует рилизинг-система.
Вернемся к нашему пациенту. Хронический панкреатит в стадии обострения, обусловленный токсическими факторами (алкоголь и курение), первая стадия по Кембриджской классификации. Синдром избыточного микробного роста в тонкой кишке. Экзогенно-конституциональное ожирение первой степени, это тоже нередко встречается при панкреатите. Не надо обязательно думать, что эти все пациенты должны быть обязательно крайне исхудавшими.
Какие направления лечебной тактики? Мы убедили пациента, воздействовав, в том числе, и на его родственников, что ему полностью необходимо отказаться от алкоголя и курения. Пациенту проводилась дезинтоксикационная терапия в достаточном объеме. Мы назначили ему препарат мезим 20000 по две таблетки 3 раза в день до улучшения его состояния, в дальнейшем мы несколько уменьшили эту дозировку, и омепразол. Добавлю, что коротким курсом с учетом синдрома избыточного микробного роста было назначено также семидневное лечение рифаксимином, антибактериальным препаратом.
В нашей клинике было проведено исследование, сравнивали анальгезирующее воздействие классических таблеток панкреатина мезима 10000 и капсулированного панкреатина в виде микросфер, содержащего такое же количество липазы – 10000 в одной капсуле. Отмечено, что мезим 10000 чаще эффективно уменьшал уровень боли и даже совсем ее прекращал, мезим 10000 реже вызывал развитие запоров и достаточно эффективно мезим 10000 снижал уровень метеоризма, часто беспокоящего наших пациентов. Таким образом, мезим 10000 и вновь появившийся где-то около года назад на рынке мезим 20000 позволяют эффективно купировать абдоминальную боль А-типа, и они обеспечивают при умеренно выраженной внешнесекреторной недостаточности ее эффективное нивелирование. Кроме того, следует отметить, что на фоне таблетированных препаратов панкреатина в виде мезима 10000 и мезима 20000 реже возникает такое осложнение ферментативной терапии как запоры.
Еще раз вернемся к основным направлениям лечения хронического панкреатита. Помимо устранения токсических факторов мы должны назначать ферментные препараты в адекватной дозе, это при лечении абдоминальной боли, прежде всего, таблетированными препаратами. Если же абдоминальная боль сочетается с тяжелой степенью экзокринной недостаточности, присоединяются уже капсулированные препараты.
Я хочу сказать, что вот сейчас на нашем рынке появляется новый препарат панкреатина – микротаблетки панкреатина заключенные в капсулы – пангрол препарат. Он будет представлен 10000-ми капсулами панкреатина по содержанию липазы и, соответственно, пангрол 25000 единиц, которые содержат липазу в 2,5 раза больше. Мы остановимся чуть позже более подробно на этом препарате.
Кроме того, обязательно используются блокаторы протонной помпы. Здесь следует учитывать, что при наличии, скажем, билиарного панкреатита октреотид, который вызывает сгущение желчи, должен использоваться с осторожностью, но тем не менее он обладает хорошим антисекреторным воздействием в плане самой поджелудочной железы.
При лечении спастических расстройств (они чаще всего имеют место при панкреатите) безусловно нужно использовать спазмолитики, лекарственные денервации поджелудочной железы, назначаем трициклические антидепрессанты. И обязательное лечение трофологической недостаточности, синдрома избыточного микробного роста, который очень часто сочетается с хроническим панкреатитом, и, наконец, антиоксидантная терапия.
Каково преимущество препарата мезим 20000? Он содержит более эффективный ферментативный комплекс по сравнению с мезимом 10000, позволяет уменьшить количество таблеток, которое мы назначаем пациенту, а это очень важно, поскольку в данном случае у пациента повышается желание следовать указаниям врача. Пациенты не любят принимать большое количество таблеток, повышается комплаентность пациентов, настроенность их на лечение.
Препарат пангрол представляет, как я уже сказал, капсулы наполненные минитаблетками. Каждая минитаблетка содержит 500 единиц липазы. Две формы выпуска – это капсулы 10000 единиц и капсулы 25000 единиц. Очень важно, что минитаблетки покрыты не только кишечнорастворимой оболочкой, устойчивой к воздействию кислого желудочного сока, но и функциональной мембраной. Вот эта функциональная мембрана, выполненная на основе дериватов метакриловой кислоты, позволяет выделяться препарату в тонкой кишке равномерно. То есть вы видите, проводилось сравнение, как выделяются ферменты, в частности липаза, из минитаблеток и из минимикросфер. Оказалось, что из минитаблеток ферменты выделяются более равномерно, что очень важно в отношении лечения внешнесекреторной недостаточности поджелудочной железы.
Кроме того, минитаблетки обеспечивают равномерное перемешивание с пищей, и происходит оптимальная активация ферментов в разных участках тонкого кишечника.
Оказалось, что пангрол достоверно снижает стеаторею уже на 5 день лечения, причем у пациентов с тяжелой формой внешнесекреторной недостаточности поджелудочной железы.
Очень важно, что на фоне терапии у большинства пациентов к шестому месяцу лечения нормализуется масса тела, нормализуется уровень сывороточного альбумина.
И заключить свое выступление я хотел тем, что, несмотря на то, что появились новые современные препараты в лечении хронических панкреатитов, в частности ферментативные препараты, работа гастроэнтеролога, работа терапевта не стала менее трудной. Но то, что появились новые эффективные препараты, позволяет сделать ее более эффективной, то есть помочь большему количеству наших пациентов.
В первом десятилетии нового века группой ученых из Цюрихского университета была опубликована статья под названием «Лечение острого панкреатита с позиции доказательной медицины. Взгляд на устоявшуюся парадигму» [1]. В ней анализировались данные, полученные различными научными группами в большом числе клинических испытаний, выполненных в соответствии с правилами, принятыми в доказательной медицине, о результатах лечения панкреатитов. Была представлена оценка эффективности наиболее часто применяемых средств для лечения острого панкреатита (ОП): габексилата мезилата, лексипафанта, апротинина (контрикал, трасилол), октреотида (аналог соматостатина). Выводы мета-анализов оказались весьма неожиданными: ни одно из указанных средств не может расцениваться как эффективное лекарство для лечения панкреатитов в силу их недостаточно доказанной эффективности.
Выводы этой работы заставили ученых пересмотреть значимость антисекреторных и антипротеазных препаратов в лечении ОП. И если в странах Западной Европы и США практически отказались от использования указанных средств, то в России их до настоящего момента достаточно часто назначают врачи для купирования явлений О.П. Вероятно, наиболее часто из этих средств назначают сандостатин (октреотид). Октреотид (ОК) является синтетическим аналогом октапептида соматостатина (СС). СС был выделен из гипоталамуса овцы в 1973 г. Несколько позднее его определили в ЦНС и периферической нервной системе (НС), локализовали в Д-клетках автономной НС поджелудочной железы (ПЖ), в желудке и двенадцатиперстной кишке. Были установлены две молекулярные формы природного СС — S-14 и S-28. Первая форма трактуется как нейропептид, вторая — как циркулирующий гормон. СС тормозит выделение, но не синтез гормона роста. В желудочно-кишечном тракте (ЖКТ) он тормозит секрецию большинства интестинальных гормонов, наряду с этим выраженно угнетает желудочную секрецию, секрецию панкреатических ферментов и бикарбонатов, снижает кровоток в органах брюшной полости [2, 3].
В 1982 г. швейцарская создала длительно действующий синтетический аналог СС, который получил название сандостатин (ОК). Это лекарственное соединение сохранило многочисленные эффекты СС, в основном ингибирующего характера в отношении гормонов пищеварительной системы, желудочной и пищеварительной секреции. Механизм действия ОК основан на угнетении аденилатциклазы и последующем уменьшении цАМФ в клетке. Ингибирующий эффект ОК на G-клетки желудка приводил к торможению продукции гормона гастрина, что сказывалось на недостаточной выработке секреции пепсина и соляной кислоты. Уменьшение концентрации другого гормона (мотилин) приводило к снижению моторной активности ЖКТ.
В 80—90 годы XX века одним из ведущих факторов развития ОП считали активизацию панкреатических ферментов, приводящую в конечном итоге к «самоперевариванию» железы. Ингибиция панкреатической секреции и ферментных систем путем назначения СС или ОК выглядела перспективно. Этому способствовали первые положительные результаты клинических наблюдений воздействия СС на ПЖ больных с ОП [4]. Позднее в многочисленных клинических работах подтвердить эффективность СС в лечении ОП не удавалось [5, 6].
Практически такая же ситуация возникла с использованием ОК в лечении больных О.П. Первоначально появились обнадеживающие статьи об эффективности ОК в купировании приступов панкреатитов, однако по мере накопления результатов исследований, проведенных по правилам доказательной медицины, число отрицательных отзывов об ОК как эффективном средстве нарастало. Примером может служить работа S. Heinrich и соавт. [1]. Этот метаанализ объединил четыре клинических исследования. Его результаты свидетельствовали, что ОК не уменьшает количество хирургических вмешательств у больных ОП (23,3% против 16,3%; р=
0,09), не снижает частоту развития сепсиса, не уменьшает летальность, а также общее количество осложнений (70,6% против 63,2%;
р=
0,2). Помимо этого, не установили разницы для любого пути введения лекарства (подкожно или внутривенно). В итоге авторы не рекомендуют пациентам с тяжелым ОП назначать ОК. В других работах того же периода времени число негативных отзывов возможности применения пептидного препарата ОК при ОП постоянно нарастало, что привело к ситуации, когда медицинские стандарты Великобритании, Международной ассоциации панкреатологов не рекомендовали применение ОК и СС при ОП [7—9]. Таким образом, идея применения мощных антисекреторных и антиферментных средств (и в первую очередь СС и ОК) в лечении ОП не нашла подтверждения в клинической практике гастроэнтерологов и абдоминальных хирургов. Вместе с тем ОК и СС находят применение в современной хирургии, они эффективно останавливают кровотечения из варикозно-расширенных вен пищевода и желудка у больных циррозом печени, применяются для профилактики рецидивов, при секретирующих эндокринных опухолях поджелудочной железы (глюкагономы, ВИПомы, карциноидные опухоли, гастриномы, синдром Золлингера—Эллисона), могут использоваться при лечении акромегалии.
В этой ситуации в конце 80-х — в начале 90-х годов в нашей стране для лечения ОП начал широко применяться пептидный препарат даларгин. Даларгин является синтетическим аналогом лейцин-энкефалина (Tyr-D-Ala-Gly-Phe-Ley-Arg). Являясь синтетическим опиоидным нейропептидом, он практически не проникает через гематоэнцефалический барьер, не вызывает привыкания, физической зависимости и толерантности [3, 10]. Фармакологическое действие опиоида преимущественно обусловлено взаимодействием с дельта-рецепторами и в меньшей степени с мю-рецепторами. Даларгин в первую очередь является активным регулятором гомеостаза организма, обладает способностью влиять на различные биологические системы. В экспериментальных исследованиях на модели цистиаминовых дуоденальных язв у крыс было показано, что даларгин обладает мощным репаративным действием в отношении язвенных поражений [11]. Установленная активность была подтверждена стимуляцией в дуоденальной слизистой маркерного энзима процессов регенерации — орнитиндекарбониксилазы (ОДК). Выраженная способность гексапептида активировать процессы регенерации и роста тканей, наряду с выявленными умеренными антисекреторными эффектами в отношении желудочной и панкреатической секреции, улучшение микроциркуляции крови в зоне повреждения определили возможности средства в лечении целого ряда гастроэнтерологических заболеваний [12]. В качестве лекарственного средства даларгин в настоящее время применяют для лечения язвенной болезни (ЯБ), панкреатитов, в том числе ОП, панкреонекрозов.
Уже в первых работах хирургов были получены убедительные данные о способности даларгина (5 мг/сут) ограничивать или приостанавливать прогрессирующее течение деструкции экзокринной паренхимы ПЖ (было подтверждено гистологическими и электронно-микроскопическими методами) у 56 больных различными формами ОП и развивающегося панкреонекроза [13, 14]. В исследовании Р.Х. Васильева и соавт. [15] отрабатывались различные дозы и пути введения пептида при сочетанных гастроэнтерологических заболеваниях (например, ЯБ и ОП). Даларгин был высоко эффективен в лечении сочетанных заболеваний панкреатодуоденальной зоны. По результатам исследований, проводимых в клинике хирургии, было предложено назначать терапию гексапептидом всем больным на до- и послеоперационном этапе лечения, что приводило к ускоренному заживлению осложненных гастродуоденальных язв, предупреждению перехода отека в панкреонекроз, угнетению ферментовыделительной функции П.Ж. При сравнении терапевтической активности даларгина и других средств, применяемых в лечении ЯБ, пептидное средство по своей активности превосходило все другие противоязвенные средства (ингибиторы протонной помпы в работе не применяли). В терапии заболеваний ПЖ гексапептид превосходил по активности цитостатики, ингибиторы протеаз, рибонуклеазу, пантриптин, СС, кальцитонин, глюкагон. Терапевтическая эффективность даларгина расценивалась авторами как результат системного воздействия пептида на органы пищеварения.
Даларгин успешно применялся в лечении хронического панкреатита (ХП), развивавшегося после резекции желудка у больных ЯБ, — постгастрорезекционного панкреатита (ПГРП) [15]. Гексапептид был применен у 25 больных с ПГРП в дозе 1 мг внутримышечно 2 раза/сут, и у 25 пациентов, получавших традиционную терапию. Результаты исследования свидетельствовали, что даларгин быстрее и в большем числе случаев (84%) снижал интенсивность болей в эпигастрии и улучшал общее самочувствие, чем в контрольной группе (купирование болей у 72% больных). Авторы отмечали у больных основной группы положительную динамику изменений со стороны функционального состояния ПЖ, которая сохранялась на протяжении года, и по данным отдаленных наблюдений превосходила по эффективности стандартную терапию. Помимо этого, в ходе исследований была зафиксирована выраженная антиоксидантная активность гексапептида, что расценивается как один из патогенетических механизмов действия пептидного лекарства [15]. Известны другие работы, в которых широко использовался даларгин в лечении и профилактике послеоперационного панкреатита (ПП) с позитивным результатом [16].
На анализе состояния 1164 больных, подвергшихся радикальной дуоденопластике в связи с гастродуоденальными язвенными поражениями, были разработаны меры профилактики ПП на всех этапах ведения больных [17, 18]. Поочередное применение даларгина и ОК на фоне стандартной терапии существенно (в 10—12 раз) снижало частоту послеоперационных осложнений. Приведенная профилактическая схема назначения пептидных средств в настоящее время достаточно часто с успехом применяется абдоминальными хирургами. Известно лишь одно клинико-экономическое наблюдение, в котором приводятся данные о недостаточной профилактической эффективности комбинации даларгина с 5-фторурацилом и контрикалом по отношению к ОК и ОК-депо у больных с ПП после хирургического вмешательства по поводу рака желудка [19].
Даларгин уже многие годы применяется в лечении ХП различного генеза. Примером может служить наше исследование, в котором даларгин применялся в дозах 2 и 3 мг внутривенно капельно (в 200 мл физиологического раствора) 2 раза в сутки в течение 5 дней на фоне стандартной терапии у 38 больных отечной стадией алкогольного ХП [20]. На фоне лечения интенсивность болей купировалась (к 5-му дню у 90% больных), снижались уровень ферментемии, показатели СОЭ и лейкоцитоз. Данные УЗИ ПЖ свидетельствовали о положительной динамике размеров железы за счет уменьшения ее отека, у 14 больных удалось добиться сокращения размеров железы до нормальных размеров. На целесообразность применения даларгина в терапии алкогольного ХП указывают О.Н. Минушкин и Л.В. Масловский [21]. По их мнению, даларгин должен применяться при легком и среднем течении (отечная форма) алкогольного ХП, а также при ХП с элементами дистрофии и эндокринной дисфункцией. При алкогольном ХП авторы рекомендуют наряду с даларгином назначать О.К. Имеются мнения других авторов [22], что комбинация даларгина и аналогов соматостатина (СС и ОК) является наиболее перспективной при использовании этих средств в терапии заболеваний ПЖ.
В 2007 г. была запатентована фармакологическая композиция, состоящая из даларгина и ОК в виде раствора, предназначенная для лечения ОП [23]. Указанная композиция была протестирована при лечении экспериментального ОП средней и тяжелой степени, вызванного холодом, у крыс. В этой комбинации даларгин использовался в количестве 0,8 и 0,9 мг/кг, ОК — 0,1 мг/кг в качестве контроля были группы животных, получавшие только раствор NaCl, даларгина или О.К. Главным критерием оценки эффективности композиции была летальность животных, которая оценивалась на 1, 5, 10 и 15-е сутки. Помимо этого, оценивались морфологические изменения ПЖ, активность ферментов железы и продукция перекисного окисления липидов. Комбинация даларгина и ОК при тяжелой степени поражения ПЖ вызывала суммирование эффектов препаратов и оказывала отчетливый лечебный эффект, выражающийся в снижении летальности крыс до 4%. В ходе эксперимента отмечали более благоприятное воздействие на течение ОП уже к 5—10-м суткам использования комбинации пептидных средств и восстановление ацинарной паренхимы к 15-м суткам без остаточных явлений склероза и воспаления. Позитивное лечебное действие композиции и ее фармакологические свойства определяются входящими в ее состав двумя пептидными средствами, действующими синергично. Сохранение свойств биорегуляции, свойственное пептидной системе и самим пептидным компонентам, может способствовать компенсаторным возможностям нового соединения при поражении ПЖ [12, 14]. Менее значимые частные механизмы также могут приводить к позитивному общему действию, например выраженные репаративные способности гексапептида даларгина могут превалировать в этой комбинации средств и способствовать быстрой регенерации тканей животных [11].
Комбинация даларгина и ОК легла в основу разработки нового лекарственного препарата в форме раствора для внутривенного и инфузионного введения, получившего название Далоктин П.В. настоящее время фармакологами при создании новых лекарственных средств стали использоваться принципы синергии действующих веществ. Синергизмом обозначается одновременное действие в одном направлении двух или нескольких соединений, что обеспечивает более высокую общую эффективность, чем у каждого из них в отдельности. В данном случае для оптимизации и удобства подбора схем лечения новый препарат представлен двумя дозировками с корреляцией по содержанию действующих веществ даларгина и ОК на 1 мл раствора, а именно 2 мг+0,05 мг соответственно. Предназначено новое средство с панкреотропной активностью для лечения ОП, обострения ХП, профилактики панкреонекроза. Новый препарат был всесторонне изучен в доклинических исследованиях на двух видах животных, включая изучение различных видов токсичности, фармакокинетики и путей введения, и был отнесен к 6-му классу «относительно безвредные вещества», что определяет возможность продолжения исследований в клинических условиях. Заметим, что как для ОК, так и особенно для даларгина характерным является практически полное отсутствие побочных эффектов при их использовании с лечебной целью. В настоящее время проводятся клинические испытания препарата Далоктин П в лечении заболеваний ПЖ.
Подводя итоги, можно сказать, что идея использовать пептидные лекарственные соединения в лечении заболеваний ПЖ не исчерпана. И если у специалистов в отношении ОК имеется определенный скепсис, то информация о позитивных терапевтических возможностях даларгина при различных панкреатитах заслуживает самого пристального внимания. В последнем случае необходимо проведение новых научных работ, выполненных на уровне доказательной медицины, перевод исследований в режим метаанализа. Что касается недавно созданного препарата Далоктин П, то можно полагать, что с учетом теоретических предпосылок и данных экспериментов, указывающих на его панкреатотропную активность, имеются все основания ожидать появления в арсенале гастроэнтерологов нового лекарственного средства для лечения заболеваний ПЖ, а результаты полного цикла клинических исследований дадут объективную оценку новому пептидному средству Далоктин П.
Автор заявляет об отсутствии конфликта интересов.
The author declare no conflicts of interest.
Сведения об авторах
Булгаков Сергей Александрович
— д.м.н., проф. ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрва России, Москва Россия; e-mail; https://orcid.org/0000-0002-9004-9400