Диффузная В крупноклеточная лимфома (ДВКЛ) — это группа опухолей лимфатической системы, в основе которой лежит трансформация В-лимфоцитов в злокачественные клетки.
- Причины возникновения и группы риска
- Симптомы диффузной крупноклеточной В лимфомы
- Классификация, формы и стадии диффузной лимфомы
- Диагностика диффузной крупноклеточной лимфомы
- Лечение диффузной В-крупноклеточной лимфомы
- Восстановление после лечения крупноклеточной неходжкинской лимфомы
- Рецидивы крупноклеточной лимфомы
- Осложнения диффузной В крупноклеточной лимфомы
- Прогноз и профилактика крупноклеточной лимфомы
Причины возникновения и группы риска
Причиной возникновения ДВКЛ является изменение В-лимфоцитов, т. е. нарушение структуры ДНК. Из-за этого клетки начинают бесконтрольно расти и размножаться, рассеиваясь по всему организму и поражая различные органы и системы. Почему возникают эти мутации, достоверно не установлено. Более того, есть много людей, у которых обнаруживаются характерные генетические поломки, но нет лимфомы. Данный вопрос продолжает изучаться.
В настоящее время принято говорить о факторах риска, которые повышают вероятность развития данного заболевания:
- Врожденные и приобретенные иммунодефициты: синдром Вискотта-Олдрича, Луи-Бара, СПИД, необходимость лечения, которое снижает иммунитет: цитостатики, иммуносупрессоры при трансплантации органов и др.
- Вирусные инфекции: ВИЧ, гепатит С, Т-лимфотропный вирус.
- Аутоиммунные заболевания: ревматоидный артрит, волчанка и др.
- Токсическое воздействие инсектицидов, гербицидов, бензола.
- Лечение посредством цитостатической и лучевой терапии.
Признаки и симптомы BIA-ALCL
Важно каждый день проводить осмотр молочной железы, чтобы отслеживать возникновение каких-либо проблем.
Также важно соблюдать график приемов в рамках последующего наблюдения у вашего пластического хирурга. На этих приемах хирург проверит наличие признаков развития BIA-ALCL.
Ниже перечислены изменения молочных желез или грудных имплантатов, которые могут быть признаками развития BIA-ALCL. Эти изменения могут наблюдаться в одной или обеих молочных железах.
Свяжитесь с вашим медицинским сотрудником, если у вас возникли следующие признаки:
- Жидкость вокруг имплантата. Это может привести к увеличению молочной железы или чувству стеснения. Это может произойти спустя много лет после операции по установке имплантата.
- Изменения внешнего вида молочной железы. Молочная железа может быть отекшей, бугристой или выглядеть деформированной.
- Чувство стеснения или рубцевание вокруг имплантата.
- Опухоли на коже или в тканях молочной железы. Это менее распространенный признак.
- Увеличенные лимфоузлы в области подмышек (одной или обеих). Это менее распространенный признак.
Эти признаки не всегда означают наличие BIA-ALCL. Эти признаки могут быть вызваны и другими проблемами, например подтеканием имплантата. При появлении какого-либо из этих симптомов запишитесь на прием к вашему врачу.
Вернуться к началу
Симптомы диффузной крупноклеточной В лимфомы
Крупноклеточная лимфома может проявляться множеством симптомов, но все их многообразие можно уложить в три синдрома:
- Увеличение лимфатических узлов — лимфаденопатия. Чаще всего, лимфома манифестирует безболезненным увеличением лимфатических узлов, которые можно обнаружить визуально или при пальпации. Но бывает так, что поражаются узлы, недоступные для осмотра и пальпации (например, в грудной или брюшной полости), тогда этого признака сразу может и не быть.
- Симптомы интоксикации: повышение температуры, не связанное с инфекцией, сильная потливость, потеря веса. Комбинацию этих признаков называют В-симптоматикой. Ее наличие имеет значение при определении стадии заболевания.
- Симптомы, которые развиваются, когда крупноклеточная лимфома переходит на другие органы и системы. Это могут быть боли в груди и кашель, боли в животе и нарушение стула. При поражении ЦНС развиваются головные боли, нарушение зрения и рвота. Из-за разрушения костного мозга снижается иммунитет, развивается анемия и склонность к опасным кровотечениям.
Генерализованная лимфома, ассоциированная с ВИЧ-инфекцией
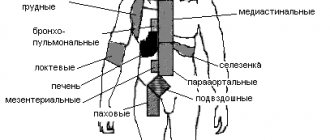
Лимфомы относятся к редким злокачественным лимфопролиферативным заболеваниям. У больных с ВИЧ-инфекцией выявляются в основном неходжкинские лимфомы (НХЛ), которые регистрируются в 200–600 раз чаще, чем в общей популяции, и относятся к вторичным заболеваниям [1–4]. По гистологическим характеристикам выделяют 5 типов НХЛ: диффузная крупноклеточная В-лимфома, первичная экссудативная лимфома, первичная В-клеточная лимфома ЦНС, лимфома Беркитта и лимфогранулематоз [2]. Иммунобластную лимфому в абсолютном большинстве случаев выявляют у больных с ВИЧ-инфекцией при количестве CD4+ Т-лимфоцитов менее 100 клеток/мкл, с частотой 3% [1, 2, 4, 5]. В патогенезе имеет значение иммуносупрессия и наличие вируса Эпштейна–Барр, который выявляется у 50–80% пациентов [2, 6–9]. Основной симптом лимфом — увеличенные, уплотненные, малоподвижные и безболезненные лимфатические узлы. У большинства больных имеют место лихорадка, слабость, потеря массы тела, ночные поты. В зависимости от локализации процесса могут быть симптомы органных поражений (ЖКТ, ЦНС, печени, легких, костей и др.) [4]. Как правило, диагноз устанавливают на поздней стадии лимфомы. Основной критерий диагностики — гистологическое исследование биоптата костного мозга или лимфатического узла. Наиболее часто проводят дифференциальный диагноз с атипичным туберкулезом [2, 4]. Онкологический процесс у больных с ВИЧ-инфекцией быстро прогрессирует. Специфическая высокоактивная антиретровирусная терапия (ВААРТ) в сочетании с химиотерапией на ранних стадиях болезни может давать определенный положительный эффект. Развитие первичной лимфомы у больных, не получавших ВААРТ, свидетельствует о самом неблагоприятном прогнозе при этой патологии среди всех СПИД-индикаторных заболеваний [2].
В г. Новокузнецке уровень заболеваемости ВИЧ-инфекцией составляет 216,3 на 100 тыс. населения, показатель пораженности 1881 на 100 тыс. населения (по официальным данным за 2021 г.). Ежегодно в инфекционные отделения госпитализируется более 400 взрослых больных с ВИЧ-инфекцией, преимущественно на поздних стадиях заболевания. Вместе с тем мы наблюдали лишь 4 случая НХЛ.
Наблюдение 1. Больная Д., 41 год (рис. 1). Поступила в инфекционное отделение 07.04.15 с жалобами на слабость, повышение температуры тела до 39 °C, боль в горле и в области шеи. Заболела 25.03.15: лихорадка, боль в горле. 02.04 обратилась в поликлинику, осмотрена терапевтом и ЛОР-врачом, направлена на госпитализацию с диагнозом: лакунарная ангина, тяжелое течение. При поступлении хронические заболевания, употребление наркотиков, ВИЧ-статус отрицала, отмечала ангины 1–2 раза в год. Состояние средней степени тяжести, сознание ясное, положение активное. Т — 38,2 °C. Кожные покровы бледно-розовые, теплые. Слизистые зева ярко гиперемированы, слева миндалина значительно увеличена в объеме, почти сплошь покрыта гноем. Увеличены подчелюстные лимфоузлы. Шейные лимфоузлы слева увеличены до 2 см в диаметре, болезненные. Язык обложен, влажный. В легких и сердце без выраженной патологии, АД 110/70 мм рт. ст., пульс 74 уд./мин, ЧДД 18/мин. Живот мягкий, безболезненный, печень по краю реберной дуги, селезенка не увеличена. В гемограмме от 08.04 СОЭ 80 мм/ч, лейкоциты 7,7 × 109, П 11, С 59, Л 9, М 21, Тр 304 × 109, Эр 2,8 × 1012, гемоглобин 80 г/л. В биохимическом анализе крови билирубин 11,0 мкмоль/л, АСТ 58 ЕД/л, АЛТ 54 ЕД/л, амилаза 21 ЕД/л, общий белок 58 г/л, мочевина 5,7 ммоль/л. Из зева выделена культура Klebsiella pneumoniae и Streptococcus viridans. ЭКГ: синусовая тахикардия, без изменений в миокарде. Диагностический поиск включал обследование на дифтерию, туляремию, туберкулез. Лечение: инфузионная терапия — 1250,0 мл/сут, антибактериальная терапия: Амписид 3,0 × 3 раза/сут в/в кап., симптоматическая терапия, местное лечение. С 10.04 усиление антибактериальной терапии гентамицином 80,0 × 3 раза/сут в/м и доксициклином по 1,0 × 2 раза/сут.
10.04 было выявлено, что больная ВИЧ-инфицированна, диагноз установлен в 2010 г., в марте 2015 г. уровень CD4+ составил 10 клеток. Назначенную ВААРТ не принимает. К 13.04 развились орофарингеальный кандидоз, хейлит, что потребовало назначения флуконазола. Состояние оставалось стабильным. Сохранялись лихорадка, лимфаденопатия, изменения в зеве, умеренно выраженная диарея. 15.04 состояние ухудшилось, присоединилась рвота до 5 раз. Зафиксировано резкое снижение ПТИ — 17,1%, повышение фибринолиза (360 мин), снижение общего белка (47 г/л) и альбумина (16 г/л) при нормальных показателях АЛТ (30,5 ЕД/л) и незначительном повышении АСТ (50,3 ЕД/л). Гипонатриемия (127,8), показатели кислотно-основного состава в пределах нормы (рН 7,43; РСО2 36,1; ВЕ 0,1; SBC 24,1). В дальнейшем, несмотря на лечение (трансфузия свежезамороженной плазмы, дезинтоксикаuионная терапия, цефтриаксон по 2,0 × 2 раза/сут в/в), усугублялась тяжесть состояния, нарастала полиорганная недостаточность, асцит, анемия. При сохранном состоянии сознания 21.04 в 23.25 произошла остановка сердечной деятельности, констатирована смерть.
При жизни также проведено обследование: рентгенография органов грудной клетки (ОГК) от 15.04 без патологии. УЗИ органов брюшной полости (ОБП) от 16.04: печень +3 см; асцита, увеличения абдоминальных л/узлов не выявлено. Желчный пузырь, поджелудочная железа, селезенка, почки без изменений. Кровь на стерильность многократно — отриц. Цитологическое исследование мазка с миндалин от 17.04: большое количество бациллярной флоры, клетки плоского эпителия с дегенерацией ядер; атипичные клетки в препарате не найдены. Мокрота на пневмоцисты от 16.04 отриц. В общем анализе крови 20.04 и 21.04 гиперлейкоцитоз (22,6 × 109, 21,7 × 109), прогрессирующая анемия (Эр 2,l × 1012), сдвиг лейкоформулы до промиелоцитов и атипичных клеток, тромбоцитопения (l33 × 109), снижение гематокрита до 0,19. Биохимический анализ крови от 20.04 без патологии. Протромбин по Квику 324,8, эуглобулиновый фибринолиз 360 мин.
Посмертный диагноз: ВИЧ-инфекция, стадия вторичных заболеваний IVВ, фаза прогрессирования. Тяжелый сепсис. Полиорганная недостаточность. Грибковое поражение желудочно-кишечного тракта. Анемия сложного генеза. Нефропатия. Лимфаденопатия. Туберкулез лимфоузлов? Отек, набухание головного мозга. Отек легких.
При патологоанатомическом исследовании обнаружено диффузное поражение внутренних органов (легкие, печень, селезенка, сердце, надпочечники, почки) клетками типа лимфобластов, лимфоцитоподобных с большим количеством митозов, в том числе патологических. При бактериологическом исследовании крови из сердца и селезенки высеяна культура КIebsiella pneumoniae, что расценено как доказательство развития сепсиса. Непосредственная причина смерти — отек головного мозга. Патологоанатомический диагноз. Основной: ВИЧ-ассоциированная диффузная лимфома с поражением легких, печени, селезенки, сердца, надпочечников, почек. ВИЧ-ассоциированный сепсис. Осложнения: гепатоспленомегалия. Тяжелые дистрофические изменения всех внутренних органов. Отек головного мозга.
Данный пример свидетельствует о трудностях прижизненного установления диагноза лимфомы при ВИЧ-инфекции, о злокачественности лимфопролиферативного процесса с быстрым прогрессированием в сочетании с сепсисом и неблагоприятным исходом.
Наблюдение 2. Пациент С., 32 года, поступил в инфекционный стационар 20.06.2017 с жалобами на слабость, асимметрию лица, нарушение зрения. Заболел остро 7.06: появилось темное пятно перед правым глазом, осмотрен окулистом, диагноз: ретинит? Через 3 дня — онемение нижней губы, правой половины туловища, отек правой половины лица. На магнитно-резонансной томографии головного мозга от 09.06.2017 обнаружены гипер- и изоинтенсивные очаги в лобных и теменных долях, подкорковых ядрах предположительно сосудистого генеза, лимфаденопатия шеи. С 15.06 субфебрилитет до 37,7 °C. 19.06 усиление асимметрии лица. Анамнез жизни: наркомания, хронический гепатит С и ВИЧ-инфекция с 2012, ВААРТ принимает с 15.06.2017. СD4 31 кл.
При поступлении состояние средней тяжести, в сознании, адинамичен. Определяются симптомы интоксикации. Гематомы на коже, умеренная гиперемия в зеве, обложен язык. АД 140/100 мм рт. ст., ЧСС 109. По внутренним органам патологии не выявлено; сомнительные менингеальные симптомы, парез верхней и нижней ветвей лицевого нерва справа. Заподозрен ВИЧ-ассоциированный энцефалит. В гемограмме тромбоцитопения (47 × 109), анемия (Эр 3,0 × 1012, Нв 74). Ликвор: Ц — 783 кл, Н — 93%, б — 1,65 г/л, Панди 3+. С 27.06 состояние ухудшилось, присоединился геморрагический синдром, тахикардия. Контрольная люмбальная пункция, ликвор: Ц — 1898, Н — 94%, б — 0,66 г/л. 28.09 проведена повторно магнитно-резонансная томография головного мозга: дополнительно выявлено изоинтенсивное образование в правом меккелевом пространстве, с распространением вдоль намета мозжечка, толщиной до 10 мм, патологически накапливающее контрастное вещество, 7-я пара черепно-мозговых нервов справа утолщена до 5 мм. Заключение: дифференцировать между лимфомой и менингеомой. 29.06 у больного появились позывы на рвоту; живот подвздут, стул «мелена». При проведении эзофагогастродуоденоскопии установлены синдром Меллори–Вейса, состоявшееся кровотечение, острые язвы желудка, эрозивный бульбит и дуоденит. УЗИ ОБП: гепатоспленомегалия, портальная гипертензия. На рентгенограмме ОГК пневмония слева. В гемограмме Эр 1,47 × 1012, Нв 49, Тр 20 × 109. Вечером 29.06 появилась одышка до 42/мин, признаки острой почечной недостаточности: олигоурия, возрастание азотистых шлаков. 30.06 состояние терминальное, в 19.30 констатирована смерть.
Исследование ликвора: полимеразная цепная реакция на ЦМВ, ВЭБ, герпес отриц., бак. посев на м/фл., грибы — отриц. Исследование на КУМ мокроты, мочи, кала — отриц. Иммуноферментный анализ крови на токсоплазмоз (IgG+, IgМ-), ЦМВ (IgG+, IgМ-), грибы (IgМ-), сифилис — отриц. Кровь на стерильность и гемокультуру — отриц.
Посмертный диагноз: ВИЧ-инфекция, стадия вторичных заболеваний 1VВ. ВИЧ-ассоциированный менингит неуточненной этиологии. Лимфома головного мозга? Опухоль головного мозга? Осложнения: полиорганная недостаточность.
Патологоанатомический диагноз: ВИЧ-ассоциированная генерализованная мелкоклеточная лимфома с поражением головного мозга, легких, лимфатических узлов средостения, печени, почек, надпочечников, селезенки. Осложнения: опухолевая интоксикация. Глубокие дистрофические изменения внутренних органов.
Случай демонстрирует трудности прижизненного дифференциального диагноза лимфомы с другими поражениями ЦНС при ВИЧ-инфекции, быстрое прогрессирование болезни с генерализацией процесса, вовлечением ЦНС и неблагоприятным финалом.
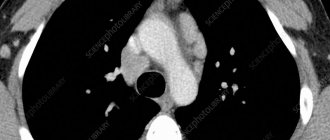
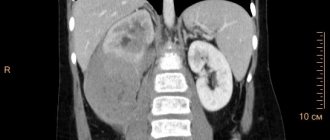
Наблюдение 3. Пациентка Р., 45 лет (рис. 2). Находилась в инфекционном отделении с 23.10 по 26.11.2017 (34 дня). Жалобы при поступлении: слабость, лихорадка до 38,5–40 °C, покашливание. ВИЧ-инфекция выявлена в 2014 г., по данным имммунограммы, CD4 = 70 кл/мкл (апрель 2017). ВААРТ получала нерегулярно. Ухудшение самочувствия, лихорадку отмечает в течение 2 месяцев. При рентгенографии ОГК выявлено образование в верхнем средостении, и больная направлена в стационар. В анамнезе наркомания много лет, хронический гепатит С, узловатый зоб.
При первичном осмотре состояние средней тяжести, в сознании, положение активное. Пониженного питания. Кожа бледно-розовая, на голенях плотные инфильтраты 4–5 см, флюктуации нет. Периферические лимфоузлы не увеличены. В легких, сердце без патологии, печень до +3 см ниже реберной дуги. В динамике отмечались периодические подъемы температуры до 38,5–38,7 °C, увеличение печени и селезенки. Изменения при спиральной компьютерной томографии от 27.10.2017: в верхнем этаже переднего средостения с уровня апертуры грудной клетки выявляется дополнительное патологическое объемное образование гомогенной плотности, с относительно четким контуром, 47,4 × 54,3 мм, смещающее трахею влево. Увеличена группа паратрахеальных, параваскулярных, преваскулярных, прикорневых лимфоузлов с двух сторон до 16 мм по короткому радиусу. Пневмофиброз. Заключение: объемное образование переднего средостения. Дифференцировать с лимфомой, зобом щитовидной железы, липомой.
С 07.11 ухудшение состояния, боли в животе, отеки нижних конечностей, передней брюшной стенки, увеличение объема живота, снижение диуреза. В биохимическом анализе крови повышение креатинина (246,7–334,3 мкмоль/л) и мочевины (25,4 ммоль/л), метаболический ацидоз, по УЗИ ОБП — гепатоспленомегалия, асцит (07.11.2017), гидронефроз справа (11.11.2017). Предположен хронический вирус-ассоциированный гломерулонефрит, хроническая почечная недостаточность. В дальнейшем постепенная отрицательная динамика: нарастание отеков с распространением на лицо и руки, прогрессирование почечной недостаточности (в крови мочевина 30,18 ммоль/л, креатинин 376,6 мкмоль/л), с 23.11 присоединение дыхательной недостаточности, приведшие 26.11 к летальному исходу.
Общий анализ крови от 02.11.2017: СОЭ 60, Нв 80 г/л, Эр 2,6 ед/л, Л 4,5 ед/л, э 1%, ю 1%, п 17%, с 66%, лим 12%, мн 3%, тр 114,0 ед/л, гематокрит 0,23; от 24.11.2017 снижение тр — 21,0 ед/л. Многократное исследование крови на стерильность, грибы — отрицательно, исследование мокроты (24.10.2017 — пневмококк 105 КОЕ/мл), мочи, кала на ВК отрицательно. В иммунограмме от 25.10.2017 СД4 = 7 кл/мкл. Эхокардиография без патологии. Пациентке проводилась антибактериальная, гормональная, противогрибковая, диуретическая терапия, трансфузии свежезамороженной плазмы, эритромассы, ВААРТ.
Посмертный диагноз: ВИЧ-инфекция, IVВ стадия. ВИЧ-ассоциированный сепсис. Не исключается лимфома средостения. Осложнения: полиорганная недостаточность (печеночно-клеточная, почечная, дыхательная, цитопения). Застойная пневмония. Отек легких. Энцефалопатия сложного генеза. Отек головного мозга. Хронический вирусный гепатит С. Нефропатия. Анемия, тромбоцитопения.
Патологоанатомический диагноз. Основной: ВИЧ-ассоциированная диффузная крупноклеточная лимфома с поражением средостения, внутригрудных парааортальных лимфатических узлов, селезенки, почек, плевры, брюшины. Осложнения: отек легких. Отек головного мозга. Тяжелые дистрофические изменения внутренних органов. Сопутствующие: хронический вирусный гепатит С. Заключение: при патологоанатомическом исследовании у больной, страдающей ВИЧ-инфекцией, обнаружено диффузное поражение внутренних органов (селезенка, почки, внутригрудные и парааортальные лимфатические узлы, плевра, брюшина, средостение) крупными лимфоцитоподобными клетками с большим количеством митозов, в том числе патологических.
В данном случае объемное образование в средостении (предположительно лимфома) было обнаружено за 1 мес до летального исхода пациентки. Диагноз диффузной лимфомы, специфическое поражение других органов и систем были установлены только при патологоанатомическом исследовании.
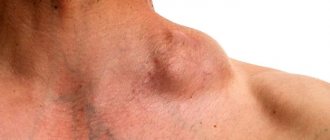
Наблюдение 4. Пациент С., 30 лет (рис. 3). Госпитализирован в инфекционное отделение 28.09.2017 по поводу ВИЧ-инфекции IVБ стадии, фаза прогрессирования, двусторонняя полисегментарная пневмония, с жалобами на повышенную температуру, одышку, кашель, слабость. С 24.09.2017 лихорадка, одышка. По данным рентгенографии ОГК 28.09.2017 двусторонняя полисегментарная пневмония. Прогрессирование основного заболевания? Присоединение оппортунистической инфекции (пневмоцистоз, туберкулез)? Из анамнеза известно, что ВИЧ-инфекция выявлена в 2021 г., получает ВААРТ. СД4 = 400 кл (обследован в сентябре 2021 г.). Наркомания много лет, последний раз употреблял наркотики в июне 2021 г. Диагностирован хронический гепатит С без биохимичекой активности. С апреля 2021 г. появились увеличенные лимфоузлы шеи справа, лихорадка до 39,6 °C. Обследован в онкологическом диспансере, по результатам гистологического исследования установлен диагноз В-крупноклеточной лимфомы 3-й стадии с поражением периферических лимфоузлов, проведено 3 курса химиотерапии (доксорубицин, винкристин, ритуксимаб).
При поступлении состояние тяжелое за счет интоксикации, в сознании, положение активное. Удовлетворительного питания. Кожные покровы телесного цвета. Лицо асимметрично, увеличение и деформация шеи справа (фото), опухоль диаметром 12–15 см (конгломерат лимфоузлов, отек мягких тканей). Отеков нет. Дыхание жесткое, 24/мин, сухие хрипы по всем легочным полям, справа влажные хрипы. АД 100/60 мм рт. ст., тоны сердца ясные, ритмичные, ЧСС 100/мин. Живот мягкий, безболезненный, печень на 3,5–4 см ниже реберной дуги, плотная. Селезенка у края ребер. В гемограмме СОЭ 52 мм/час, Эр 3,5 × 1012, Л 9,9 × 109, базофилы 2%, эозинофилы 4%, бласты 26%, промиелоциты 2%, миелоциты 2%, юные 4%, палочкоядерные 4%, сегментоядерные 2%, лимфоциты 42%, моноциты 14%, тромбоциты 94,5 × 109. В биохимическом анализе крови выявлены повышение печеночных ферментов (АЛТ/АСТ — 73,7/136,1 ЕД/л), азотистых шлаков (мочевина 14,08 ммоль/л, креатинин 146,6 мкмоль/л), снижение глюкозы (2,91 ммоль/л). По результатам исследования кислотно-основного состояния венозной крови — метаболические нарушения: рН 7,394, PCO2 29,1↓, PO2 36↓↓, BEb –6,2, BEecf –7,3,%SO2 c 69,9%. Спиральная компьютерная томография ОГК от 05.10.2017. Диффузно по всем легочным полям обоих легких симметрично, больше в прикорневой зоне выявляется альвеолярное поражение в виде пятнистого уплотнения по типу матового стекла, с частичным сохранением субплевральных участков легких. Дополнительно в обоих легких определяются одиночные разнокалиберные гиперденсивные очаги размером от 3 до 12 мм. Лимфатические узлы увеличены до 12 мм. Заключение: двусторонняя пневмоцистная пневмония. Очаговое поражение легких дифференцировать с метастатическим поражением, септической эмболией, очаговым туберкулезом. Туберкулез исключен при консультации фтизиатра. Проводилась дезинтоксикационная, антибактериальная (цефтриаксон, Хемомицин, Бисептол, ко-тримоксазол), противогрибковая (флуконазол), симптоматическая терапия. 02.10 носовое кровотечение, подкожные кровоизлияния на предплечьях. На фоне проводимой терапии с 09.10 наметилась положительная динамика, проявившаяся в уменьшении интоксикации, нормализации температуры, исчезновении одышки, улучшения физикальной картины в легких. Однако с 12.10 вновь лихорадка до 38,1 °C, усилился кашель со слизистой мокротой, появились множественные влажные хрипы в легких по всем полям. 15.10 с 20:00 стали нарастать признаки дыхательной недостаточности, в 22:00 произошла остановка сердечной деятельности и дыхания. Реанимационные мероприятия не эффективны, констатирована смерть.
Лабораторно в динамике в гемограмме установлено снижение гемоглобина и тромбоцитов, в биохимическом анализе, наряду с нормализацией печеночных и почечных показателей, возрастание ЛДГ до 1938,7 ЕД/л. Снижение протромбина по Квику до 57,2%. В мокроте 29.09 обнаружены пневмоцисты, выделена культура Candida albicans. Посевы крови и мочи отрицательны.
Посмертный диагноз. ВИЧ-инфекция IVБ-В, фаза прогрессирования. Пневмоцистная пневмония, тяжелое течение. В-крупноклеточная лимфома 3-й стадии с поражением периферических лимфоузлов. Осложнения: тяжелый сепсис. Полиорганная недостаточность. Эндотоксический шок. Отек легких. Энцефалопатия сложного генеза. Отек головного мозга. Нефропатия. Анемия сложного генеза. Хронический вирусный гепарит. Фон: наркомания.
Патологоанатомический диагноз. Основной: ВИЧ-асоциированная диффузная В-клеточная лимфома с поражением периферических, внутригрудных, парааортальных лимфатических узлов, селезенки, печени, почек, стенки желудка. Осложнения: отек легких. Отек головного мозга. Тяжелые дистрофические изменения внутренних органов. Сопутствующее заболевание: наркомания.
В приведенном клиническом случае диагноз В-клеточной лимфомы был установлен при жизни, проводилась активная химиотерапия на фоне ВААРТ. Тем не менее прогрессирование онкологического процесса остановить не удалось.
Выводы
- В-клеточную лимфому целесообразно включать в круг дифференциального диагноза оппортунистических заболеваний при ВИЧ-инфекции.
- В-клеточная лимфома развивается, как правило, на поздних стадиях ВИЧ-инфекции, имеет быстро прогрессирующее течение с выраженным интоксикационным синдромом и вовлечением разных органов и систем, в том числе головного мозга.
- В-клеточная лимфома у больных с ВИЧ-инфекцией часто сочетается с другими оппортунистическими заболеваниями (в нашем наблюдении — с пневмоцистной пневмонией, грибковыми поражениями) и сопутствующей патологией (хронический гепатит С, наркомания).
- При выявлении В-клеточной лимфомы на поздней стадии ВИЧ-инфекции, даже на фоне ВААРТ и химиотерапии, прогноз неблагоприятный.
Литература
- ВИЧ-инфекция и СПИД: национальное руководство / Под ред. акад. РАМН В. В. Покровского. М.: ГЭОТАР-Медиа. 2013. 608 с.
- Барлетт Дж., Галлант Дж., Фам П. Клинические аспекты ВИЧ-инфекции. 2012. М.: Р. Валенm. 2012. 528 с.
- Покровский В. В., Юрин О. Г., Кравченко А. В., Беляева В. В., Ермак Т. Н., Канестри В. Г., Шахгильдян В. И., Козырина Н. В., Буравцова В. В., Нарсия Р. С., Хохлова О. Н., Покровская А. В., Ефремова О. С., Коннов В. В., Куимова У. А., Попова А. А. Национальные рекомендации по диспансерному наблюдению и лечению больных ВИЧ-инфекцией. Клинический протокол // Эпидемиология и инфекционные болезни. 2015. № 6 (Приложение).
- Пивник А. В., Туманова М. В., Серегин Н. В., Пархоменко Ю. Г., Тишкевич О. А., Ковригина А. М., Ликунов Е. Б. Лимфомы у ВИЧ-инфицированных больных: обзор литературы // Клиническая онкогематология. Обзоры. 2014. Т. 7. № 3.
- Покровский В. И., Лобзин Ю. В., Волжанин В. М., Белозеров Е. С., Буланьков Ю. И. Инфекции нервной системы с прогредиентным течением. СПб: ООО «Изд-во Фолиант», 2007. 264 с.
- Горейко Т. В., Калинина Н. М., Дрыгина Л. Б. Современные представления об иммунопатогенезе инфекции, вызванной вирусом Эпштейна–Барр // Инфекция и иммунитет. 2011. Т. 1. № 2. С. 121–130.
- Pagano J. S. Viruses and lymphomas // N. Eng. J. Med. 2002. Vol. 347. № 2. P. 78–79.
- Шахгильдян В. И., Ядрихинская М. С., Сафонова А. П., Домонова Э. А., Шипулина О. Ю., Альварес-Фигероа М. В., Долгова Е. А., Тишкевич О. А. Структура вторичных заболеваний и современные подходы к их лабораторной диагностике у больных ВИЧ-инфекцией // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2015. № 1. С. 24–30.
- Yachie A., Kanegane H., Kasahara Y. Epstein-Barr virus-associated T-/natural killer cell lymphoproliferative diseases // Semin. Hematol. 2003. Vol. 40. № 2. P. 124–132.
З. А. Хохлова*, 1, доктор медицинских наук, профессор Р. А. Гилева* Т. В. Середа*, кандидат медицинских наук Н. А. Николаева*, кандидат медицинских наук А. П. Тишкина** Л. Ю. Золотухина*** Ю. М. Кириллова***
* НГИУВ — филиал ФГБОУ ДПО РМАНПО МЗ РФ, Новокузнецк ** ГБУЗ КО НГКИБ № 8, Новокузнецк *** ГБУЗ КО НГКБ № 29, Новокузнецк
1 Контактная информация
Генерализованная лимфома, ассоциированная с ВИЧ-инфекцией/ З. А. Хохлова, Р. А. Гилева, Т. В. Середа, Н. А. Николаева, А. П. Тишкина, Л. Ю. Золотухина, Ю. М. Кириллова Для цитирования: Лечащий врач № 8/2018; Номера страниц в выпуске: 64-68 Теги: злокачественные лимфопролиферативные заболевания, кожа, вирусы, неблагоприятный прогноз
Классификация, формы и стадии диффузной лимфомы
Современная классификация крупноклеточной лимфомы базируется на клинических данных и степени распространенности опухолевого процесса.
Классификация Ann Arbor:
- 1 стадия. Поражение ограничено одной лимфатической зоной или одним экстралимфатическим органом или одним сегментом экстралимфатической ткани.
- 2 стадия. Поражено две и более зоны лимфатических узлов по одну сторону диафрагмы. При поражении внелимфатических органов или тканей обнаруживаются метастазы в регионарные лимфатические узлы.
- 3 стадия. Имеются единичные очаги поражения по обе стороны диафрагмы.
- 4 стадия. Имеются множественные очаги поражения экстралимфатических органов, либо ограниченное поражение экстралимфатических органов с отдаленными метастазами, либо поражение печени и костного мозга.
Классификация Ann Arbor дополняется модификацией Cotswold:
- А — нет В-симптомов.
- В — есть хотя бы один из В-симптомов.
- Е — есть локализованные экстранодальные очаги.
- S — лимфома поразила селезенку.
- X — имеется массивное опухолевое тканей и внутренних органов.
Диагностика диффузной крупноклеточной лимфомы
Диагноз неходжкинская лимфома выставляется на основании гистологического и иммуногистохимического исследования опухолевой ткани. Для того чтобы получить материал, проводят инцизионную или эксцизионную биопсию лимфатических узлов. Помимо этого, выполняют молекулярно-генетические и иммунофенотипические исследования, которые позволят определить вид опухоли, наличие тех или иных генетических изменений и подобрать оптимальный метод лечения.
Для определения стадии лимфомы проводят следующие исследования:
- Трепанобиопсия костного мозга.
- Методы лучевой диагностики — УЗИ, КТ, ПЭТ-КТ, МРТ.
- Также назначается ряд лабораторных анализов — развернутый анализ крови, определение маркеров парентеральных гепатитов, анализ на ВИЧ, биохимические исследования и др.
Диагностика заболевания
По данным регистра PROFILE, на основании анализа 89 полностью документированных случаев, наиболее частым симптомом BIA-ALCL является перипротезная серома — у 73 (85,9%) пациентов. Капсулярная контрактура имела место у 28 (32,9%) больных, чаще всего III или IV степени. Пальпируемые опухолевые массы в молочной железе были обнаружены только в 13 (15,7%) случаях. Боль, повреждения кожи и покраснение встречались реже, но все же присутствовали. Системные симптомы включали лихорадку, ночную потливость, потерю массы тела и поражения кожи вне области молочных желез. У 2 (2%) пациентов на момент постановки диагноза симптомы отсутствовали [29].
У 2/3 пациентов с BIA-ALCL развивалась поздняя серома — в среднем через 8—10 лет после протезирования. Следовательно, любая серома, возникающая более чем через 1 год после протезирования, не поддающаяся объяснению инфекцией или травмой, должна рассматриваться как возможный признак заболевания. У 1/3 пациентов наблюдали опухолевые массы, которые указывали на более агрессивное клиническое течение [30].
По данным других источников литературы [6, 31, 32], у 8—24% пациентов определялась пальпируемая опухолевая масса, у 4—12% — лимфопатия. Реже (<5% случаев) авторы описывали местные и системные симптомы, включая кожную сыпь, лихорадку и капсулярную контрактуру. Большинство случаев BIA-ALCL диагностировалось во время операции по ревизии имплантата при наличии персистирующей серомы (>1 года), а также болевого синдрома, пальпируемых образований в молочной железе, отека или асимметрии груди [33].
B. Adrada и соавт. [34] рассмотрели 44 cлучая BIA-ALCL с использованием различных методов визуализации. Они сообщили о чувствительности и специфичности при выявлении выпота с помощью ультразвука в 84 и 75% случаев соответственно, компьютерной томографии (КТ) в 55 и 83%, магнитно-резонансной томографии (МРТ) в 82 и 33%, позитронно-эмиссионной томографии (ПЭТ)/КТ в 38 и 83%. Чувствительность и специфичность при определении опухолевой массы методом ультразвукового исследования (УЗИ) — 46 и 100%, КТ — 50 и 100%, МРТ — 82 и 33%, ПЭТ/КТ — 64 и 88%. Было обнаружено, что чувствительность метода маммографии является низкой для визуализации как выпота, так и опухолевых масс и, следовательно, не считается приемлемым методом визуализации при диагностике BIA-ALCL. Исходя из этих данных, УЗИ используется в качестве скринингового метода, тогда как ПЭТ/КТ применяется после установления диагноза, для обследования перед операцией.
Первый этап диагностики должен включать УЗИ для забора перипротезной жидкости, тонкоигольной биопсии опухолевых масс и увеличенных региональных лимфатических узлов. За вовлечением в процесс подмышечных (93%) лимфатических узлов чаще всего следует увеличение внутренних грудных и надключичных лимфоузлов, тогда как поражение нерегиональных групп лимфатических узлов встречается очень редко [35]. Аспирация тонкой иглой является оптимальной для забора проб перипротезной жидкости. Во время аспирации для аккуратного смещения и защиты имплантата можно применять УЗИ. Для диагностики заболевания следует собрать как можно больше жидкости (минимум 50 мл). Перипротезная жидкость при BIA-ALCL обычно более вязкая, чем доброкачественная серома, из-за более высокого содержания белка и клеточности. Образцы жидкости не требуют хранения в каких-либо специализированных средах и должны быть доставлены в лабораторию в течение 48 ч. Хотя клетки могут лизироваться, если их оставить на длительный период, диагностические белковые маркеры в опухолевых клетках не разрушаются, вследствие чего диагностика возможна по фиксированным клеточным блокам спустя годы [6]. Оценка тонкоигольной аспирации затрудняется после серии предыдущих пункций, поскольку титр опухолевых клеток в пунктате может быть искусственно снижен. Наличие опухолевой массы требует проведения биопсии. Образцы необходимо отправлять на морфологическое цитологическое исследование с использованием цитометрии и ИГХ для количественного определения Т-клеток в образце и определения экспрессии CD30. ИГХ-исследование CD30 является основополагающей частью диагностических тестов, однако само по себе непатогномонично, поскольку экспрессия CD30 неспецифична. Антиген CD30 может экспрессироваться на доброкачественных воспалительных клетках. Редкие CD30±лимфоциты с нормальной морфологией считаются нормальными и не требуют дальнейшего исследования [13, 36].
После установления диагноза BIA-ALCL врачу настоятельно рекомендуется провести консилиум по конкретному пациенту для определения тактики лечения. Пациентам с агрессивной локальной инвазией или метастазированием в лимфатические узлы рекомендуется выполнить биопсию костного мозга, чтобы исключить вариант системной ALCL. Всем пациентам с подтвержденной BIA-ALCL следует назначить предоперационное сканирование с помощью метода ПЭТ/КТ, который является оптимальным при визуализации ассоциированных капсулярных масс, инвазии грудной стенки, регионарной лимфаденопатии и/или метастазирования в отдаленные органы. От полученных данных будут зависеть стратегия резекции и сроки операции [10].
Лечение диффузной В-крупноклеточной лимфомы
Лечение диффузной лимфомы определяется исходя из следующих данных:
- Риски рецидива согласно IPI.
- Возраст пациента.
- Его состояние (сможет ли больной перенести высокодозную полихимиотерапию).
В качестве основных методов лечения крупноклеточной лимфомы применяется химиотерапия и в некоторых случаях облучение. Перед началом терапии фертильных пациентов обсуждается вопрос о криоконсервации гамет (половых клеток), поскольку лечение может вызвать бесплодие.
Главным критерием подбора терапии является международный прогностический индекс IPI, который включает следующие аспекты:
- Возраст. Младше 60 лет — 0 баллов, старше — 1 балл.
- Состояние пациента по ECOG (активность больного и способность к самообслуживанию). 1-2 балла по ECOG это 0 по IPI, и 3-4 балла по ECOG — это 1 балл по IPI.
- Уровень ЛДГ. В норме — 0 баллов по IPI, повышен — 1 балл.
- Стадия лимфомы. 1-2 — 0 баллов, 3-4 — 1 балл.
- Наличие более 1 экстранодальной зоны поражения. Нет — 0, да — 1.
Интерпретация IPI следующая:
- 0-1 балл — лимфома низкого риска.
- 2 балла — лимфома промежуточно низкого риска.
- 3 балла — лимфома промежуточно высокого риска.
- 4-5 баллов — лимфома высокого риска.
Пациенты из группы низкого и промежуточно-низкого риска начинают свое лечение с 6 циклов иммунохимиотерапии по протоколу R-CHOP-21. Эта схема, помимо цитостатиков, предполагает применение иммунотерапевтического препарата ритуксимаба. Такая схема позволяет добиться пятилетней выживаемости у 80% больных. Для пациентов с 3-4 стадией заболевания, лечение дополняется лучевой терапией на зоны массивного и экстранодального опухолевого поражения.
Лечение пациентов из групп промежуточно-высокого и высокого риска подбирается индивидуально с учетом возраста и состояния больного по шкале ECOG. Молодым пациентам с хорошим соматическим состоянием назначаются более агрессивные схемы лечения, предполагающие проведение высокодозной химиотерапии с трансплантацией гемопоэтических стволовых клеток (ГСК). При высоких рисках поражения нервной системы проводится несколько циклов интратекальной химиотерапии, когда препараты вводят в спинномозговой канал. Пожилым и слабым пациентам подбираются более щадящие схемы. Оценка эффективности лечения производится в середине циклов химиотерапии и после их окончания.
Современное состояние проблемы
В августе 2012 г. Американское общество пластических хирургов (American Society of Plastic Surgeons — ASPS), Фонд пластической хирургии (Plastic Surgery Foundation — PSF) и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration —FDA) подписали соглашение о совместных исследованиях и разработках, направленное на развитие инфраструктуры, в которой были бы централизованно собраны все случаи BIA-ALCL. Результатом этой совместной работы стал Реестр пациентов и результаты лечения имплантат-ассоциированной анапластической крупноклеточной лимфомы, этиология и эпидемиология (Patient Registry and Outcomes For breast Implants and anaplastic large cell Lymphoma etiology and Epidemiology — PROFILE).
В 2021 г. Национальная комплексная сеть по борьбе с раком (National Comprehensive Cancer Network — NCCN) разработала принципы диагностики и лечения BIA-ALCL [5, 6]. Руководство NCCN по BIA-ALCL было впоследствии признано FDA, а также национальными обществами пластической хирургии.
По оценкам разных авторов, заболеваемость BIA-ALCL варьирует от 0,1 до 0,3 на 100 000 женщин с грудными имплантатами в год. При этом 1 из 500 000 женщин с текстурированными грудными имплантатами рискует заболеть через 1 год после вмешательства [7].
Недавние исследования в Австралии и Новой Зеландии выявили резкий рост заболеваемости BIA-ALCL. В общей сложности 56 случаев BIA-ALCL были подтверждены к 2021 г., еще 26 новых случаев были диагностированы в период с января 2021 г. по апрель 2021 г. Заболеваемость была впоследствии пересмотрена с 1 на 300 000 до 1 на 1000—10 000 женщин с имплантатами1.
В январе 2021 г. было зафиксировано 414 сообщений о случаях BIA-ALCL, из них 9 с летальным исходом2. К февралю 2021 г. было зарегистрировано 518 больных BIA-ALCL в 25 странах, в том числе 194 в США3. Согласно данным от апреля 2021 г., во всем мире число больных возросло до 570, включая 16 смертей4 [8].
По состоянию на 1 декабря 2021 г. реестр PROFILE включал сведения о более чем 250 пациентах с BIA-ALCL, а ASPS отследило в общей сложности более 573 случаев, в том числе 33 с летальным исходом5 [9].
Самые последние данные о количестве диагностированных случаев представлены в настоящее время на сайте ASPS. На 3 сентября 2021 г. зарегистрировано 779 пациентов по всему миру4.
Анализ случаев возникновения BIA-ALCL, проведенный G. Brody и соавт. [10], выявил существенную вариабельность заболеваемости во всем мире — с самой низкой относительной заболеваемостью в еврозоне, Китае и Бразилии. В настоящее время наибольший зарегистрированный уровень заболеваемости наблюдается в Австралии и Новой Зеландии (1/2832 в зависимости от типа имплантата) [10]. В скандинавских странах до недавнего времени практически не было сообщений о случаях BIA-ALCL. Интересно, что, по данным производителей, 70—80% имплантатов, продаваемых в Европе, текстурированы. Следовательно, можно предположить, что, как и в случае большинства опухолевых заболеваний, генетическая предрасположенность и этническая принадлежность при BIA-ALCL могут играть важную роль [11].
Согласно обзору мировой литературы, наибольшая заболеваемость присуща странам, в которых существуют государственные регистры пациентов с BIA-ALCL, например США, Австралии, Франции, Италии и Великобритании. Видимо, это связано преимущественно с тем, что происходит стандартизированный сбор данных обо всех имплантатах, а также случаях их удаления или замены. С другой стороны, наличие регистров косвенно указывает на высокий уровень осведомленности медицинского сообщества этих стран о проблеме BIA-ALCL. Возможно, до настоящего времени не существует реального представления о распространенности BIA-ALCL среди женщин с имплантатами молочных желез.
Следуя рекомендациям FDA США, в 2011 г. производители имплантатов добавили предупреждение о риске возникновения BIA-ALCL на вкладыши упаковок грудных имплантатов. Всем пациентам, которым планируется эндопротезирование молочных желез, необходимо подписать информированное добровольное согласие, которое преследует три основные цели: 1) информирование пациентов о существовании этого редкого заболевания; 2) объяснение пациенту распространенных симптомов, таких как появление опухолевых масс в молочных железах и возникновение перипротезного выпота; 3) настойчивую рекомендацию пациентам срочно обратиться к врачу в случае появления этих симптомов [12].
Рецидивы крупноклеточной лимфомы
При лечении диффузной В-крупноклеточной лимфомы долгосрочной ремиссии удается достичь в 70-80 % случаев, но у ряда пациентов возникает рецидив. Лечение рецидивов проводится по следующей схеме:
- Химиотерапия второй линии. Она должна подавить опухолевый рост, в то же время не нанося ущерба гемопоэтическим стволовым клеткам.
- Сбор ГСК.
- Высокодозная химиотерапия. Используются высокие дозы цитостатиков, которые уничтожают самые стойкие опухолевые клетки, но они же губят и кроветворение, поэтому чтобы его восстановить проводят следующий этап.
- Трансплантация гемопоэтических стволовых клеток, которая призвана восстановить кроветворение.
У пациентов из групп высокого риска, которые уже прошли аутологичную трансплантацию, и получили рецидив диффузной лимфомы, проводят аллогенную трансплантацию, т. е. используют стволовые клетки доноров. В этих случаях также есть шансы на полную ремиссию, но они не превышают 50%.
Осложнения диффузной В крупноклеточной лимфомы
Химиотерапия и лучевая терапия диффузной крупноклеточной лимфомы пагубно влияют не только на злокачественную опухоль, но и на все быстро делящиеся клетки. Это кроветворные клетки, эпителий кожи и слизистых оболочек и др. Поэтому в процессе лечения и восстановления большое внимание уделяется профилактике осложнений. В первую очередь, это борьба с инфекциями (бактериальными, вирусными, грибковыми), нарушением кровесвертывающей системы и работы пищеварительного тракта.
Помимо этого, в долгосрочной перспективе есть риск развития следующих осложнений:
- Возникновение других злокачественных опухолей: рак легкого, молочной железы, желудка, а также лейкозов и других видов лимфом. Наибольшие риски отмечаются в первые десятилетия после прекращения лечения.
- Кардиоваскулярные осложнения: нарушение работы миокарда, быстрый атеросклероз кровеносных сосудов, повреждение клапанов сердца и др.
- Поражение легких: пульмониты, пневмосклероз и пневмофиброз.
- Осложнение со стороны эндокринной системы: гипотиреоз, бесплодие, нарушение сперматогенеза.
Факторы риска развития BIA-ALCL
BIA-ALCL может развиться, если ваши грудные имплантаты заполнены силиконом или физраствором. Чаще это возникает у тех, у кого установлены грудные имплантаты с шероховатой, а не гладкой поверхностью, но при этом риск развития BIA-ALCL все еще остается низким. Информацию о том, является ли поверхность имплантата шероховатой или гладкой, можно найти с помощью карточки-идентификатора грудного имплантата. На ней должен быть указан веб-сайт производителя имплантата, на котором можно найти дополнительную информацию. Вы также можете позвонить в офис вашего врача.
Вернуться к началу
Прогноз и профилактика крупноклеточной лимфомы
Прогноз течения диффузной В крупноклеточной лимфомы зависит от показателя IPI. Чем больше баллов, тем хуже прогноз. Для больных, имеющих 4-5 баллов (высокий риск), пятилетняя выживаемость колеблется в пределах 31%. При низких рисках пятилетняя выживаемость составляет около 91%.
Что касается специфической профилактики, то ее на сегодняшний день не существует, а все рекомендации для минимизации риска заболевания сводятся к ведению здорового образа жизни и правильному питанию.
Запись на консультацию круглосуточно
+7+7+78
Этиология заболевания
В свете последних исследований предполагается, что наиболее вероятно риск заболевания BIA-ALCL напрямую связан с текстурой поверхности имплантата молочной железы и наиболее высок у генетически предрасположенных женщин [12]. Текстурированные имплантаты подвержены образованию на их поверхности биопленок [11], представляющих собой сообщества бактерий, которые образуются на поверхности раздела фаз, например твердое вещество/жидкость. Бактерии биопленки примечательны тем, что окружены слизисто-полимерным матриксом из продуцируемых ими внеклеточных веществ и чрезвычайно устойчивы к воздействию ультрафиолетового излучения, дегидратации и вирусам, антибиотикам и факторам иммунной защиты. M. Kadin и соавт. [13] выдвинули гипотезу, что BIA-ALCL связан с хронической бактериальной стимуляцией Th1/Th17-антигенуправляемых T-клеток памяти в тканях перипротезной капсулы и, как следствие, устойчивой пролиферацией T-клеток с последующими генетическими событиями в патогенезе BIA-ALCL [14]. H. Hu и соавт. [15] сравнили капсулы имплантатов пациентов с BIA-ALCL и капсулярной контрактурой, обнаружив более высокую бактериальную нагрузку и значительно отличающийся микробиом в образцах BIA-ALCL. Авторами было выявлено большое количество бактерий Ralstonia pickettii
(распространенный грамотрицательный загрязнитель питьевой воды), которые, возможно, играют не последнюю роль в этиологии заболевания, что еще предстоит выяснить.
Первоначальное понимание патогенеза и молекулярных факторов BIA-ALCL было получено с помощью проточной иммуногистохимической (ИГХ) цитометрии и функциональных экспериментов при описании иммунофенотипов клеточных линий, полученных из опухолей пациентов. Клетки BIA-ALCL демонстрировали положительное окрашивание на CD30 (белок клеточной мембраны), которое при наличии анапластической цитоморфологии и соответствующей клинической картины следует считать отличительной чертой BIA-ALCL [16, 17]. В норме пул CD30+ T-клеток составляет от 0,1 до 5% всех циркулирующих T-клеток, а при воспалительных состояниях организма их концентрация может существенно повышаться. Повышенная экспрессия CD30 может быть индуцирована как на Т-клетках, так и на В-клетках в результате вирусной инфекции. Описано, что CD30±лимфоциты способны временно увеличиваться с фонового уровня 0,1 до 95% [18]. Другими Т-клеточными антигенами, экспрессируемыми в злокачественных клетках, являются CD3, CD4/8, CD5 и CD7 [19]. В большинстве случаев BIA-ALCL-опухолевые клетки при проведении ИГХ-исследования положительно окрашиваются на множественную миелому 1 (MUM1) (интерферон-регуляторный фактор 4) [20]. Геномная характеристика BIA-ALCL показывает сходные молекулярные аномалии с ALK-негативной системной анапластической крупноклеточной лимфомой (sALCL), включая активацию JAK/STAT и дисрегуляцию MYC/TP53, однако клинически заболевание протекает гораздо менее агрессивно [20]. Другие исследования также отметили случаи возникновения BIA-ALCL у женщин с приобретенными JAK/STAT-мутациями зародышевой линии [21] и, кроме того, связь заболевания с синдромом Ли—Фраумени, который возникает при наличии мутации онкогена p53 [22, 23]. В таких случаях реконструкция молочной железы с использованием текстурированных грудных имплантатов у женщин после мастэктомии по поводу рака молочной железы совершенно нецелесообразна.