Общая характеристика
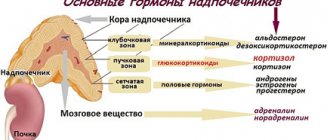
Альдостерон — основной минералокортикоидный гормон коры надпочечников, регулятор водно-солевого гомеостаза. Синтезируется из холестерина в клетках клубочковой зоны коры надпочечников. Под его влиянием происходит задержка в организме натрия (преобладающая над задержкой воды) и выделение ионов калия и водорода. Главные регуляторы секреции альдостерона – ренин-ангиотензиновая система, активизирующаяся в ответ на колебания ОЦК, а также уровень калия в крови. Гиперкалиемия стимулирует, а гипокалиемия подавляет продукцию альдостерона. При гипокалиемии перед исследованием необходимо восполнить дефицит калия. Содержание альдостерона в крови изменяется в течение суток (самая низкая концентрация около полуночи) и в зависимости от положения тела (повышается при переходе в вертикальное положение). Содержание альдостерона увеличивается в лютеиновую фазу менструального цикла и во время беременности. У пациентов старше 60 лет уровень альдостерона снижается на 50%, что важно учитывать при интерпретации результатов. Повышенное потребление соли ведет к снижению уровня альдостерона крови, сниженное – к повышению его концентрации. Метаболизируется альдостерон в печени и почках. Также см. Альдостерон-Рениновое соотношение.
Как сдавать анализ
Для анализа нужна венозная кровь, взятая строго натощак. Наиболее подходящее время для проведения процедуры – с 8 до 11 часов утра. Повторные исследования следует проводить в одно и то же время суток.
Главным методом исследования биоматериала является иммуноферментный метод (ИФА). Альдостерон в сыворотке крови обнаруживается благодаря добавлению в нее меченого реагента. Он связывается только с данным гормоном и при этом окрашивает все исследуемое вещество. Уровень альдостерона определяется по интенсивности окрашивания сыворотки крови.
Правила подготовки пациента
венозная кровь
Стандартные условия подготовки (если иное не определено врачом):
За 2 недели Согласовать с врачом прием: препаратов из корня солодки, диуретиков, гипотензивных препаратов, оральных контрацептивов. За 3 дня питание без ограничения соли. За 4 часа Выдержать голодание, исключить жирную пищу. Можно пить воду. За 2 часа находиться в вертикальном положении (стоя, сидя). За 5 минут посидеть за манипуляционным столом.
Примечания:
во вложении.
АРС.pdf
Вы можете добавить данное исследование в корзину на этой странице
Клиническая картина альдостеромы — первичного гиперальдостеронизма
Клинические признаки первичного гиперальдостеронизма представлены тремя основными синдромами: сердечно-сосудистым (гипертензионным) нервно-мышечным и почечным.
Сердечно – сосудистый (гипертензионный) синдром альдостеромы — первичного гиперальдостеронизма
Артериальная гипертензия является одним из наиболее типичных симптомов первичного гиперальдостеронизма. Ее наблюдают практически у всех больных с первичным гиперальдостеронизмом, а в некоторых случаях она может быть даже единственным клиническим проявлением этого заболевания (Conn J. et al.,1964). Артериальная гипертензия имеет, как правило, постоянный характер. Вместе с тем у некоторых больных повышение АД имеет форму кризов; возможна также транзиторная артериальная гипертензия.
Уровень артериального давления колеблется от умеренно повышенных цифр (150-160 и 90-100 мм.рт.ст.) до очень высоких (250-280 и 130-140 мм.рт.ст. Патофизиологическую основу такой гипертензии составляют задержка натрия в тканях и гиперволемия, отек интимы, уменьшение просвета сосудов, значительное увеличение периферического сопротивления. Кроме того, высокое содержание натрия в стенках кровеносных сосудов и обеднение клеток калием повышают чувствительность сосудов к воздействию прессорных факторов.
Нервно-мышечный синдром первичного гиперальдостеронизма
Нарушения нервно-мышечной системы у больных обусловлены преимущественно гипокалиемией, изменением градиентов концентрации вне- и внутриклеточного калия, калиево-натриевого коэффициента, внутриклеточным ацидозом, и в итоге — дистрофическими изменениями в мышечной и нервной тканях. Больные, как правило, жалуются на резко выраженную мышечную слабость, которая наблюдается в 70% случаев. Степень миастении различна от умеренной усталости и быстрой утомляемости до псевдопаралитических состояний. Миастения может либо быть распространенной, либо охватывать определенное группы мышц, чаще нижних конечностей. Описаны парестезии Хвостека (Weinberger M. et al.,1979)
Почечный синдром альдостеромы — первичного гиперальдостеронизма
Гипокалиемия и гипернатриемия являются также основной причиной развития калиепенической нефропатии, которая проявляется снижением концентрационной способности почек, полиурией, изогипостенурией, никтурией, обостренным чувством жажды и полидипсией.
Интерференция:
- Калийсберегающие диуретики, гиперкалиемия, ангиотензин, эстрогены, слабительные средства при хроническом злоупотреблении с развитием дегидратации, мочегонные, метоклопрамид, пероральные контрацептивы, тиазидные диуретики, ограничение соли, беременность, реноваскулярная артериальная гипертензия. Также см.Альдостерон-Рениновое соотношение.
- Бета-блокаторы, центральные альфа 2 – миметики, нестероидные противовоспалительные препараты, ингибиторы АПФ, блокаторы ангиотензиновых рецепторов, блокаторы кальциевых каналов (группа дигидропиридина), аминоглютетимид, этомидат, продолжительное лечение гепарином, лакрица, дезоксикортикостерон, глюкокортикоиды, гипокалиемия, ингибиторы ренина, избыток соли, пожилой возраст
Первичный гиперальдостеронизм (синдром Конна)
Рис.1. Расположение и кровоснабжение надпочечника в норме
К первичному гиперальдостеронизму (ПГА) относят заболевание, при котором избыточная продукция альдостерона является автономной, не зависящей от влияния различных регулирующих факторов — в отличие от вторичного, сопутствующего ряду заболеваний повышения секреции альдостерона. Первичный гиперальдостеронизм рассматривают в качестве самостоятельной нозологической формы, тогда как вторичный обусловливает лишь ряд специфических симптомов при различных по этиологии и патогенезу заболеваниях почек, печени и других органов. Точных данных о частоте ПГА нет, поскольку многие пациенты не попадают в поле зрения эндокринологов. Вместе с тем такие больные составляют значительную часть страдающих артериальной гипертензией.
Этиология и патогенез альдостеромы — первичного гиперальдостеронизма
Морфологически субстратом первичного гиперальдостеронизма является опухоль надпочечника, реже гиперплазия коркового вещества надпочечников. По данным J.Conn (1955,1964), одиночные аденомы (альдостеромы) встречаются у 70-90 % больных, множественные – у 10-15%, гиперплазия коры надпочечников — 9%. В целом опухолевые поражения надпочечников, как причина первичного гиперальдостеронизма наблюдаются в 85% случаев, причем у 2-6% больных они носят злокачественный характер.
По современным представлениям, распространенность первичного гиперальдостеронизма (ПГА) у больных с АГ составляет 10-17% и до 30% при вторичных (симптоматических) АГ. Альдостерон-продуцирующяя аденома выявляется в 10-15% среди всех форм ПГА. Необходимо отметить, что при случайно выявленных опухолях встречаемость альдостером крайне мала и не превышает 1%, тем не менее наибольшее число необоснованных адреналэктомий связано с гипердиагностикой именно альдостеромы.
Первичный гиперальдостеронизм встречается преимущественно у взрослых лиц. Альдостерома в большинстве случаев – одиночная, четко очерченная инкапсулированная опухоль массой 1-3г, диаметром до 3 см. На разрезе охряно-желтого, охряно-золотисто-желтого цвета с гладкой поверхностью.
Лечение альдостеромы — первичного гиперальдостеронизма
Лечение первичного гиперальдостеронизма, обусловленного альдостеронсекретирущей аденомой коры одного из надпочечников, оперативное. Медикаментозные методы показаны при легких формах заболевания, обусловленных двусторонней идиопатической гиперплазией коркового вещества надпочечников, а также в период подготовки больных к операции.
Хирургическое лечение первичного гиперальдостеронизма, обусловленного альдостеромой, является единственным радикальным методом лечения и заключается в удалении альдостеромы (парциальная с сохранением органа или односторонняя адреналэктомия).
Посмотреть видео операций при опухолях надпочечника в исполнении профессора Пучкова К.В. Вы можете на сайте «Видео операций лучших хирургов мира».
Пациенты, как правило, не нуждаются в проведении специальной предоперационной подготовки и заместительной гормональной терапии в раннем послеоперационном периоде. Выбор операционного доступа, проведение операции, анестезия и интенсивная терапия у больных с альдостеромой не имеют каких либо специфических особенностей.
При альдостеронизме, обусловленном диффузно-узловой гиперплазией коркового вещества надпочечников, показания к операции еще четко не выработаны и существующие мнения хирургов неоднозначны.
Роль антагонистов альдостерона в лечении сердечно-сосудистых заболеваний
Уважаемый Вячеслав Юрьевич! Сегодня мы хотели бы поговорить с вами о роли антагонистов альдостерона в современной кардиологической практике и определить контингент пациентов, для которых наиболее важно применение препаратов данной группы.
Ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в развитии и прогрессировании сердечно-сосудистых заболеваний (ССЗ), на сегодняшний день ее значимость общепризнана. С течением времени определяются новые тканевые и гемодинамические эффекты отдельных ее составляющих и конечного продукта этой цепи — альдостерона. Альдостерон — стероидный гормон, синтезируемый преимущественно в коре надпочечников под влиянием ангиотензина II. Он также присутствует в сосудистой стенке, сердце, головном мозге и жировой ткани, что обусловливает его эффекты.
Для понимания роли альдостерона важно знать, что в результате активации рецепторов альдостерона в дистальных канальцах почек увеличивается реабсорбция ионов натрия и водорода в обмен на ионы калия, выводящиеся из организма, что вызывает антидиуретические эффекты, проявляющиеся задержкой жидкости в организме и повышением артериального давления (АД). Хроническая активация миокардиальных рецепторов сопровождается развитием фиброза и ремоделированием миокарда, что лежит в основе формирования хронической сердечной недостаточности (ХСН), которая является исходом большинства ССЗ. Также гиперактивация эндотелиальных рецепторов альдостерона ведет к ремоделированию сосудистой стенки, гипертрофии медии и гиперплазии эндотелия. Кроме того, альдостерон активирует симпатический отдел вегетативной нервной системы, увеличивает свободнорадикальное окисление, что обусловливает развитие воспаления, ремоделирования, апоптоза и фиброза.
Таким образом, назначение антагонистов альдостерона при различных клинических состояниях, сопровождающихся явлениями гиперальдостеронизма, обосновано с патофизиологической точки зрения, эти препараты давно с успехом применяются в клинической практике.
Что касается пациентов, которым необходим прием антагонистов альдостерона, то это прежде всего лица, страдающие ХСН, артериальной гипертензией (АГ), в особенности ее резистентной формой. Также данные препараты применяются при лечении цирроза печени с отечным синдромом, нефротического синдрома, гипокалиемии и первичного гиперальдостеронизма.
Какие антагонисты альдостерона применяются в современной кардиологии?
Наиболее широко применяемым антагонистом альдостерона является спиронолактон — структурный аналог альдостерона. Данный препарат под названием «молекула БС-8109» был разработан в середине 1950-х годов. Спиронолактон как калийсберегающий диуретик применялся у больных с отечным синдромом вследствие ХСН и портального цирроза печени. Именно диуретические свойства высоких доз Верошпирона при одновременной блокаде потери калия и магния стали основным показанием к его использованию на протяжении четверти века. Эти эффекты и методика его использования были подробно описаны в нашей с академиком Н.М. Мухарлямовым, моим учителем, монографии по лечению ХСН, вышедшей в свет в 1985 году.
Затем, в 1980-е годы, было доказано наличие альдостероновых рецепторов в миокарде и эндотелии сосудов. К концу ХХ века антагонисты альдостерона или, как их стали называть, антагонисты минералокортикоидных рецепторов (АМКР) начали применять в качестве нейрогормональных модуляторов при длительном лечении ХСН. Это подробно обсуждалось в нашей с академиком Ю.Н. Беленковым монографии по рациональному лечению ХСН, опубликованной в 2000 году.
Уже в 1960-х годах спиронолактон продемонстрировал свою эффективность при АГ, но широкое распространение в клинической практике как гипотензивное средство он получил лишь во втором десятилетии XXI века.
Также в кардиологии применяется эплеренон, который является химическим производным мексренона — метаболита спиронолактона. Спиронолактон и эплеренон являются конкурентными антагонистами минералокортикоидных рецепторов, но обладают разной степенью селективности к ним.
Существует еще один препарат — канренон, который не зарегистрирован в Российской Федерации. В настоящее время третью фазу клинических исследований проходит первый антагонист альдостерона нестероидной структуры — финнеренон. Как видим, интерес к этому классу препаратов, несмотря на более чем 60-летнюю историю их применения, растет.
Чем определяется эффективность спиронолактона в лечении пациентов с ССЗ и какими фармакологическими характеристиками он обладает?
Спиронолактон представляет собой неселективный конкурентный антагонист минералокортикоидных рецепторов. Блокируя рецепторы альдостерона, он оказывает диуретическое и натрийуретическое действие, сохраняя при этом в организме ионы калия и магния. Так как в дистальных отделах нефрона реабсорбируется небольшое количество натрия, диуретический эффект применения спиронолактона не слишком значительный, однако его мочегонное действие существенно усиливается при применении с петлевыми и тиазидными диуретиками.
Спиронолактон по структуре близок к прогестерону, в связи с этим он обладает свойствами агониста прогестероновых рецепторов и слабого антагониста андрогеновых и кортикостероидных рецепторов, что может привести к таким нежелательным явлениям, как гинекомастия, нарушения менструального цикла, снижение либидо и гирсутизм. Однако необходимо учитывать, что нежелательные явления имеют дозозависимый характер. Так, в крупном рандомизированном клиническом исследовании RALES при лечении пациентов спиронолактоном в дозах 25–50 мг/сут частота возникновения гинекомастии не превышала 8,5%.
Спиронолактон является пролекарством, в печени образуются его активные метаболиты — канреноат и канренон. Период полувыведения спиронолактона составляет 13–24 часа, что в значительной степени обусловлено активными метаболитами, которые продолжают оказывать действие за пределами «терапевтического окна». Время достижения максимальной концентрации в плазме после утреннего приема составляет 2–6 часов. Выводится препарат преимущественно почками.
Какая доказательная база существует у спиронолактона при резистентной АГ и ХСН?
Антагонисты альдостерона, в частности спиронолактон, позволяют блокировать негативные эффекты избыточной активации РААС на всех этапах сердечно-сосудистого континуума. При этом польза от применения данного препарата при резистентной АГ и ХСН максимальна.
Если говорить о ведении пациентов, страдающих АГ, то спиронолактон является важным компонентом терапии резистентной АГ. Напомню, что АГ считается резистентной, когда не удается достичь снижения офисных показателей АД <140/90 мм рт. ст. (по рекомендациям 2021 года — ниже 130/80 мм рт. ст. для лиц моложе 65 лет) на фоне применения рекомендованной тактики лечения, которая должна включать мероприятия по модификации образа жизни и прием оптимальных доз минимум трех препаратов: диуретика, ингибитора ангиотензинпревращающего фермента (АПФ) или блокатора рецепторов ангиотензина и блокатора кальциевых каналов. При подозрении на резистентную АГ необходимо исключить вторичные формы АГ и псевдорезистентность, причинами которой могут быть низкая приверженность лечению, феномен «белого халата», нарушение правил измерения АД, выраженный кальциноз плечевой артерии, применение вазопрессоров или веществ, способствующих задержке натрия, и другое.
По данным исследования PATHWAY-2 (Prevention And Treatment of Hypertension With Algorithm-based therapy number 2), спиронолактон оказался эффективным и безопасным у отдельных групп пациентов с резистентной АГ, например при синдроме ночного апноэ, ожирении, хронической болезни почек. В данном исследовании спиронолактон в сравнении с бисопрололом и доксазозином обладал максимальным гипотензивным эффектом при добавлении к трехкомпонентной комбинации из ингибитора АПФ (или блокатора рецепторов к ангиотензину), антагониста кальция и диуретика в максимальных дозах.
Спиронолактон также играет важную роль в лечении ХСН на протяжении уже 40 лет. Доказано, что гиперальдостеронемия негативно влияет на прогноз и выживаемость больных с ХСН за счет прогрессирования декомпенсации ХСН и увеличения риска внезапной смерти.
Все пациенты, страдающие ХСН (при отсутствии абсолютных противопоказаний), с целью блокады РААС должны получать ингибиторы АПФ. Однако оказалось, что монотерапия ингибиторами АПФ не в полной мере блокирует негативные эффекты РААС, что связано с наличием АПФ-независимых путей образования ангиотензина II (химазы и другие ферменты). Именно этот эффект уменьшения способности ингибиторов АПФ снижать секрецию альдостерона, описанный нами еще в 1990-х годах, получил название «феномена выскальзывания блокады». Причем данный феномен развивается у пациентов независимо от дозы ингибиторов АПФ и проявляется уже к третьему месяцу непрерывного лечения, что впервые было показано нашей группой в 1990 году. Также имеются данные о том, что при длительном применении ингибиторов АПФ при ХСН активируются альтернативные пути стимуляции синтеза альдостерона, не связанные с ангиотензином II, а опосредованные эндотелином, антидиуретическим гормоном, кортикотропином и гистамином. Выявление указанных дополнительных активаторов синтеза альдостерона послужило обоснованием целесообразности применения ингибиторов минералокортикоидных рецепторов в комбинации с ингибитором АПФ (и бета-адреноблокаторами) для более полной нейрогуморальной блокады при лечении больных с ХСН, что было подтверждено результатами рандомизированных плацебо-контролируемых исследований.
Клинически достоверность этой гипотезы в 1999 году была подтверждена результатами двойного слепого плацебо-контролируемого исследования RALES (Randomized ALdactone Evaluation Study). В данное исследование были включены больные с тяжелой ХСН (III–IV функциональный класс по классификации Нью-Йоркской ассоциации кардиологов (NYHA)), которые получали спиронолактон в дозе 25–50 мг/сут или плацебо в дополнение к стандартной для того времени терапии ингибиторами АПФ, диуретиками и сердечными гликозидами (почти без β-адреноблокаторов). Исследование было прекращено досрочно из-за очевидного преимущества спиронолактона перед плацебо. В результате трехлетнего наблюдения было показано, что применение спиронолактона позволяет достоверно снизить риск смерти на 27%, общее число госпитализаций — на 18%, а число госпитализаций в результате декомпенсации ХСН — на 30%. На основании результатов исследования RALES спиронолактон был включен в европейские, американские и российские клинические рекомендации по лечению больных с ХСН.
Таким образом, антагонисты альдостерона давно и широко вошли в клиническую практику и не уступают своих позиций уже много лет, однако практикующим врачам важно помнить о том, что именно эти препараты часто остаются «за бортом», несмотря на их обширную доказательную базу. В США и Европе, например, эти препараты назначаются только трети больных, которые в них нуждаются. В России при стационарном лечении чуть больше половины больных с ХСН и ФВЛЖ <40% принимают АМКР, но при переходе на амбулаторный этап лечения, по данным исследования ЭПОХА, проведенного в 2021 году, лишь 14% больных принимают спиронолактон. При этом не только больные не принимают или прекращают прием антагонистов альдостерона, но и врачи недостаточно часто назначают данные препараты.
Какое место в клинических рекомендациях антагонисты альдостерона занимают в настоящее время?
В европейских клинических рекомендациях 2021 года по ведению пациентов с АГ важная роль в лечении резистентной АГ отводится именно АМКР как главному «помощнику» основной антигипертензивной терапии, включающей блокаторы РААС + блокаторы медленных кальциевых каналов + диуретики. В данном документе отмечено, что терапия четвертой линии на третьей ступени должна включать в себя спиронолактон в дозе 25–50 мг/сут. Основные исследования по лечению резистентной АГ проводились именно со спиронолактоном. Также акцент сделан на необходимость контроля уровня калия и скорости клубочковой фильтрации (СКФ) почек. Больным с резистентной АГ спиронолактон назначается при СКФ ≥45 мл/мин/1,73 м2 и концентрации калия в плазме ≤4,5 ммоль/л. В рекомендациях, опубликованных Российским кардиологическим обществом и одобренных научно-практическим советом Министерства здравоохранения РФ в начале 2021 года, также сказано, что всем пациентам с резистентной АГ рекомендовано добавление к проводимой терапии спиронолактона в дозах 25–50 мг/сут для достижения целевого уровня АД. При этом применение спиронолактона противопоказано пациентам с СКФ ≤30 мл/мин/1,73 м2 и концентрацией калия в плазме ≥5 ммоль/л из-за риска гиперкалиемии. В данном случае рекомендовано использовать петлевые диуретики.
Что касается сердечной недостаточности, то в европейских рекомендациях по диагностике и лечению острой и хронической сердечной недостаточности от 2021 года указано, что спиронолактон рекомендуется всем пациентам с ХСН II–IV функционального класса по NYHA (несмотря на лечение ингибиторами АПФ и бета-адреноблокаторами) со сниженной ФВЛЖ ≤ 35% с целью снижения смертности и числа госпитализаций по поводу сердечной недостаточности. С осторожностью нужно назначать этот препарат пациентам с нарушением функции почек (креатинин >221 мкмоль/л или СКФ <30 мл/мин/1,73 м2), для чего должен проводиться регулярный контроль в зависимости от клинического статуса пациента, также необходимо строго учитывать потенциальные лекарственные взаимодействия. Стартовая доза спиронолактона составляет 25 мг/сут, поддерживающая — 50 мг/сут, дозу рекомендовано повышать через 4–8 недель терапии. Также в рекомендациях особо указано на необходимость информирования пациента о том, что данное лечение проводится для улучшения его самочувствия, выживаемости и предотвращения ухудшения течения сердечной недостаточности и уменьшения количества госпитализаций; о том, что симптоматическое улучшение на фоне приема антагонистов альдостерона наступает не сразу — должно пройти от нескольких недель до нескольких месяцев с момента начала лечения; о том, что необходимо избегать приема нестероидных противовоспалительных препаратов, не прописанных врачом, и заменителей соли с высоким содержанием К+.
С моей точки зрения, доступное разъяснение пациенту механизмов действия и причин назначения ему данных препаратов — очень важный этап лечения, помогающий улучшить связь врача и пациента и повысить приверженность лечению.
В совместных рекомендациях Общества специалистов по сердечной недостаточности (ОССН) — Российского кардиологического общества (РКО) и Российского научного медицинского общества терапевтов (РНМОТ) от 2021 года показаниями к применению спиронолактона (25–50 мг/сут) служат выраженная ХСН III–IV ФК и случаи острой декомпенсации кровообращения, когда препарат применяется в высоких дозах. При ХСН (начиная со II ФК) и у больных, перенесших острый инфаркт миокарда, при дисфункции левого желудочка показано применение АМКР (спиронолактона или эплеренона) в дозах 25–50 мг/сут. Также отмечено, что при наличии повышенного уровня креатинина >130 мкмоль/л, почечной недостаточности в анамнезе, снижении СКФ <30 мл/мин/1,73 м2, гиперкалиемии (причем даже умеренной — >5,2 ммоль/л) сочетание антагонистов альдостерона с ингибиторами АПФ требует тщательного клинического и лабораторного контроля. Необходимо контролировать уровень калия и креатинина сыворотки и расчет СКФ через 2 и 4 недели, затем через 2 и 3 месяца лечения, а потом 1 раз в полгода, что позволяет минимизировать число побочных реакций.
О чем должен помнить врач, назначая спиронолактон своим пациентам?
При лечении декомпенсации невозможно эффективно и безопасно проводить дегидратационную терапию без использования высоких доз спиронолактона в качестве калий- и магнийсберегающего диуретика.
При длительной терапии только использование тактики «тройной нейрогормональной блокады» реально продлевает жизнь пациентов и улучшает ее качество. Врач должен объяснять своим пациентам цели терапии. Только так можно повлиять на приверженность терапии и повысить число принимающих спиронолактон пациентов. Как уже говорилось, сейчас их доля недопустимо мала — только 14%.
Наконец, необходимо помнить, что каждый третий пациент с АГ не может достичь цели по снижению АД с помощью трех основных антигипертензивных препаратов. Решением проблемы является использование АМКР, причем их эффективность нарастает при повышенном потреблении соли (бич российской популяции) и неснижении АД ночью.
Важную роль играет также качество принимаемого препарата. Так, первым спиронолактоном, появившимся на фармацевтическом рынке Российской Федерации, стал Верошпирон — препарат . В настоящее время в России Верошпирон является референтным и невзаимозаменяемым спиронолактоном, который мы можем рекомендовать нашим пациентам.
Таким образом, несмотря на появление новых препаратов, обладающих способностью блокировать эффекты РААС или иными механизмами гипотензивного действия, спиронолактон не только не утратил своих позиций, а продолжает демонстрировать эффективность в различных клинических ситуациях.
Благодарность
Редакция благодарит ООО «Гедеон Рихтер Фарма» за помощь в организации и проведении данного интервью.
Сниженный уровень альдостерона
При дефиците альдостерона в почках снижается концентрация натрия, замедляется выведение калия, нарушается механизм ионного транспорта по тканям. В результате нарушается кровоснабжение головного мозга и периферических тканей, снижается тонус гладкомышечной мускулатуры, угнетается вазомоторный центр.
Гипоальдостеронизм требует пожизненного лечения, прием препаратов и ограниченное потребление калия позволяет добиться компенсации заболевания.
Гипоальдостеронизм – это комплекс изменений в организме, вызванных снижением секреции альдостерона. Выделяют первичный и вторичный гипоальдостеронизм.
Первичный гипоальдостеронизм чаще всего носит врожденный характер, первые проявления его наблюдаются у грудных детей. В его основе лежит наследственное нарушение биосинтеза альдостерона, при котором потеря натрия и артериальная гипотензия повышают продукцию ренина.
Заболевание проявляется электролитными нарушениями, дегидратацией, рвотой. Первичная форма гипоальдостеронизма имеет тенденцию к спонтанной ремиссии с возрастом.
В основе вторичного гипоальдостеронизма, который проявляется в юношеском или взрослом возрасте, лежит дефект биосинтеза альдостерона, связанный с недостаточной продукцией ренина почками или сниженной его активностью. Эта форма гипоальдостеронизма часто сопутствует сахарному диабету или хроническому нефриту. Развитию заболевания также может способствовать длительное применение гепарина, циклоспорина, индометацина, блокаторов ангиотензиновых рецепторов, ингибиторов АПФ.
Симптомы вторичного гипоальдостеронизма:
- слабость;
- интермиттирующая лихорадка;
- ортостатическая гипотония;
- сердечная аритмия;
- брадикардия;
- обмороки;
- снижение потенции.
Иногда гипоальдостеронизм протекает бессимптомно, в этом случае он обычно является случайной диагностической находкой при обследовании по другому поводу.
Различают также врожденный изолированный (первичный изолированный) и приобретенный гипоальдостеронизм.