Острым миелобластным лейкозом (наиболее часто используемая аббревиатура — ОМЛ) называют злокачественную патологию крови и костного мозга, характеризующуюся бесконтрольным продуцированием незрелых (бластных) миелоцитарных клеток — эритроцитов, гранулоцитов, нейтрофильных лейкоцитов, тромбоцитов. Заболевание диагностируется в случаях, когда в миелограмме обнаруживается свыше 20% незрелых клеток. Его характерной особенностью является быстрое течение: в течение нескольких месяцев незрелые клетки начинают преобладать в составе крови, из-за чего она перестаёт выполнять свои основные функции. Состояние больного резко ухудшается, и при отсутствии лечения прогноз крайне неблагоприятен.
Виды
Онкогематологи различают несколько десятков разновидностей острого миелоидного лейкоза, которые группируются по сходным признакам:
- с типичными генетическими мутациями;
- с дисплазией, обусловившей изменение клеток;
- возникшие в результате лечения других заболеваний;
- с разрастанием миелоидного ростка на фоне синдрома Дауна;
- миелоидные саркомы;
- дендритноклеточные плазмацитоидные опухоли.
В зависимости от формы заболевания врач выбирает тактику лечения, так как продолжительность ремиссий и общий прогноз для разных видов имеют серьёзные отличия.
Патофизиология
Под влиянием вышеописанных этиологических факторов в организме человека происходят соматические мутации клеток-предшественниц кроветворной и лимфоидной тканей.
https://onlinelibrary.wiley.com/doi/abs/10.1046/j.1526-0968.2002.00402.x
Первый этап образования лейкемий начинается с мутации родоначальной клетки, которая приобретает способность быстро пролиферировать. Вследствие этого процесса образуются клетки, что являются их клоном.
На этапе формирования первой копии, опухоль сохраняет способность к дальнейшей дифференциации (доброкачественный опухолевый рост). Со временем, в первичного лейкозного клона происходят многочисленные мутации и изменения в структуре. В результате они не только активно пролиферируют, но и теряют способность к дифференцировке (злокачественного опухолевого роста).
И у детей, и у взрослых острый лейкоз может проявляться чрезвычайно высоким числом бластов; явление, известное как гиперлейкоцитоз. Дыхательная недостаточность, внутричерепное кровотечение и тяжелые метаболические нарушения часто возникают при острых гиперлейкоцитарных лейкозах (АГЛ) и являются основными детерминантами наблюдаемой высокой ранней смертности (от 20% до 40%).
Процесс, приводящий к этим осложнениям, давно известен как лейкостаз, но биологические механизмы, лежащие в основе его развития и прогрессирования, остаются неясными. Традиционно лейкостаз связывают с накоплением лейкозных бластов в микроциркуляции, и его лечение направлено на быстрое снижение лейкоцитоз. https://onlinelibrary.wiley.com/doi/abs/10.1046/j.1526-0968.2002.00402.x
Симптомы
В начальной стадии острого миелобластного лейкоза симптомы практически отсутствуют, с развитием болезни у пациента развиваются:
- бледность кожи и другие признаки анемии;
- кровотечения из носа и дёсен, многочисленные кровоподтёки на коже;
- повышенная температура в пределах 37-38 градусов (субфебрильная);
- обильное выделение пота по ночам;
- сыпь на коже в виде мелких красноватых пятнышек;
- одышка даже после небольших нагрузок;
- постоянные боли в костях и суставах;
- частые простудные и другие инфекции;
- увеличенные лимфоузлы;
- резкое снижение веса без видимых причин.
Стоимость лечения острого миелоидного (гранулоцитарного) лейкоза в Израиле
Цена на лечение острого миелоидного лейкоза в Израиле включает в себя стоимость всех назначенных врачом диагностических и лечебных процедур. Поэтому точная стоимость лечения острого гранулоцитарного лейкоза в Израиле может быть рассчитана только после прибытия пациента в клинику и прохождения им диагностики.
Для получения информации о стоимости тех или иных медицинских услуг клиники Ихилов Комплекс оставьте свою заявку на нашем сайте.
Преимущества лечения острого миелоидного (гранулоцитарного) лейкоза в зарубежной клинике Ихилов Комплекс
- Лечением пациентов занимаются врачи наивысшей квалификации, опыт которых позволяет им решать сложнейшие медицинские задачи.
- Оборудование клиники ставит ее на ступень выше большинства медицинских учреждений по всему миру. Благодаря техническому оснащению клиники в ее стенах проводятся сложнейшие операции, реализуются экспериментальные терапевтические методики и высокоточная диагностика.
- В клинике осуществляется лечение широкого спектра заболеваний у пациентов различного возраста, в том числе и лечение острого миелоидного (гранулоцитарного) лейкоза у детей в Израиле.
- Удобная для пациентов поэтапная система оплаты лечения.
- Каждый пациент в праве сам выбирать своего лечащего врача.
- Пациенты окружаются заботой опытного и ответственного медицинского персонала.
- Наличие высококвалифицированных специалистов, которые оказывают пациентам необходимую психологическую помощь.
- 5
- 4
- 3
- 2
- 1
(8 голосов, в среднем: 5 из 5)
Причины и факторы риска
В настоящее время неизвестно, какие именно воздействия побуждают ростки крови к злокачественным мутациям, однако онкологи хорошо изучили факторы, способствующие развитию острого миелобластного лейкоза.
- Воздействие канцерогенов. Некоторые химические соединения могут побуждать клетки к изменению. Это ряд продуктов, образующихся во время курения табака и неполного окисления жиров, многие виды промышленных выбросов, некоторые лекарственные препараты и т. д.
- Излучение. Рентгеновские лучи и другие радиоактивные, ионизирующие излучения изменяют наследственный аппарат живых клеток.
- Генетический фактор. Риск заболевания повышается в несколько раз для людей, у которых близкие родственники болели лейкозом.
- Заболевания. Некоторые болезни увеличивают вероятность рака крови. Это синдром Дауна, врождённая анемия и тромбоцитопения, нейрофиброматоз и т. д.
Причины острого лимфобластного лейкоза
Факторы риска – это то, что влияет на вероятность заболевания. На некоторые из них можно воздействовать, на другие – нет. Обозначают несколько известных факторов риска острого лимфолейкоза.
- Действие высоких уровней радиации. Лечение рака с помощью лучевой терапии также увеличивает риск лейкемии, особенно, если облучение используется в комбинации с химиотерапией.
- Влияние некоторых химических веществ, к примеру, бензола и определенных химиотерапевтических препаратов.
- Некоторые вирусные инфекции: вирус Т-клеточного лейкоза человека (HTLV-1) или вирус Эпштейна-Барра (ВЭБ).
- Наследственный фактор. Острый лимфобластный лейкоз не является наследственным заболеванием. Но существует синдромы генетического происхождения, повышающие риск болезни: синдром Дауна, Клайнфельтера, Блума, Луи-Бар (атаксия-телеангиэктазия) и анемия Фанкони.
- Этническая принадлежность: острый лимфолейкоз более распространен у белых, чем у афроамериканцев.
- Пол: заболевание несколько чаще встречается у мужчин, чем у женщин.
- Наличие близнеца повышает риск в первый год жизни.
- Неопределенные, недоказанные или спорные факторы риска: воздействие электромагнитных полей (к примеру, проживание вблизи электропередач или применение сотовых телефонов); влияние на рабочем месте химикатов (дизельного топлива, бензина, пестицидов); курение; действие краски для волос.
Причины острого лимфобластного лейкоза на данный момент неизвестны. Вероятность многих видов рака можно уменьшить, изменив образ жизни, чтобы избежать определенных факторов риска. Но нет известного способа предотвратить большинство случаев лейкемии. У основной части заболевших отсутствуют вышеупомянутые факторы риска.
Диагностика
Лабораторные анализы крови и образцов костного мозга являются основными способами диагностики острого миелобластного лейкоза. Это:
- общий анализ периферической крови;
- миелограмма;
- цитохимический анализ незрелых клеток;
- иммунофенотипирование;
- цитогенетический анализ;
- молекулярно-генетический анализ;
- HLA-типирование;
- биохимический анализ крови;
- проба Реберга;
- коагулограмма.
Кроме того, пациенту назначают инструментальные исследования внутренних органов для оценки их состояния: УЗИ брюшной полости, ЭКГ, рентген грудной клетки. Впоследствии могут быть назначены другие анализы и исследования.
Прогноз при остром лимфобластном лейкозе
Ряд исследований, связанных с лечением лейкемии, были направлены на выяснение, почему у некоторых людей больше возможностей избавиться от этого недуга, чем у других. Были найдены отличия, которые получили название – прогностические факторы. Они помогают врачам решить вопрос об объеме лечения для конкретного типа лейкоза.
- Возраст: у молодых пациентов прогноз лучше.
- Изначальное число лейкоцитов: низкий уровень на момент постановки диагноза обеспечивает лучший прогноз.
- Подтип острого лимфолейкоза: Т-клеточный лейкоз имеет лучший прогноз, чем В-клеточный.
- Генетические мутации. Транслокации между 4 и 11, а также между 9 и 22 (если не используются препараты таргетной терапии) дают хуже прогноз, чем отсутствие хромосомы 7 или наличие дополнительной хромосомы 8.
- Реакция на химиотерапевтическое лечение: пациенты, которые на четвертой-пятой неделе достигают состояния полной ремиссии после начала лечения, имеют лучший прогноз.
Кроме вышеперечисленного, оказывает влияние статус заболевания после лечения, насколько хорошо болезнь отреагировала на терапию.
- Ремиссия – это состояние, когда отсутствуют симптомы недуга. В составе костного мозга показатель лимфобластных клеток составляет менее 5%, уровень лейкоцитов — в пределах нормы. Молекулярная ремиссия подтверждается лабораторной диагностикой – ПЦР.
- Минимальная остаточная болезнь свидетельствует о состоянии, когда стандартные лабораторные тесты не выявляют лейкозных клеток, но их обнаруживает цитометрия или ПЦР. Пациенты с данным статусом имеют риск рецидива и более плохой прогноз.
- Активная болезнь указывает на признаки присутствия лейкоза или вероятности рецидива после терапии.
В Израиле проводятся активные клинические испытания новых методов лечения лейкоза. Существует возможность участия в них для пациентов.
Лечение
Основным методом лечения острого миелобластного лейкоза является химиотерапия, которая проводится в два этапа:
- индукция — снижение количества незрелых клеток для достижения ремиссии;
- консолидация — максимальное продление ремиссии, предотвращение рецидивов, устранение остаточных явлений.
Интенсивная терапия, применяемая на этапе индукции, позволяет достигнуть ремиссии примерно в 70% клинических случаев. Но заканчивать на этом лечение категорически не следует, так как без программы консолидации у пациентов практически всегда спустя некоторое время наступает рецидив.
Консолидационный этап, в зависимости от состояния больного, включает до пяти курсов химиотерапии. Если риск рецидива достаточно высок, проводится пересадка костного мозга и/или стволовых клеток кроветворения. Лучшими донорами считаются родные братья и сёстры, особенно однояйцевые близнецы.
Кроме того, пациентам часто назначают введение эритроцитарной массы, трансфузионную терапию (переливания крови и её препаратов). Тактика лечения обычно выбирается в соответствии с возрастом пациента. Ремиссия считается достигнутой, если количество миелобластных клеток в костном мозге удаётся снизить до 20% и менее.
благотворительный фонд
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обуславливает основные симптомы заболевания.
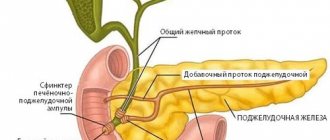
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты и другие клетки крови относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других клеток (такие лейкозы называют миелобластными, миелоидными или просто миелолейкозами).
Острый миелоидный лейкоз (ОМЛ, острый миелобластный лейкоз, острый миелолейкоз, острый нелимфобластный лейкоз) – заболевание, сравнительно редко встречающееся у детей, однако с возрастом частота его возрастает. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «миелоидный» (см. выше) означает, что незрелые клетки, составляющие основу болезни, принадлежат к так называемой миелоидной линии кроветворения. Эти клетки – как правило, миелобласты и их потомки, но возможно и присутствие других видов бластных клеток.
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
* М0 (ОМЛ с минимальной дифференцировкой): <5% всех случаев ОМЛ * М1 (ОМЛ без созревания): 15-20% * М2 (ОМЛ с признаками созревания): 20-30% * М3 (Острый промиелоцитарный лейкоз): 10-15% * М4 (Острый миеломоноцитарный лейкоз): 20-25% * М5 (Острый моноцитарный лейкоз): 5-10% * М6 (Острый эритроидный лейкоз): <5% * М7 (Острый мегакариоцитарный лейкоз): 3-10%
Некоторые очень редкие варианты ОМЛ не включены в этот список. Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
Частота встречаемости, факторы риска
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, где пик заболеваемости наблюдается в детском возрасте, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний). Иногда наблюдаются и случаи заболевания ОМЛ среди близких родственников, что говорит об определенной роли генетической предрасположенности. Но конкретные генетические особенности, повышающие риск развития лейкоза, во многих случаях пока не удается выделить, хотя исследования постоянно ведутся.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Тогда говорят о вторичном лейкозе. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и др.
Признаки и симптомы
ОМЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Ведущими, как правило, являются признаки анемии: утомляемость, бледность, одышка, снижение аппетита. Недостаток тромбоцитов проявляется повышенной кровоточивостью при порезах и ушибах, носовыми кровотечениями, «беспричинным» появлением синяков и кровоподтеков. Нередко встречаются устойчивые к лечению инфекции, так как у больного для борьбы с ними слишком мало «нормальных» (зрелых) лейкоцитов. Может возникнуть поражение слизистых оболочек рта и желудочно-кишечного тракта, припухлость десен. Нередко повышена температура тела, ощущаются боли в костях. Иногда возникают опухоли из лейкемических клеток вне костного мозга – миелосаркома.
Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
Диагностика
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, нередко избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Для лечения и оценки прогноза заболевания важно не только подтвердить диагноз «лейкоз», но и различить острый лимфобластный лейкоз и ОМЛ, разграничить лейкоз и миелодиспластический синдром, а также определить конкретный вариант ОМЛ (см. выше). Для этой цели применяется не только морфологическое исследование клеток (микроскопическое исследование специальным образом окрашенных препаратов), но и цитохимический анализ, а также иммунофенотипирование (изучение белков-антигенов на поверхности клеток). Цитогенетические исследования применяются для обнаружения хромосомных перестроек – в первую очередь транслокаций, имеющих большое значение для определения варианта болезни и прогноза. Возрастающую роль играют и молекулярно-генетические анализы.
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии будет планироваться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
- Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
- Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные цитогенетические изменения изменения связаны с ухудшением прогноза.
- Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
- С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также повышается при рецидиве лейкоза.
Лечение
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Индукция ремиссии – интенсивная терапия, направленная на достижение ремиссии лейкоза. При большинстве вариантов ОМЛ индукция ремиссии производится при помощи интенсивной химиотерапии с использованием цитарабина (цитозара) и лекарств антрациклинового ряда (даунорубицин, идарубицин), иногда с добавлением других препаратов – например, этопозида или митоксантрона.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота) или других лекарств с похожим действием (триоксид мышьяка).
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток (на фоне восстановления кроветворения) и у пациента нет других проявлений болезни, то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, в том числе высокодозный; к нему часто добавляются другие препараты в разных сочетаниях.
При лечении рецидивов ОМЛ часто используются режимы химиотерапии, включающие в себя флударабин.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Иногда при ОМЛ к терапии добавляются современные таргетные препараты. Конкретные лекарства зависят от генетических особенностей опухолевых клеток. Например, при определенной генетической поломке эффективен препарат сорафениб.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Но иногда она встречается, чаще у детей при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала.
Для снижения вероятности рецидива части пациентов показана трансплантация костного мозга. При ОМЛ она используется чаще, чем при остром лимфобластном лейкозе. Показаниями к трансплантации могут служить, например,
- вариант болезни, связанный с более высоким риском (см. выше),
- цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
- рецидив лейкоза,
- вторичный ОМЛ, развившийся на фоне миелодиспластического синдрома или другой болезни крови, или же после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны. Постоянно ведется работа над совершенствованием режимов трансплантации.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до (в случае варианта М3) 2-3 лет.
Постоянно появляются новые таргетные лекарства, которые помогают излечивать больных со сложными случаями ОМЛ. Так, некоторым пациентам помогает венетоклакс («Венклекста») и/или даратумумаб («Дарзалекс»). Иногда используется конъюгированный препарат гемтузумаб озогамицин («Милотарг»). Кроме того, совершенствуются протоколы трансплантации костного мозга.
Прогноз
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретного варианта лейкоза, хромосомных особенностей лейкемических клеток, возраста, общего состояния больного и других факторов.
В настоящее время медицина в развитых странах способна излечить более 65% детей, заболевших ОМЛ. В частности, постоянно улучшаются результаты трансплантации костного мозга. В среднем и пожилом возрасте, к сожалению, вероятность излечения существенно ниже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Лишь у меньшинства пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для продления жизни и улучшения ее качества.